海蒿子多糖的结构组分及生物活性研究
李溢真, 于志洋, 田 欣, 宋 琳, 3
海蒿子多糖的结构组分及生物活性研究
李溢真1, 于志洋1, 田 欣2, 宋 琳2, 3
(1. 青岛农业大学 生命科学学院, 山东 青岛 266109; 2. 青岛科技大学 海洋科学与生物工程学院, 山东 青岛 266071; 3. 无穷食品有限公司, 广东 饶平 515726)
采用水提醇沉法制备海蒿子多糖, 利用红外光谱法(FT-IR)和PMP柱前衍生化法研究海蒿子多糖的理化特性及糖元组成, 并采用实时荧光定量PCR法和ELISA法, 研究免疫相关因子和细胞凋亡相关因子的mRNA表达。结果表明, 海蒿子多糖总糖含量为24.32%, 硫酸根含量为5.39%, 具有α糖苷键。单糖分析表明, 海蒿子多糖主要由半乳糖、岩藻糖、甘露糖组成。进一步体外免疫实验结果表明, 海蒿子多糖具有促进小鼠巨噬细胞RAW264.7增殖的作用, 能够提高巨噬细胞系免疫因子IL-1β、IL-6、iNOS和TNF-α的mRNA表达量。此外, 海蒿子多糖还能抑制肺癌细胞A549的增殖, 提高Bax/Bcl-2的比例, 说明其具有抑制肿瘤的效果。ELISA分析表明, 海蒿子粗多糖能显著提高RAW264.7分泌NO、IL-1β、TNF-α和IL-6细胞因子。因此, 海蒿子多糖不仅具有免疫增强活性, 还具有一定的抗肿瘤活性。
海蒿子; 多糖; 理化性质; 免疫活性
海蒿子()属于褐藻门(Rhaeophyta), 马尾藻科(Sargassaceae), 马尾藻属(),生长于潮间带的石沼中和大干潮线下1~4米深处的岩石上, 为多年生海藻[1]。
《中药大辞典》记载, 海蒿子性苦、咸、寒, 入肺、脾、肾经, 具有软坚、消痰、利水、泻热之功效, 可用于治疗瘰疠、瘿瘤、积聚、水肿、脚气和睾丸肿痛等病症[2]。方飞等[3]证实海蒿子多糖对-OH清除率为26%, 对O2–的清除率为80%, 对过氧化脂的抑制率为40%, 具有明显的抗氧化作用。张华峰等[4]研究表明, 海蒿子活性多糖能明显降低高血脂小鼠血清中总胆固醇、甘油三酯的含量。刘斌[5]用不同的提取温度和不同浓度的乙醇醇沉可以获得性质不同的褐藻糖胶; 通过离子交换和凝胶柱层析技术分离获得电荷、分子量均单一的褐藻糖胶组分, 并通过MTT法发现多糖对肿瘤细胞A549, P388具有一定的生长抑制作用。郭利民[6]以小鼠乳腺癌tsFT210细胞、小鼠白血病P389细胞和人白血病K562细胞为材料, 采用流式细胞术、细胞增殖抑制实验及细胞形态学等方法, 对分离得到的14个化合物进行抗肿瘤活性的初步评价, 发现海蒿子具有一定抗肿瘤作用。Cao等[7]研究微波辅助水相两相萃取用于同时提取和分离海蒿子多糖, 表现出较好的α-淀粉酶和α-葡萄糖苷酶抑制活性, 并且可以显著改善胰岛素抗性模型细胞中的葡萄糖消耗。然而, 关于水提醇沉法获得海蒿子多糖的免疫活性和抗肿瘤活性的机理报道甚少。本文就海蒿子粗多糖的结构组分、免疫活性和抗肿瘤活性进行研究, 并探讨其免疫活性和抗肿瘤活性的机理, 为进一步探究海蒿子粗多糖的生物活性提供一定理论支持。
1 材料与方法
1.1 材料与试剂
海蒿子保存于中国科学院海洋研究所, 肺癌细胞A549、小鼠巨噬细胞 RAW264.7来自中国水产科学院黄海水产研究所。
氯仿、苯酚、浓硫酸、氯化钡(分析纯, 国药集团化学试剂有限公司), 甘露糖、葡萄醛酸、鼠李糖、半乳糖、木糖、核糖标准品, 葡萄糖标准品、硫酸钾标准品(美国Sigma 公司)、1-苯基-3甲基-5吡唑啉酮(PMP)、胰蛋白酶、DMEM培养基、RPMI 1640培养基、磷酸缓冲液、二甲基亚砜(北京索莱宝科技有限公司), Gibco胎牛血清(ThermoFisher scientific公司), 甲醇, 乙腈(色谱纯, 德国Merck公司), CCK-8试剂盒(尚宝生物科技有限公司), 明胶(天津市北辰方正试剂厂), 一氧化氮(NO)检测试剂盒(南京建成生物工程研究所), 鼠源IL-1β、TNF-α和IL-6 ELISA试剂盒(上海朗顿科技有限公司)。
1.2 仪器与设备
3 500 Da透析袋(北京索莱宝科技有限公司), 万能粉碎机(FW100, 天津市泰斯特仪器有限公司), 旋转蒸发仪(RE-5205, 上海亚荣仪器有限公司), 多管架平衡离心机(TDZ5-WS, 湘仪离心机仪器有限公司), 冷冻干燥机(SCIENTZ-18N, 宁波新芝生物科技有限公司), 电热恒温水浴锅(HH-2, 国华电器有限公司), 傅里叶变换红外光谱仪(Thermo scientific Nicolet-360, 美国Thermo公司), 酶标仪(iMarkTM BIO-RAD, 美国BIO-RAD公司), 细胞培养箱(Thermo Forma 3110, 美国Thermo公司), 高效液相色谱仪(Shimadzu-20A, 日本岛津公司)。
1.3 海蒿子多糖的制备
跟据李俊卿等[8]的方法, 稍作改动。取适量海蒿子进行粉碎, 经过100目筛, 收集待用。量取4 200 mL蒸馏水, 加热, 保持水温在90℃左右, 称量海蒿子粉末200 g, 倒入蒸馏水中, 浸提5 h。将浸提后的混合物离心(2 000 r/min, 15 min), 弃沉淀, 取上清液, 浓缩到原体积的1/3左右, 经截留分子量为3 500 kDa的透析袋进行透析除去小分子物质, 时间为3天。然后浓缩, 醇沉(按照无水乙醇︰多糖溶液体积比 3︰1),4 ℃过夜。次日, 进行离心(4 000 r/min, 20 min), 弃上清, 收集沉淀, 冷冻干燥并收集多糖(SPPS)。
1.4 海蒿子多糖的化学成分测定
1.4.1 总糖含量
总糖含量采用苯酚-硫酸法[9]测定, 以葡萄糖为标准品, 绘制标准曲线。然后配制0.1%海蒿子多糖溶液, 取100 μL于比色管中, 加入蒸馏水至终体积为1 mL。依次加入1 mL 5%苯酚溶液, 5 mL浓硫酸, 静置30 min后, 测定485 nm处的吸光度。重复三次, 取吸光度平均值, 带入葡萄糖标准曲线, 测得海蒿子总糖含量。
1.4.2 硫酸根离子含量
以100~110℃烘烤至充分干燥的K2SO4为标准品, 绘制标准曲线, 根据Bahramzadeh[10]的方法, 海蒿子多糖酸水解后, 加氨水中和至pH 6~7。脱色并过滤, 定容至25 mL。然后再取被测样品100 μL, 加入蒸馏水至200 μL, 然后依次加入0.2 mol/L HCl 3.8 mL, 明胶BaCl2溶液1 mL, 30 min后在500 nm处比浊。最后计算SO42–的浓度。
1.5 单糖组成
根据宋琳[11]的方法, 称取10 mg海蒿子多糖于安瓿瓶中, 加入1 mL水, 1 mL 4 mol/L的三氟乙酸(TFA), 于105~110 ℃水解2~6 h。样品用NaOH中和至pH 5~6, 并定容至10 mL, 取0.2 mL样品, 加入0.2 mL核糖作为内标。从中取0.1 mL加入0.12 mL 0.5 mol/L PMP溶液和0.1 mL 0.3 mol/L NaOH溶液, 混匀, 70℃反应60 min。放至室温后, 加0.1 mL 0.3 mol/L HCl, 中和混匀, 加0.5 mL氯仿萃取, 离心(7 000 r/min, 5 min), 弃去有机层, 重复3次。吸取上清0.1 mL进行HPLC检测。色谱柱YMC-Pack ODS-AQ(250 mm×4.6 mm, 5 μm), 柱温25℃, 流速 1.0 mL/min, 检测波长254 nm, 流动相A︰0.4%三乙胺水溶液︰乙腈=9︰1。流动相B︰0.4%三乙胺水溶液︰乙腈=4︰6。
1.6 FT-IR分析
采用Seedevi[12]的方法, 称取2 mg左右的海蒿子多糖, KBr压片, 在红外光谱波数范围4 000~400 cm–1下扫描样品。
1.7 海蒿子多糖对小鼠巨噬细胞RAW 264.7的增殖作用
根据Nie等[13]的实验方法, 稍加修改。将RAW 264.7细胞以1×105个细胞/孔接种在96孔板中, 并用不同浓度(25, 50, 100, 200, 400 μg/mL)的海蒿子多糖处理, 空白对照则加入等体积的培养基, 在37℃和5% CO2下培养48小时。培养结束后弃上清, 向每个孔中加入混有20 μL CCK-8溶液的完全培养基, 并继续孵育4小时, 在450 nm下测量吸光度以评估细胞活力。细胞相对存活率计算公式为:
细胞相对存活率 = (A450实验组/A450对照组)×100%。
1.8 海蒿子粗多糖对巨噬细胞免疫因子mRNA的表达量的影响
根据王昭晶[14]的方法, 并稍作改变。实验设置空白组, 待细胞培养48 h后, 利用试剂盒提取总RNA, 反转录生成cDNA后, 选择基因IL-1β, IL-6, iNOS及TNF-β, 进行Q-PCR分析, 根据公式2–ΔΔCT计算免疫相关因子的相对表达量。反应中使用的引物和作为内源参照的β-actin基因序列如下:
β-actin: 5′-GCAGAAGGAGATCACTGCCCT-3′和5′-GCTGATCCACATCTGCTGGAA-3′;
IL-1β: 5′-GGGATGATGATGATAACCTG-3′和5′-TTGTCGTTGCTTGGTTCTCCT-3′;
IL-6: 5′-CATGTTCTCTGGGAAATCGTGG-3′和5′-AACGCAACTAGGTTTGCCGAGTA-3′;
iNOS: 5′-GGTCTTCCTGGGCTCGATCTG-3′和5′-GCCGTGGCCAACATGCTACT-3′;
TNF-α: 5′-GATCTCAAAGCAAACCAACTAGTG-3′和5′-CTCCAGCTGGAAGACTCCCAG-3′。
1.9 海蒿子多糖对A549的抑制作用
采用Wang等[15]的实验方法, 利用CCK-8检测海蒿子多糖对A549的抑制作用。将A549细胞以2×104个/mL接种在96孔板中, 每孔100 μL。同时用不同浓度(0, 25, 50, 100, 200, 400 μg/mL)的海蒿子多糖处理, 空白对照组则加入等体积培养基, 并将细胞在37℃和5%CO2下孵育48小时, 弃上清, 每孔中加入混有20 μL CCK-8溶液的完全培养基, 孵育4小时。最后, 在450 nm下测量吸光度以评估细胞活力。
1.10 肿瘤凋亡相关基因的表达
根据Wang等[16]的方法, 并稍作修改。选择基因Bcl-2和Bax用于研究细胞A549细胞的凋亡。待细胞培养48 h后, 使用总RNA提取试剂盒从A549细胞中提取总RNA, 然后进行反转录生成cDNA, 设计引物按照SYBR qPCR master Mix 试剂盒上的说明进行荧光定量PCR分析。反应中使用的引物和作为内源参照的β-actin基因序列如下:
β-actin: 5′-GCAGAAGGAGATCACTGCCCT-3′和5′-GCTGATCCACATCTGCTGGAA-3′;
Bax: 5′-GACCCGGTGCCTCAGGATGC-3′和5′-GTCTGTGTCCACGGCGGCAA-3′;
Bcl-2: 5′-ATCCAGGATAACGGAGGC-3′和5′-CAGCCAGGAGAAATCAAAC-3′。
1.11 海蒿子多糖对小鼠巨噬细胞RAW264.7分泌细胞因子的影响
将处于对数生长期的巨噬细胞RAW264.7 (1×105个/mL)接种于12孔板中, 24 h后弃去培养基, 用PBS冲洗巨噬细胞。然后, 加入含有不同浓度(25, 100, 400 μg/ mL)多糖的1 mL完全培养基。空白对照为不加多糖的培养基。培养24 h后, 收集上清液, 用ELISA试剂盒测定上清液中NO、IL-1β、TNF-α和IL-6的浓度。
2 结果与分析
2.1 化学成分及单糖组成分析
通过表1可以看出, 海蒿子多糖中总糖含量为24.32%, 硫酸根含量为5.39%。由单糖组成结果可知海蒿子多糖主要由半乳糖、岩藻糖、甘露糖组成。

表1 海蒿子多糖的化学组成及单糖摩尔比
注: Man: 甘露糖; Rha: 鼠李糖; Gal: 半乳糖; GlcA: 葡萄糖醛酸; Glc: 葡萄糖; xyl: 木糖; Fuc: 岩藻糖; Nd: 未检出
2.2 红外光谱(FT-IR)分析
如图1所示, 4 000~400 cm–1处的几个吸收峰是多糖的典型特征峰。在3 498.24 cm–1处的峰吸收带和在2 932.27 cm–1处的弱吸收峰分别是O–H和C–H的拉伸特征峰。在1 614.57 cm–1和1 418.32 cm–1处的两个特征吸收峰表示C=O的不对称伸缩振动和对称伸缩振动, 表明海蒿子多糖中存在羧基。1 255.73 cm–1处的吸收峰为S=O对称伸缩振动。1 039.92 cm–1的吸收峰归因于C–O–H变形振动[17]。831.17 cm–1处的吸收峰说明海蒿子多糖具有α糖苷键。
2.3 海蒿子多糖对小鼠巨噬细胞RAW264.7相对存活率的影响
利用CCK-8试剂盒检测不同浓度海蒿子多糖对巨噬细胞RAW264.7增殖的影响。如图2所示, 海蒿子多糖在25~400 μg/mL浓度范围内均表现出增殖效果, 与对照组相比, 增殖效果显著。在浓度为25 μg/mL时, RAW264.7的增殖率较低, 相对存活率为109.82%, 增殖率随着浓度的增加而增加, 但增加程度并不明显。在400 μg/ mL时, 增殖率达到最大, 细胞相对存活率为157.57%, 呈剂量依赖关系。
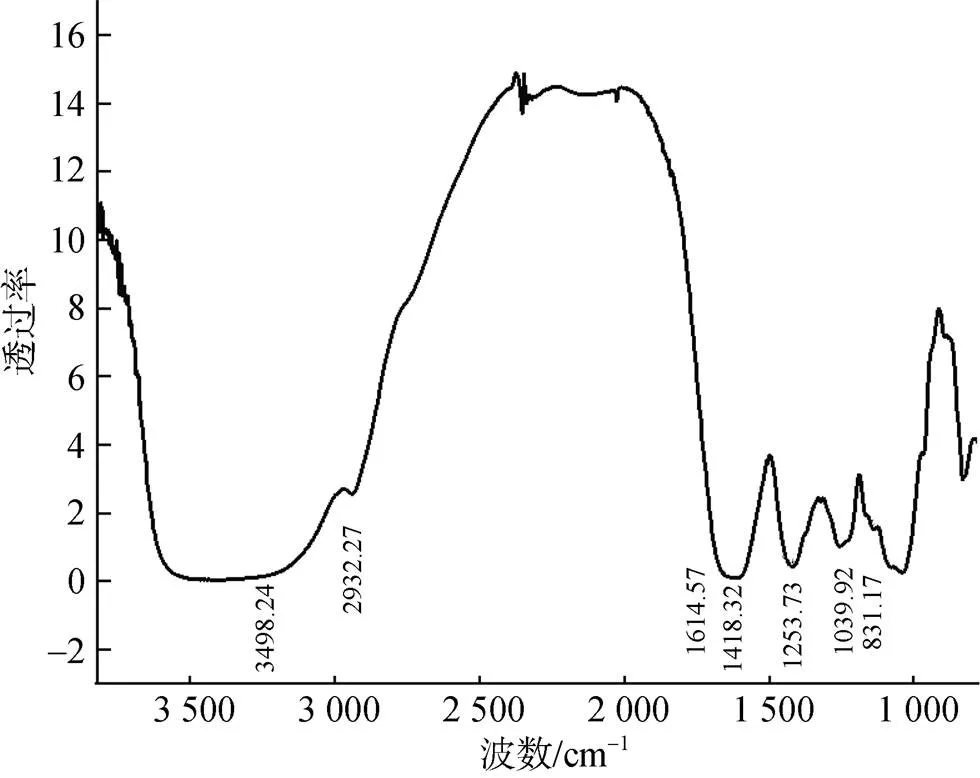
图1 海蒿子多糖的红外图谱
2.4 海蒿子多糖对免疫因子mRNA相对表达的影响
为了研究海蒿子多糖的免疫增强作用, 使用实时荧光定量PCR检测了不同浓度海蒿子多糖对iNOS, IL-6和IL-1β和TNF-β的mRNA表达的影响。图3a、b中的结果显示与对照组相比, IL-1β与IL-6的mRNA表达量均显著增加, 并呈现剂量依赖性。400 μg/mL海蒿子多糖处理后IL-1β和IL-6的mRNA表达分别是对照组的20.68倍和2.69倍。同样, 图3c、d中与对照组相比iNOS、TNF-α的mRNA表达也显著增加, 呈剂量相关关系, 多糖浓度在100 μg/mL时, iNOS、TNF-α的mRNA的表达量是分别对照组的3.16倍和2.36倍。在浓度200 μg/mL、400 μg/mL时出现mRNA表达量下降的现象, 但是与空白组相比, 依然能促进iNOS、TNF-α的mRNA表达量增加。以上结果表明, 海蒿子多糖能够促进免疫相关细胞因子mRNA的显著表达, 海蒿子多糖具有免疫增强活性。
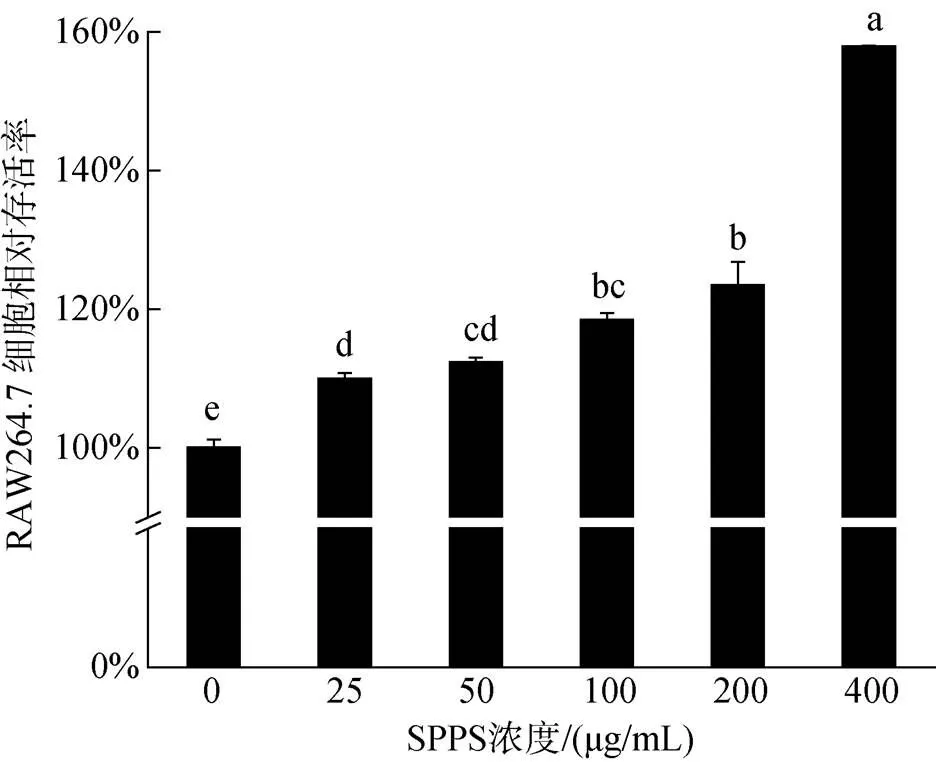
图2 SPPS对小鼠巨噬细胞RAW264.7的相对存活率的影响

图3 不同浓度SPPS对IL-1β (a)、IL-6 (b)、iNOS (c)和TNF-α (d) mRNA相对表达量的影响
2.5 海蒿子多糖对A549的抑制作用
为了研究海蒿子多糖对肿瘤细胞A549的抑制作用, 用不同浓度的海蒿子多糖处理A549, 从图4中可以看出, 海蒿子多糖的浓度在25~400 μg/mL范围内, 抑制率呈先上升后先下降的趋势。100 μg/mL时, 海蒿子多糖对A549抑制率达到40.38%。在浓度200 μg/mL时出现了抑制率首次下降的现象, 但是与空白组相比, 依然能抑制肺癌细胞A549的增殖。表明海蒿子粗多糖具有一定的抗肿瘤的效果。

图4 SPPS对A549细胞的抑制率的影响
2.6 海蒿子多糖对凋亡相关细胞因子mRNA表达的影响
通过实时荧光定量PCR检测海蒿子多糖对A549细胞中Bax, Bcl-2 mRNA的表达水平的影响。如图5所示, 海蒿子多糖浓度为25 μg/mL时, Bax/Bcl-2相对mRNA表达量的比值为1.05。海蒿子多糖浓度为100 μg/mL时, Bax/Bcl-2相对mRNA表达量的比值为2.10。海蒿子多糖浓度为400 μg/mL时, Bax/Bcl-2相对mRNA表达量的比值为1.91。海蒿子多糖通过提高Bax/Bcl-2相对mRNA表达量的比例抑制A549细胞的增殖, 且与CCK-8检测的结果一致。

图5 SPPS对Bcl-2(a)、Bax(b) mRNA相对表达量的影响
2.7 免疫相关因子的ELISA分析
本实验利用ELISA检测海蒿子多糖对RAW264.7产生NO含量的影响, 从图6中可以看出, 不同浓度的海蒿子多糖刺激RAW264.7产生的NO量不同, 随着糖浓度的升高, NO的含量也呈递增趋势。在400 μg/mL时, RAW264.7产生的NO含量最高为55.46 μmoL/mL, 且显著高于对照组。说明海蒿子粗多糖能显著刺激NO的分泌, 调节RAW264.7的免疫活性。
为了研究SPPS的免疫增强作用, 利用ELISA检测了不同浓度海蒿子多糖对RAW264.7分泌IL-1β(a)、TNF-α(b)和IL-6(c)的含量的影响。图7a、b、c中的结果显示与对照组相比, 添加SPPS后IL-1β、TNF-α与IL-6的浓度均显著增加, 并呈现剂量依赖性。400 μg/mL SPPS处理后IL-1β、TNF-α和IL-6的含量分别达到87.09 ng/L、1 063.15 ng/L和134.71 ng/L。结果表明, 海蒿子多糖具有免疫增强活性。
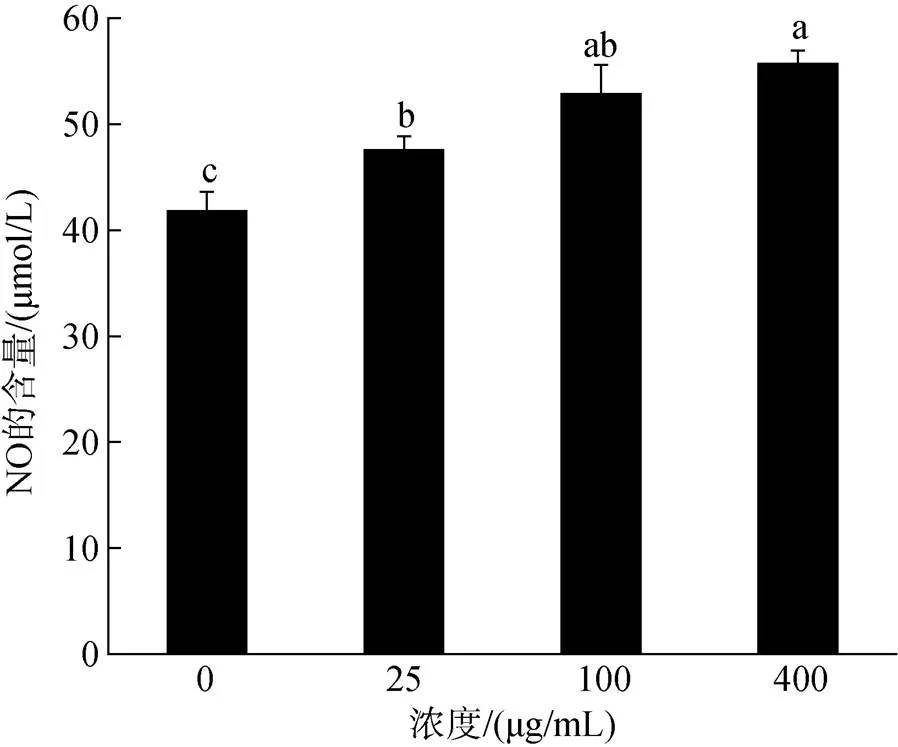
图6 SPPS对RAW264.7分泌NO的影响
3 讨论
本研究通过传统的水提醇沉法来制备海蒿子多糖, 通过化学成分分析和单糖组成分析发现海蒿子多糖含有一定量的硫酸基。Bahramzadeh等[17]研究发现, 来自马尾藻的褐藻糖胶对巨噬细胞的活化能力与硫酸基团有密切的关系。由此推测, 海蒿子多糖的免疫增强活性与其硫酸基有关。单糖组成分析结果表明, 海蒿子多糖中主要为半乳糖, 岩藻糖和甘露糖。先前的研究[18-19]已经证明多糖的生物活性取决于能否有效的与免疫细胞表面受体的结合, 而含有甘露糖的多糖最有可能被免疫细胞表面受体识别, 引发免疫反应。根据红外光谱分析结果, 海蒿子多糖中存在硫酸盐基团[20]、α糖苷键。糖结构的特征是吡喃糖结构, 同时α糖苷键与半乳糖4-硫酸盐相匹配[21],这与单糖组成分析一致。刘玮等[22]研究发现具有α-糖苷键的姬松茸多糖具有抗炎症的效果。由此推测, 海蒿子多糖的免疫活性与其含有的硫酸基团以及α糖苷键有关。本研究证明, 海蒿子粗多糖具有一定的免疫增强活性效果。
巨噬细胞与中性粒细胞一起, 构成了宿主防御的第一道防线[23]。其中, 巨噬细胞释放各种炎症物质和细胞免疫因子, 如NO, IL-1β, TNF-α和IL-6等, 都是宿主免疫过程中抵抗外来和内部微生物、病原体和细胞所必需的[24]。iNOS是NF-κB诱导的关键产物[25], 已有研究表明多糖激活巨噬细胞, Toll样受体(Toll-like receptors, TRL)接受信号, 激活NF-κB中的转录因子, 从而使细胞产生一系列的免疫反应[26]。NO是免疫和炎症调节的中介物, 可以杀死或抑制许多微生物的生长; NO的合成是巨噬细胞非特异性免疫的重要机制, 参与各种生理和病理过程[27]。IL-1β、IL-6、IL-10和TNF-α等发挥机体的免疫功能, 巨噬细胞在先天性免疫中发挥着重要的作用[28]。海蒿子多糖刺激小鼠巨噬细胞RAW264.7, 促进其增殖, 并显著提高了免疫相关因子IL-1β, IL-6, iNOS和TNF-α的mRNA相对表达量。刺激小鼠巨噬细胞RAW264.7释放NO和分泌细胞因子等。本实验结果表明海蒿子多糖具有较好的免疫增强活性, 在提高机体免疫功能上具有一定研究价值。

图7 SPPS对RAW264.7分泌IL-1β(a)、TNF-α(b)和IL-6(c)的影响
Bcl-2蛋白家族通过凋亡与抗凋亡蛋白之间的相互作用与线粒体凋亡途径密切相关。Bcl-2位于线粒体外膜上发挥重要作用并防止细胞凋亡。Bax是位于细胞质基质中的促细胞凋亡因子, 当被凋亡信号刺激时, 它在线粒体上被激活, 破坏线粒体膜的完整性并促进细胞凋亡[29]。细胞凋亡激活后Bcl-2与Bax的比例决定了细胞的存活或死亡, Bax表达占优势时细胞死亡, Bcl-2 表达占优势时细胞存活[30]。本研究发现海蒿子多糖可以抑制肺癌细胞的增殖, 并提高Bax/Bcl-2的比例, 表明海蒿子多糖可以通过促进肿瘤细胞凋亡达到抗肿瘤的效果, 在抗肿瘤方面具有一定的活性。
本研究通过海蒿子多糖的结构组分分析, 揭示了其单糖组成和糖苷键组成; 以及通过海蒿子多糖对RAW264.7的影响, 表明海蒿子多糖不仅能刺激巨噬细胞, 使TNF-α, iNOS, IL-6和IL-1β的mRNA表达增强, 刺激小鼠巨噬细胞RAW264.7释放NO和分泌细胞因子等。起到良好的免疫增强作用; 还能抑制肿瘤细胞的增殖, 具有一定的抗肿瘤效果。
[1] Xiao H, Chen C, Li C, et al. Physicochemical characterization, antioxidant and hypoglycemic activities of selenized polysaccharides from[J]. International Journal of Biological Macromolecules, 2019, 32: 308-315.
[2] 赵宇, 张立新, 李志富, 等. 中药海蒿子多糖的分离纯化及结构研究[J]. 山东农业大学学报(自然科学版), 2005(2): 247-250. Zhao Yu, Zhang Lixin, Li Zhifu, et al. Isolation, purifycation and structure study of polysaccharides from Chinese medicine[J]. Journal of Shandong Agricultural University (Natural Science Edition), 2005(2): 247-250.
[3] 方飞, 唐志红. 海蒿子多糖的抗氧化活性研究[J]. 安徽农业科学, 2011, 39(16): 9590-9591. Fang Fei, Tang Zhihong. Study on antioxidant activity ofpolysaccharide[J]. Anhui Agricultural Sciences, 2011, 39(16): 9590-9591.
[4] 张华锋, 高征, 罗亚飞, 等. 海蒿子活性多糖降血脂作用的研究[J]. 中成药, 2009, 31(12): 1925-1927. Zhang Huafeng, Gao Zheng, Luo Yafei, et al. Study on the hypolipidemic effect of active polysaccharides of[J]. Traditional Chinese Medicine, 2009, 31(12): 1925-1927.
[5] 刘斌. 中药海藻海蒿子多糖的分离与鉴定及其抗肿瘤活性初步研究[D]. 青岛: 中国海洋大学, 2005. Liu Bin. Isolation and identification of polysaccharides from the Chinese herb seaweedand preliminary study on its anti-tumor activity[D]. Qingdao: Ocean University of China, 2005.
[6] 郭立民. 中药海藻海蒿子的抗肿瘤活性成分研究[D]. 青岛: 中国海洋大学, 2006. Guo Limin. Research on anti-tumor active ingredients of[D]. Qingdao: Ocean University of China, 2006.
[7] Cao C, Huang Q, Zhang B, et al. Physicochemical characterization andhypoglycemic activities of polysaccharides fromby microwave-assisted aqueous two-phase extraction[J]. International Journal of Biological Macromolecules, 2018, 109: 357- 368.
[8] 李俊卿, 赵宇, 李志萍, 等. 海蒿子多糖DEI、DEII组分分离纯化、结构及抗癌活性研究[J]. 天然产物研究与开发, 2005(5): 35-38. Li Junqing, Zhao Yu, Li Zhiping, et al. Separation, purification, structure and anticancer activity of thepolysaccharide DEI and DEII[J]. Natural Product Research and Development, 2005(5): 35-38.
[9] Dubois M, Gilles K, Hamilton J K, et al. Colorimetric method for the determination of sugars and related substances[J]. Analytical Chemistry, 1956, 28: 350-356.
[10] Bahramzadeh S, Tabarsa M, You S, et al. Purification, structural analysis and mechanism of murine macrophage cell activation by sulfated polysaccharides from[J]. Carbohydrate Polymers, 2019, 205: 261-270.
[11] 宋琳. 几种大型海藻硫酸多糖免疫相关活性及转录组学研究[D]. 青岛: 中国科学院大学(中国科学院海洋研究所), 2016.Song Lin. Immunomodulatory-related activity and RNA- Seq research of six macroalgaes’ sulfated polysaccharides[D]. Qingdao: University of Chinese Academy of Sciences (Institute of Oceanology, Chinese Academy of Sciences), 2016.
[12] Palaniappan S, Meivelu M, Sadhasivam S. Isolation and chemical characteristics of rhamnose enriched polysaccharide from[J]. Carbohydrate Polymers, 2018, 195: 261-270.
[13] Nie C, Zhu P, Ma S, et al. Purification, characterization and immunomodulatory activity of polysaccharides from stem lettuce[J]. Carbohydrate Polymers, 2018, 188: 236-242.
[14] 王昭晶, 罗巅辉, 聂开颖. 网格状与线状鼠尾藻多糖抗炎作用研究[J]. 中国海洋药物, 2019, 38(2): 17-23. Wang Zhaojing, Luo Dianhui, Nie Kaiying. Study on the anti-inflammatory effects of the polysaccharides ofandlinear[J] .Marine Medicines of China, 2019, 38(2): 17-23.
[15] Wang C, Zhu J, Ma J, et al. Functionalizedstriata polysaccharide micelles for targeted intracellular delivery of Doxorubicin:andevaluation[J]. International Journal of Pharmaceutics, 2019, 567: 118- 436.
[16] Wang Y, Wang S, Song R. Ginger polysaccharides induced cell cycle arrest and apoptosis in human hepatocellular carcinoma HepG2 cells[J]. International Journal of Biological Macromolecules, 2019, 123: 81-90.
[17] Saman B, Mehdi T, Sangguan Y, et al. Purification, structural analysis and mechanism of murine macrophage cell activation by sulfated polysaccharides from[J]. Carbohydrate Polymers, 2018, 205: 261-270.
[18] Souza B W S, Cerqueira M A, Bourbon A I, et al. Chemical characterization and antioxidant activity of sulfatedpolysaccharide from the red seaweed[J]. Food Hydrocolloids, 2012, 27: 287-292.
[19] Meng Q, Wang Y, Chen F, et al. Polysaccharides from: Extraction optimization, antitumor, and immune-enhancement effects[J]. International Journal of Biological Macromolecules, 2018, 115: 835-845.
[20] Li C, Li X, You L, et al. Fractionation, preliminary structural characterization and bioactivities of polysaccharides from[J]. Carbohydrate Polymers, 2017, 155: 261-270.
[21] Wongpraserta K, Rudtanatipa T, Praiboonb J. Immunostimulatory activity of sulfated galactans isolated from the red seaweedand development of resistance againstwhite spot syndrome virus (WSSV) in shrimp[J]. Fish & Shellfish Immunology, 2014, 36: 52-60.
[22] Chen C, You L J, Abbasi A M, et al. Optimization for ultrasound extraction of polysaccharides from mulberry fruits with antioxidant and hyperglycemic activity in vitro[J]. Carbohydrate Polymers, 2015, 130: 122-132.
[23] Jackaman C, Tomay F, Duong L, et al. Aging and cancer: The role of macrophages and neutrophils[J]. Ageing Research Reviews, 2017, 36: 105-116.
[24] Yan J, Han Z, Qu Y, et al. Structure elucidation and immunomodulatory activity of a β-glucan derived from the fruitingbodies of[J]. Food Chemistry, 2018, 240: 534-543.
[25] Wang L, Li Y, Zhu L, et al. Antitumoractivities and immunomodulatory of rice bran polysaccharides and its sulfates in vitro[J]. International Journal of Biological Macromolecules, 2016, 88: 424-432.
[26] Liu X, Wang X, Xu X, et al. Purification, antitumor and anti-inflammationactivities of an alkali-soluble and carboxymethyl polysaccharide CMP33 from[J]. International Journal of Biological Macromolecules, 2019, 127: 39-47.
[27] Shu Y, Liu X, Ma X, et al. Immune response mechanism of mouse monocytes/macrophages treated with κ-carrageenan polysaccharide[J]. Environmental Toxicology and Pharmacology, 2017, 53: 191-198.
[28] Xie S, Hao R, Zha X, et al. Polysaccharide of Dendrobium huoshanense activates macrophages via toll- like receptor 4-mediated signaling pathways[J]. Carbohydrate Polymer, 2016, 146: 292-300.
[29] Chen P, Liu H P, Ji H H. A cold-water soluble polysaccharideisolated frominduces the apoptosis of HepG2 cells through mitochondrial passway[J]. International Journal of Biological Macromolecules, 2019, 125: 1232-1241.
[30] 陈玉燕, 李红玲, 赵龙. 不同压力高压氧对脑出血大鼠Bcl-2/Bax比值的影响[J]. 中国康复医学杂志, 2019, 34(1): 16-21. Chen Yuyan, Li Hongling, Zhao Long. Effect of hyperbaric oxygen at different pressures on Bcl-2/Bax ratio in rats with cerebral hemorrhage[J]. Chinese Journal of Rehabilitation Medicine, 2019, 34(1): 16-21.
Physicochemical properties and immunomodulatory activities of crude polysaccharides isolated from
LI Yi-zhen1, YU Zhi-yang1, TIAN Xin2, SONG Lin2, 3
(1. College of Life Sciences, Qingdao Agricultural University, Qingdao 266109, China; 2. College of Marine Science and Biological Engineering, Qingdao University of Science and Technology, Qingdao 266071, China; 3. Wuqiong food Co., Ltd, Raoping 515726, China)
polysaccharides (SPPS), a group of natural polysaccharides, were isolated fromthrough water extraction and alcohol precipitation. Infrared spectroscopy (FT-IR) and 1-phenyl-3-methyl-5-pyrazolone (PMP) pre-column derivatization were employed to study the physical and chemical properties, as well as the monosaccharide composition of SPPS. Quantitative real-time Polymerase Chain Reaction (qRT-PCR) and enzyme linked immunosorbent assay (ELISA) techniques were employed to study the mRNA expression of immune-related and apoptosis-related factors. The total sugar content of SPPS was 24.32%, while the sulfate content was 5.39%. The FT-IR spectra analysis indicated that SPPS contain sulfuric acid groups and has α-glycosidic bonds. In regard to the monosaccharide composition, the most abundant components in SPPS were galactose, fucose, and mannose. Bioassays indicated that SPPS significantly enhance the proliferation of RAW264.7 macrophage cells and also stimulate the corresponding mRNA expression of iNOS and interleukins (IL-6, IL-1β, and TNF-α) in a dose-dependent manner. In addition, SPPS effectively suppressed the proliferation of A549 cells and increase the ratio of Bax/Bcl-2, indicating its anti-proliferative activity against A549 cells. The ELISA analysis revealed that the crude SPPS significantly increased the production of NO, IL-1β, TNF-α, and IL-6 cytokines in RAW264.7 cells. These results indicate that SPPS demonstrated both immunomodulatory and anti-tumor activities.
; polysaccharides; physicochemical properties; immunomodulatory activity
Apr. 18, 2020
R932
A
1000-3096(2020)11-0010-09
10.11759/hykx20200418002
2020-04-18;
2020-04-29
山东省自然基金(ZR201702170401); 青岛科技大学2019年创新训练计划项目(201910426018)
[Natural Foundation of Shandong Province, No. ZR201702170401; 2019 The Innovative Entrepreneurial Training Plan Program of Qingdao University of Science & Technology, No. 201910426018]
李溢真(1991-), 女, 汉族, 山东济南人, 硕士研究生, 研究方向为海洋活性物质, E-mail: lyzliyizhen@163.com; 宋琳(1987-),通信作者, 女, 汉族, 山东青岛人, E-mail: lylinsong@hotmail.com
(本文编辑: 杨 悦)

