外源脯氨酸对Cd胁迫下107杨光合与叶绿素荧光特性的影响
赵串串, 侯文涛, 温怀峰, 汲绍文, 王 雪, 余登举
陕西科技大学环境科学与工程学院, 陕西 西安 710021
近年来,植物修复技术为解决土壤Cd污染提供了一条全新治理途径而备受人们关注[1]. 研究发现,木本植物中速生的杨柳科具有生物量大、根系发达、对Cd耐性好、经济可行、抑制Cd污染向食物链中转移等优势,故将其应用于Cd污染土壤的修复具有良好的前景[2-3]. 当前,利用杨树修复Cd污染的研究主要集中于低浓度Cd胁迫对杨树光合作用[4]及叶绿素荧光参数[5]、叶片渗透调节物质[6]、干物质分配的影响[7],而关于外源添加物下杨树对高浓度Cd胁迫的光合生理响应研究较少[8].
脯氨酸是植物体内水溶性最大的氨基酸,也是干旱、高温、高盐、冰冻、紫外光照射和重金属等逆境胁迫下植物体内积累的主要渗透调节物质[9-10],外源脯氨酸可以提高逆境胁迫下植物的抗氧化能力,促进植物生长,从而提高植物耐受能力[11-12]. 目前,关于外源脯氨酸缓解Cd对植物的胁迫研究主要集中在较低浓度Cd对小麦[13]、白菜[14]和稻谷[15]等农作物生理影响的研究,而高浓度Cd胁迫下外源脯氨酸对杨树光合生理指标的影响还有待进一步揭示,因此该文以107杨苗木为试验材料,基于叶绿素荧光技术,探讨高浓度Cd胁迫下外源脯氨酸对107杨叶片光合气体交换参数、叶绿素荧光特性的影响,以期从光合生理角度阐明外源脯氨酸对107杨抗Cd胁迫的调节机制,进一步提高107杨的耐Cd能力,将其应用于矿区高浓度Cd污染土壤修复具有重要的现实意义.
1 材料与方法
1.1 供试材料
试验材料107杨(Populus×euramericanacv. ‘7476’)采自陕西省杨凌示范区,2018年3月上旬将地径约1 cm的一年生107杨苗木截成长20 cm的枝条,在自然光放置于Hoagland营养液[16]中水培,每2 d换一次营养液,15 d后选择长势一致的苗木移栽到内径30 cm、深40 cm的塑料盆中,1株盆,生长基质采用田园土(每盆6 kg). 苗木移栽后,每天对所有供试植株统一浇蒸馏水,消除水分胁迫的影响,每周添加100~200 mL Hoagland营养液保证养分供给,1个月后选择生长势均匀的107杨实生苗进行外源脯氨酸处理和Cd胁迫处理.
1.2 试验处理
根据前期试验研究和相关文献[17]报道,土壤中w(Cd)为100 mgkg左右时会对107杨光合作用产生明显胁迫. 为此该试验设计2个试验因素,即外源脯氨酸处理和Cd胁迫处理,其中,外源脯氨酸处理设3个水平——0、10和20 mmolL,Cd胁迫处理设4个水平——0、100、200和300 mgkg. 试验共设12个处理,分别记为0Cd+0Pro(对照)、0Cd+10Pro、0Cd+20Pro、100Cd+0Pro、100Cd+10Pro、100Cd+20Pro、200Cd+0Pro、200Cd+10Pro、200Cd+20Pro、300Cd+0Pro、300Cd+10Pro和300Cd+20Pro,每个处理均设5次重复,共计60盆. Cd胁迫处理是以分析纯CdCl2·2.5H2O 配置成相应浓度的Cd溶液施入盆栽土壤中,外源脯氨酸处理是以每天傍晚在107杨苗木叶面喷施等量的去离子水或不同浓度的脯氨酸进行,处理期间每隔1 d更换处理液,以叶面刚好完全打湿为标准,每天对所有供试植株进行统一管理,采用质量差减法使各处理保持相同的土壤含水量. 2018年6月中旬测定苗木叶片光合气体交换参数和叶绿素荧光参数.
1.3 测定指标和方法
1.3.1气体交换参数的测定
2018年6月中旬选择晴朗的天气,于09:00—11:00进行光合参数测定. 使用LI-6400便携式光合仪(LI-Cor Inc.,USA)测定107杨叶片在光强1 200 μmol(m2·s)下的叶片净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)等参数. 107杨苗叶片木水分利用效率(WUE)的计算公式为WUE=PnTr[18]. 测定过程中的环境状况:气温为(22.45±2.31)℃,相对湿度为57.13%±2.45%,空气中CO2浓度为(379.51±13.25)μmolmol. 各处理均测定5次,结果取其平均值.
1.3.2光合光响应曲线的测定
2018年6月中旬选择晴朗的天气,于09:30—11:00选取107杨苗木中长势一致的成熟叶片作为测定对象,采用Li-6400便携式光合测定仪配置红蓝光源(LI-Cor Inc.,USA)测定叶片光合作用对光合有效辐射(PAR)的响应曲线,测定过程中,气体流速控制为500 μmol(m2·s),使用CO2钢瓶控制叶室CO2浓度为380 μmolmol,由温度控制器控制叶室温度为25 ℃,6400-02B LED红蓝光源提供不同PAR,PAR梯度设定为 2 000、1 800、1 500、1 200、900、700、500、300、200、100、75、50、25和0 μmol(m2·s). 在测定前,叶片先用 1 200 μmol(m2·s)的光强适应30 min,待仪器读数稳定后进入自动测量程序,测定结束后绘制净光合速率的光响应曲线(Pn-PAR),并依据直角双曲线修正模型[19],计算方法如式(1)所示. 通过SPSS 19.0 统计软件对107杨光响应曲线测量值进行非线性回归拟合,得到暗呼吸速率〔Rd,μmol(m2·s)〕、光补偿点〔LCP,μmol(m2·s)〕、最大净光合速率〔Pnmax,μmol(m2·s)〕和光合量子效率(AQY,molmol)等光合生理参数.
(1)
式中:Pn为净光合速率,μmol(m2·s);PAR为光合有效辐射,μmol(m2·s);α为光响应曲线的初始斜率;β为修正系数;γ为光饱和项;Rd为植物暗呼吸速率,μmol(m2·s).
1.3.3叶绿素荧光参数测定
采用Li-6400便携式光合测定仪配置荧光叶室6400-40于08:30—11:30对107杨叶片叶绿素荧光参数进行测定,选取与光合-光响应曲线测量相同的叶片,经过30 min暗适应后,照射检测光测定最小荧光(Fo),然后施加饱和脉冲为 7 200 μmol(m2·s)的光强照射0.8 s,测得暗适应下的最大荧光(Fm),荧光参数的计算参照Rohacek[20]的方法,PSⅡ中原初反应最大量子效率(FvFm)的计算公式为FvFm=(Fm-Fo)Fm. 用叶室内活化光将植株充分活化1 h,待仪器读数稳定后在 1 200 μmol(m2·s) 的光强下测定光适应下植株叶片的最大荧光(Fm′)、最小荧光(Fo′)和稳态荧光(Fs). 基于以上参数计算表观光合电子传递速率(ETR)、实际光化学量子效率(ΦPSⅡ)、光化学淬灭系数(qP)及非光化学淬灭系数(NPQ)等荧光参数.
1.4 数据统计与分析
采用SPSS 19.0软件进行数据分析,数据经方差分析后进行多重比较(Tukey′s法,α=0.05),采用双因素方差分析(Two-way ANOVA)来揭示Cd胁迫处理与外源脯氨酸处理及二者交互作用对107杨叶片光合与叶绿素荧光等指标的影响;采用Origin 8.6软件作图.
2 结果与分析
2.1 外源脯氨酸处理对Cd胁迫下107杨气体交换参数的影响
表1 不同Cd添加量下外源脯氨酸处理对107杨叶片光合气体交换参数的影响
Table 1 Effect of exogenous proline on photosynthetic gas exchange parameters in leaves of P. × euramericana cv.‘7476’ under different Cd addition levels

表1 不同Cd添加量下外源脯氨酸处理对107杨叶片光合气体交换参数的影响
项目w(Cd) ∕(mg∕kg)c(脯氨酸)∕(mmol∕L)Pn∕[μmol∕(m2·s)]Gs∕[mol∕(m2·s)]Tr∕[mmol∕(m2·s)]Ci∕(μmol∕mol)WUE∕(μmol∕mmol)试验处理显著性分析021.42±1.15a0.37±0.02a5.35±0.36a240.87±28.04a4.00±0.28a01021.64±1.01a0.36±0.02a5.32±0.23a242.36±20.03a4.07±0.30a2021.17±0.59a0.35±0.02a5.17±0.36a250.01±26.02a4.29±0.35a014.09±0.80b0.24±0.02b3.97±0.25b308.19±27.03b3.24±0.35b1001021.43±0.70a0.34±0.02a5.42±0.26a248.34±26.04a3.95±0.36a2020.61±1.03a0.30±0.03ab5.29±0.40a253.30±26.04a3.89±0.24ab07.91±1.04c0.14±0.02c2.30±0.35c358.12±20.02c2.70±0.25c2001017.66±0.96e0.26±0.03b4.04±0.31b310.26±25.03b3.88±0.30ab2016.30±1.20be0.30±0.03ab3.97±0.32b319.30±20.03b3.28±0.32b04.56±0.99d0.10±0.01d1.56±0.30c368.10±22.01c1.80±0.21d300107.54±0.86c0.13±0.02c1.83±0.29c362.13±20.02c2.13±0.22cd208.12±0.98c0.12±0.02cd2.00±0.19c300.12±21.02b2.01±0.30dc(脯氨酸)NSNSNSNSNSw(Cd)*******c(脯氨酸)×w(Cd)*********
注: 数据为平均值±标准差,n=15. 每列数据右侧字母相同者表示差异未达显著水平(P>0.05); 字母不同者表示差异达显著水平(P<0.05).双因素方差分析结果: NS表示无显著差异; *为P<0.05,表示差异显著; ** 为P<0.01,表示差异非常显著.
2.2 外源脯氨酸处理对Cd胁迫下107杨光响应特征参数的影响
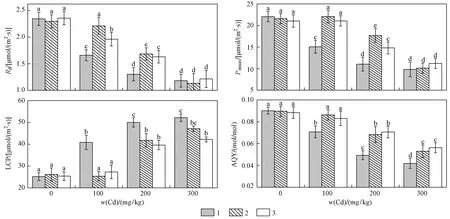
由图1可见,随着光强的增加,不同处理条件下107杨叶片Pn表现出先逐渐上升后趋于平缓的趋势. 在PAR<200 μmol(m2·s) 水平下,Pn随着光强的增强而迅速增加,当PAR>800 μmol(m2·s) 时Pn逐渐达到光饱和点. 与对照组相比,单独外源脯氨酸处理对107杨叶片光响应曲线几乎没有影响,Cd胁迫处理显著影响107杨叶片Pn的变化,使其Pn值低于对照组;与单独Cd胁迫处理对比,外源脯氨酸处理显著增加了Pn值. 在w(Cd)>200 mgkg条件下,PAR>1 800 μmol(m2·s) 时,光响应曲线下降明显,产生光抑制现象. 107杨叶片Rd、Pnmax和AQY均随着胁迫强度的增加逐渐下降,在w(Cd)<200 mgkg、单独脯氨酸处理下,各处理组107杨叶片的光响应参数均无显著差异(P<0.05).
由图2可见,与单独Cd胁迫处理组相比,外源脯氨酸处理显著提高了植株Pnmax、Rd和AQY,降低了LCP,提高了光能利用效率. 双因素方差分析(见表2)表明,Cd胁迫作为独立因子显著影响了107杨叶片的光响应参数(P<0.05),而外源脯氨酸作为独立因子对光响应参数无显著影响,与单独Cd胁迫处理组相比,交互处理显著影响了植株的光响应参数(P<0.01).
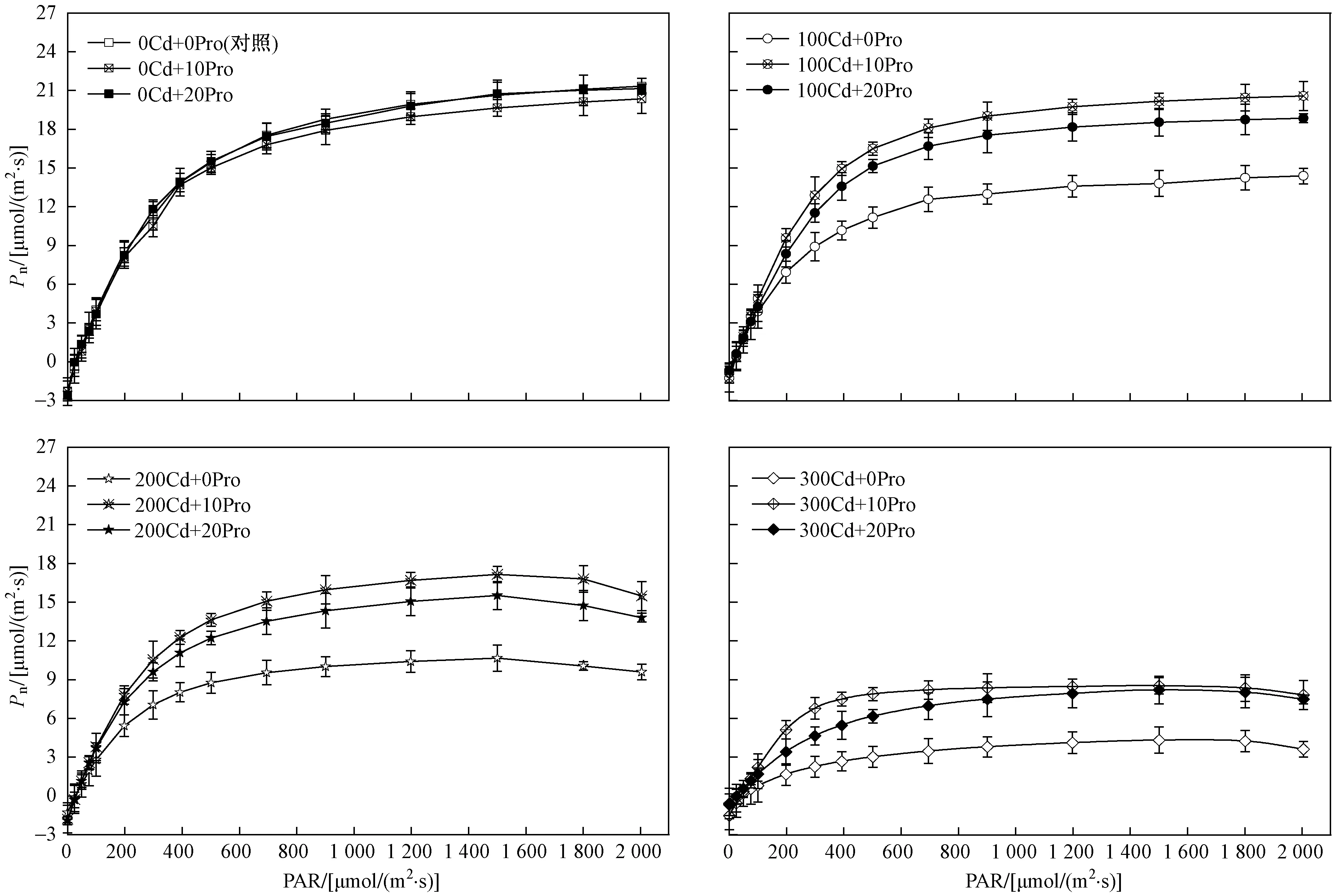
图1 外源脯氨酸处理对Cd胁迫下107杨叶片光响应曲线的影响Fig.1 Effect of exogenous proline on light response curves in leaves of P. × euramericana cv.‘7476’under Cd stress
2.3 不同浓度脯氨酸对Cd胁迫下107杨叶绿素荧光参数的影响
由图3可见,随着w(Cd)的增加,107杨叶片的FvFm、ΦPSⅡ、qP和ETR均呈下降趋势,且各处理之间差异显著(P<0.05);NPQ明显升高,与单独Cd胁迫处理组差异显著(P<0.05). 双因素方差分析(见表3)表明,Cd作为独立因子时会显著影响FvFm、ΦPSⅡ、qP、ETR和NPQ,外源脯氨酸作为单独因子时对107杨叶片叶绿素荧光参数无显著影响. 与单独Cd胁迫处理相比,交互条件下外源脯氨酸处理的植株具有更高的qP、ΦPSⅡ以及更低的NPQ.
c(脯氨酸)(mmolL): 1—0; 2—10; 3—20.
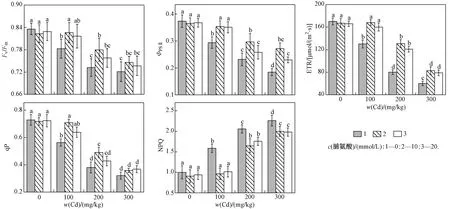
图3 外源脯氨酸处理对Cd胁迫下107杨叶片叶绿素荧光参数的影响Fig.3 Effect of exogenous proline on chlorophyll fluorescence parameters in leaves of P. × euramericana cv. ‘7476’ under Cd stress
表2 脯氨酸、Cd及其交互效应对107杨叶片光响应参数影响的显著性检验
Table 2 Statistical significance of the single and interactive of Cd, proline on light response parameters in leaves of P. × euramericana cv. ‘7476’
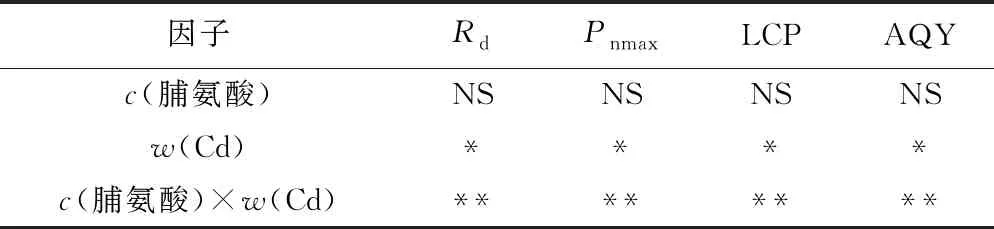
表2 脯氨酸、Cd及其交互效应对107杨叶片光响应参数影响的显著性检验
因子RdPnmaxLCPAQYc(脯氨酸)NSNSNSNSw(Cd)****c(脯氨酸)×w(Cd)********
注: *为P<0.05,表示差异显著; ** 为P<0.01,表示差异非常显著.
3 讨论
在逆境胁迫下,当植物本身产生的脯氨酸不足以消除逆境伤害时,可以使用外源脯氨酸来缓解逆境伤害[21],外源脯氨酸在增强作物对干旱、盐、高温和重金属等逆境胁迫耐性方面具有重要的作用[22]. 该研究结果表明,107杨叶片的Pn、Gs随着w(Cd)的增大而降低,同时伴随着Ci的升高,说明Cd胁迫下107杨叶片光合作用的降低是由于非气孔因素导致的. 这与冯世静等[23]对灰杨(Populus×canescens)和青杨(Populuspseudo-simonii)在Cd胁迫条件下的响应特征相似. Cd胁迫下,107杨叶片光合电子传递反应受阻,用于碳固定Rubisco羧化酶活性受到抑制,阻碍了CO2的利用,从而造成胞间CO2积累,这与高会玲等[24]对Cd胁迫下菊芋光合作用和徐小逊等[25]对Cd胁迫下豨莶光合作影响的研究结论一致,同时Cd会引起光合作用暗反应中ATP和NADPH利用率的下降[26],进而降低107杨的碳固定效率. Zouari等[27]研究发现,在土壤中施加不同浓度Cd可不同程度地降低椰枣树(PhoenixdactyliferaL.)的Pn、Gs、Tr、WUE,而外源添加20 mmolL的脯氨酸可明显缓解Cd胁迫对光合作用的抑制作用,且不同处理之间的缓解程度有所不同. 该研究结果表明,Cd胁迫下,添加外源c(脯氨酸)为10和20 mmolL后,Pn、Tr和Gs与单独Cd处理组相比均得到显著提高、Ci均降低,这与杨晓春等[28]在Cd胁迫下外源6-BA对茄子苗木生长光合特性的研究结果一致,说明外源脯氨酸可通过缓解对107杨非气孔的限制,从而促进PSⅡ在Cd胁迫下对CO2的吸收和利用,增加植物光能捕获,提高光化学效率[29],缓解Cd对光合作用的抑制作用.
表3 Cd、脯氨酸及其交互效应对107杨叶片叶绿素荧光参数影响的显著性检验
Table 3 Statistical significance of the single and interactive of Cd, proline on chlorophyII fluorescence parameters in leaves of P. × euramericana cv. ‘7476’
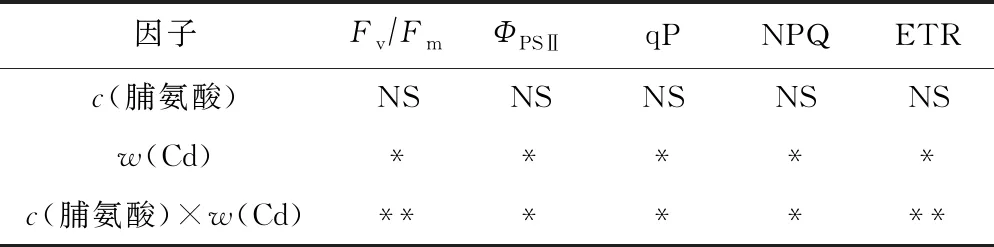
表3 Cd、脯氨酸及其交互效应对107杨叶片叶绿素荧光参数影响的显著性检验
因子Fv∕FmΦPSⅡqPNPQ ETRc(脯氨酸)NSNSNSNSNSw(Cd)*****c(脯氨酸)×w(Cd)*******
注: *为P<0.05,表示差异显著; ** 为P<0.01,表示差异非常显著.
光合光响应模型所获得的光合生理参数是甄别植物光合机构运转状况、不同生境的光合能力及适应规律的有效依据[30]. 该研究中,107杨叶片Pnmax、AQY和Rd均随着Cd胁迫的加重而显著降低,LCP显著升高,表明Cd胁迫降低了107杨叶片在强光和弱光下的光合效率和光能利用能力,107杨通过减少呼吸作用的消耗来维持自身代谢平衡,对光强具有一定的适应性,同时也可能是Cd胁迫限制了其生理活性,减少了对于能量的需求,这与郑明瑜等[31]对Cd胁迫下烟草光合作用的研究结果一致. 在w(Cd)分别为100和200 mgkg条件下,外源添加c(脯氨酸)为10 mmolL时会使107杨叶片Pnmax分别提高46.61%和60.11%,说明外源脯氨酸处理可显著缓解Cd胁迫对107杨叶片Pnmax的抑制作用. 此外,不同浓度Cd胁迫下,外源添加c(脯氨酸)为10 mmolL时均会不同程度地提高107杨叶片的AQY和Rd,降低LCP,说明外源脯氨酸处理可显著提高Cd胁迫下107杨叶片光合效率和利用弱光的能力.
在活体状态下,植物的叶绿素荧光全部由PSⅡ反应中心产生[32]. PSⅡ原初反应的FvFm和ΦPSⅡ是判断植物是否受到光抑制的重要指标,是研究植物对逆境胁迫响应的理想参数[33-34]. 正常条件下,植物通常表现出较高的FvFm和ΦPSⅡ值,可以使植物获得较高的光能转化效率,从而有利于能量的同化积累[35]. 该研究中,w(Cd)为200 mgkg时,与对照组相比,107杨叶片FvFm和ΦPSⅡ分别下降12.41%和37.88%,说明107杨叶片的原初光化学效率和从天线色素到PSⅡ反应中的传能效率明显受到Cd胁迫的影响,出现了光抑制现象. 同时,107杨叶片的qP和ETR也随w(Cd)的升高而显著降低,NPQ的变化规律则相反,这与甘龙等[36]对Cd胁迫下一年蓬(Erigeronannuus)叶绿素荧光特性的研究结果一致,说明Cd胁迫使107杨叶片的光合机构受到一定程度的伤害,PSⅡ反应中心氧化端电子传递受阻,光能转化效率以及捕获激发能的效率受到影响,用于热耗散等非光化学反应的能量增加.w(Cd)为200 mgkg时,与单独Cd胁迫处理组相比,外源添加c(脯氨酸)为10和20 mmolL下107杨ETR显著提高了63.26%和50.92%,并以c(脯氨酸)为10 mmolL处理时的效果更佳,表明外源脯氨酸处理缓解了Cd对反应中心活性的抑制作用,使光合电子链的传递速率得到一定程度的恢复,从而使植物能够维持正常的暗反应等基本生理功能.
4 结论
a) Cd胁迫对107杨光合相关生理过程的影响较为复杂. 在w(Cd)低于200 mgkg时,添加外源脯氨酸可有效促进107杨的光合作用和提高水分利用效率,从而降低高浓度Cd胁迫对107杨光合作用的抑制,且以c(脯氨酸)为10 mmolL的效果较好;在w(Cd)为300 mgkg时,107杨的生长明显受到抑制,外源脯氨酸处理虽能够起到一定缓解作用,但作用较小.
b)w(Cd)低于200 mgkg时,添加外源脯氨酸能够通过非气孔限制来提高107杨叶片ΦPSⅡ、qP和ETR,缓解Cd对反应中心活性的抑制作用,使光合电子链的传递速率得到一定程度的恢复,进而缓解Cd胁迫对107杨的伤害,在矿区高浓度Cd污染地区的生态恢复中具有一定的应用潜力.

