应用可吸收聚左旋乳酸微骨板外固定术治疗先天性心脏病合并支气管软化-单中心经验总结
张恒,张本青,段雷雷,李汉美,芮璐,龚丁旭,鲁中原,李守军
先天性心脏病患者可能因为特殊的解剖畸形(如血管环,双动脉弓,异常走行的无名动脉、锁骨下动脉),或者增大的心脏和扩张的血管产生的压迫,造成继发性支气管软化[1]。这部分患儿在进行心脏畸形矫治术后,容易出现难以脱离机械通气,长期佩戴气管插管,甚至需要气管切开的情况。呼吸道并发症以及全身感染几率增加,耗费大量医疗资源[2]。对于先天性心脏病合并支气管软化的患儿,过去常用的治疗方法除了呼吸机治疗等保守治疗措施外,还有主动脉悬吊、支气管内膜支架等治疗方式[3]。本组病例采用可吸收材料-聚左旋乳酸(PLLA)微骨板外固定术,治疗先天性心脏病合并支气管软化患儿。通过近期疗效观察其安全性和有效性。
1 资料与方法
研究对象:选取2017 年12 月至2019 年1 月,在我中心接受可吸收PLLA 微骨板外固定术治疗先天性心脏病合并支气管软化的8 例患儿临床资料。其中男性2 例,女性6 例。平均年龄(8.4±4.1)个月,平均体重(6.5±1.2)kg。所有患儿术前均行血常规、血生化、心肌酶谱、心电图、超声心动图、X 线胸片、胸部CT、纤维支气管镜等检查。患儿家属均充分获知病情和手术相关事宜并签署知情同意书。
入选标准:(1)需要手术矫治的心内畸形;(2)CT 显示左主支气管重度狭窄;(3)纤维支气管镜证实左主支气管重度狭窄。诊断标准:按照气管支气管内径减少程度分为<1/3 为轻度;达到1/2 为中度;达4/5 或者接近闭合、看不到远端圆形管腔为重度。
排除标准:(1)气管及支气管软骨发育异常,呈“O”型软骨;(2)合并桥支气管等畸形。
手术方法:7 例患儿同时接受心内畸形矫治和支气管外固定术。患儿采取仰卧位,升主动脉、上腔静脉、下腔静脉插管建立体外循环。心肌灌注停跳保护液,心脏停跳下进行心内畸形的矫治。心脏复跳后,经食管超声心动图(TEE)证实心内畸形矫治满意后,解剖游离左主支气管。在纤维支气管镜引导下,明确病变部位和长度。用电热弯曲器(工作温度95℃~105℃,预热2~3 min,加热6~8 s)制备PLLA 微骨板金属模型,置入病变部位“测量”模型形状。在病变部位支气管软骨两侧,对称缝置4针5/0 Prolene 预置线。用相同加热条件,按照模型形状制备PLLA 微骨板呈“U”型。将U 型板套入病变部位支气管软骨,预置线从板孔穿出后打结,将支气管外膜悬吊固定于微骨板上,从而增加病变部位支气管内径,如图1 所示。复查支气管镜,证实支气管狭窄解除后,用自体心包或0.1 mm Gore-tex膜,疏松包绕微骨板,避免对毗邻的组织、器官的磨损以及对于支气管软骨生长的限制。1 例为单纯支气管外固定术,采用左胸后外侧切口,在主动脉弓下解剖游离左主支气管。此后的步骤同前。

图1 以MP-4S-22 材料制作微骨板的示意图
随访:全部患儿术后1、3、6 及12 个月进行门诊随访,询问生长发育情况、呼吸状况,常规复查超声心动图观察心内畸形矫治情况。术后6~12 个月行胸部CT 扫描,气管、支气管三维重建,观察气道有无狭窄和发育情况,以及手术材料PLLA 微骨板影像等。
统计学分析方法:所有数据采用SPSS 22.0 分析。年龄、体重、机械通气时间、重症监护病房(ICU)时间等计量资料以均数±标准差()表示。P<0.05 为差异有统计学意义。
2 结果
8 例患儿一般资料(表1):8 例患儿均顺利完成心内畸形矫治和PLLA 微骨板支气管外固定术。心内畸形矫治种类包括:室间隔缺损修补术4 例,房间隔缺损修补术4 例,二尖瓣成形术2 例,右心室流出道疏通术2 例,三尖瓣成形术2 例,主动脉弓成形术1 例,三房心矫治术1 例。
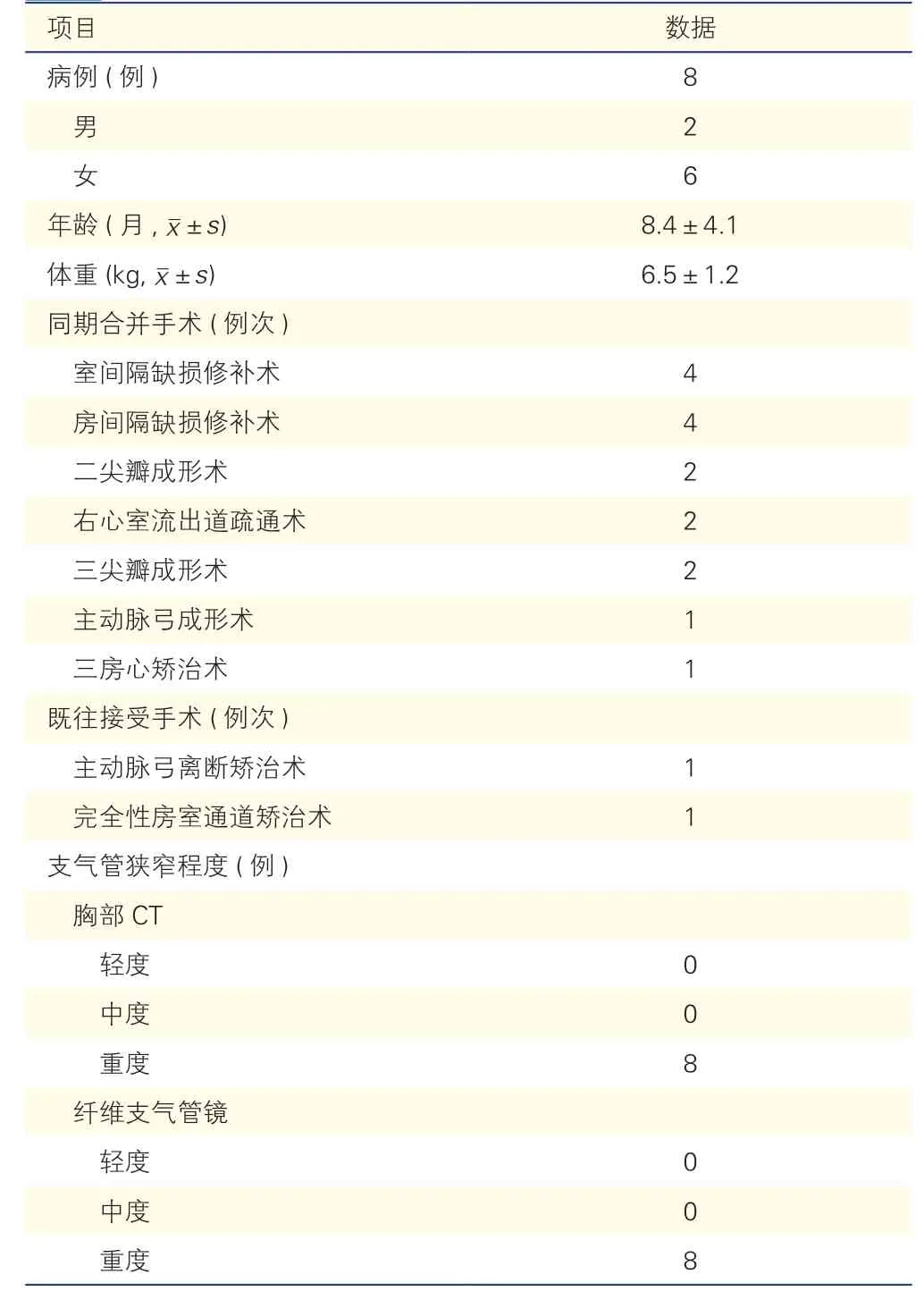
表1 8 例患儿一般资料
8 例患儿术后资料和随访结果(表2):患儿平均机械通气时间(24.4±23.7)小时,ICU 时间(3.8±3.8)天,平均随访时间(6.5±6.2)个月。未出现恶性心律失常、脑卒中等严重并发症。超声心动图结果均提示心脏畸形矫治满意,无心包积液、残余分流、残余梗阻等情况。患儿生长发育良好。8例患儿术后随诊期间(2~12 个月),复查胸部CT 均显示接受治疗的左主支气管无狭窄,治疗部位未见明显的可吸收PLLA 微骨板影像。
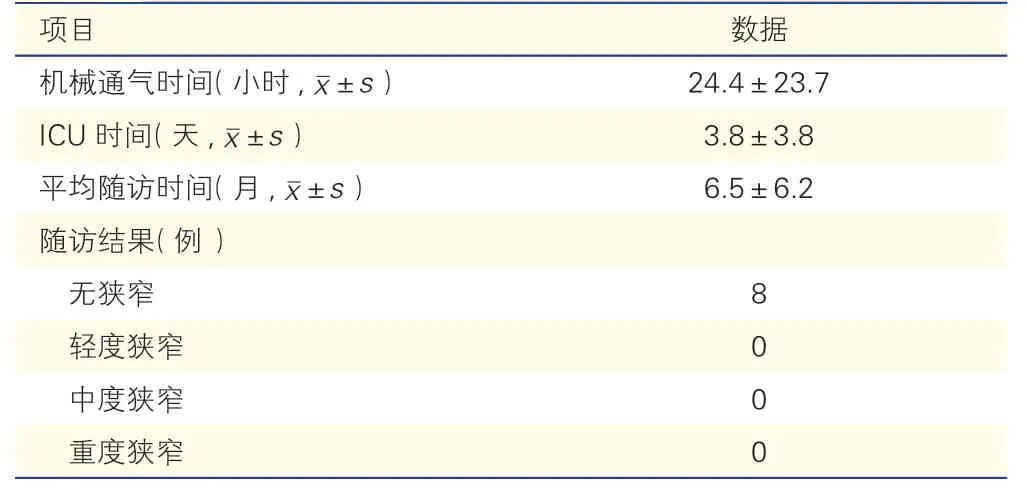
表2 8 例患儿术后资料和随访结果
3 讨论
先天性心脏病患儿可合并继发性支气管软化,主要是特殊的解剖畸形(如血管环,双动脉弓,异常走行的无名动脉、锁骨下动脉),或者增大的心脏和扩张的血管产生的压迫所造成[1]。确诊检查手段包括胸部CT(气管支气管三维重建)和纤维支气管镜检查,后者是诊断的“金标准”[4-5]。
对于先天性心脏病合并继发性支气管软化的患儿,目前在治疗策略和方法上存在争议。一部分患儿,支气管病变局限,程度较轻,随着心脏畸形的矫治,压迫解除,支气管软化会逐渐改善,能渡过术后监护期。但一部分重度狭窄患儿,单纯采用保守治疗策略,需要长期依赖机械通气,撤离呼吸机后需要续贯无创通气,且再次插管率高。有些患儿甚至接受气管切开术。这极大延长ICU 时间,增加治疗费用,加重患者本人和家庭的痛苦,可能造成不良预后[3-7]。
积极治疗策略主要包括支架介入治疗和手术治疗。先天性心脏病合并支气管软化的患儿,接受手术时间较早,支架治疗面临着支架能否适应儿童气道生长潜能的问题。另外,支气管内膜炎症反应、内膜增生和肉芽组织形成,也是支架治疗无法避免的并发症。因此,对于这类患儿,不建议把支架介入治疗作为首选治疗手段[8-9]。外科手术可以分为两大类,一种是以主动脉悬吊为代表的间接治疗方案;第二种是支气管外膜固定术的直接治疗方案。主动脉悬吊手术虽然被广泛采用,但是其游离范围大,对于其他心脏结构造成的压迫无法彻底缓解。对于再次手术患者难度较高,因术后恢复时间较长,仍面临长时间气道狭窄的相关问题[1,3,10-11]。
本组病例均为先天性心脏病患儿,因心脏结构的压迫导致支气管软骨软化,管腔重度狭窄。从治疗策略上,本团队考虑采用既不损伤支气管内膜,又能加强支气管软骨强度和支撑力的支气管外固定术。针对这一术式,既往报道的人工材料包括网状涤纶+硅胶、网状硅胶+聚乙烯纤维、生物陶瓷、PTFE 螺纹支架血管等[2-3]。本团队选用可吸收PLLA 微骨板,主要考虑以下几点优势:(1)这是一种经FDA 批准的可降解高分子材料,具有良好组织相容性,已经广泛应用于心血管外科、骨科和矫形外科;(2)强度高(挠曲强度190 MPa),具备足够的支撑力;(3)按时逐级降解(7~10 个月后在体内强度基本降解消失,3~5 年完全分解和被吸收,分解为二氧化碳和水),不影响儿童气道生长。
本组中1 例为二次手术患儿,第一次手术为治疗主动脉弓离断所施行的主动脉弓成形手术。因为主动脉弓压迫,造成左主支气管狭窄。本次手术经左胸后外侧切口,采用可吸收PLLA 微骨板左主支气管外固定术。其他7 例患儿均同期进行心脏畸形的矫治和可吸收PLLA 微骨板左主支气管外固定术,手术时间虽然有所延长,但是与文献报道的此类患儿平均数据相比,明显缩短术后呼吸机时间、ICU滞留时间,降低相关并发症,减少费用。本组患儿术后随访过程中,超声心动图检查均显示心脏畸形矫治满意,生长发育良好。胸部CT 结果显示,手术治疗的左主支气管病变部位均无狭窄。在患儿术后6~12 个月的复查胸部CT 中,治疗部位未见明显的可吸收PLLA 微骨板影像,提示该材料在逐渐吸收分解。
此项技术安全、有效,本团队总结了以下经验:(1)术中纤维支气管镜精准定位,并预防缝线过深损伤内膜;同时可以清理呼吸道,评估即刻治疗效果;(2)制备金属模型是塑形PLLA 微骨板之前必不可少的步骤;(3)为了保证外固定术效果,在病变处支气管软骨双侧对称缝线,使得牵引力均匀分布;(4)常规采用自体心包或0.1mm Gore-tex 膜进行疏松包裹,既避免对毗邻的组织、器官的磨损,同时还兼顾支气管的生长潜能。
综上所述,采用可吸收PLLA 微骨板外固定术治疗先天性心脏病合并支气管软化安全、有效,手术材料可以逐渐吸收分解,近期结果良好。本研究为单中心、回顾性研究,且样本量较小,仍需大规模临床试验进一步验证。

