术前PLR、NLR与喉鳞状细胞癌预后的相关性分析1
张 曦,赵留芳,李静芳,魏 颖,杨 伟,夏全松,潘玉卿
(云南省肿瘤医院/昆明医科大学第三附属医院:1.检验科;2.头颈外科,云南昆明 650118;3.昆明医科大学第一附属医院检验科/云南省实验诊断研究所/云南省检验医学重点实验室,云南昆明 650032)
喉鳞状细胞癌是头颈部最常见的恶性肿瘤之一,其发病率和病死率仅次于口咽部肿瘤[1]。据统计,我国2015年喉鳞状细胞癌的新发病例在男性和女性约为23 700例及2 600例,而死亡数约为14 500例[2]。临床上对喉鳞状细胞癌的治疗一般是外科手术、放疗及化疗或两者联合,其形式主要依赖于肿瘤分期、疾病部位及是否转移。尽管喉鳞状细胞癌的发生是一个多因素作用的结果,但有研究显示其5年存活率并未随治疗方式的改善而升高[3]。因此,探寻有效的喉鳞状细胞癌预后指标并预测患者术后生存及优化治疗策略显得至关重要。全血细胞计数是喉鳞状细胞癌术前一项经济实用的反映全身炎性反应的常规实验,本次研究通过回顾性分析喉鳞状细胞癌患者术前部分全血细胞计数相关参数,旨在探讨中性粒细胞与淋巴细胞比值(NLR)、血小板与淋巴细胞比值(PLR)及相关全血细胞计数参数对喉鳞状细胞癌患者术后生存的影响,并为其是否可作为喉鳞状细胞癌预后的实验室指标及对临床检测提供理论依据。
1 资料与方法
1.1一般资料 2008年12月至2015年10月云南省肿瘤医院头颈外科收治的经手术治疗的151例喉鳞状细胞癌患者为研究对象,术前均未进行放化疗。其中男150例,女1例,年龄40~83岁,平均(61.82±9.15)岁。纳入标准:符合《2018中国临床肿瘤学会头颈部肿瘤诊疗指南》的患者且术后病理诊断为喉鳞状细胞癌,术前未患有可影响血常规计数结果的疾病且随访满5年或术后5年内因喉鳞状细胞癌进展死亡。排外标准:有任何炎症、自身免疫性疾病、急或慢性感染、血液病、激素治疗史或慢性肾功能不全的患者。
1.2研究方法 患者空腹行肘静脉穿刺分别采集乙二胺四乙酸二钾(EDTA-K2)抗凝血及肝素抗凝血3.5 mL,使用日本Sysmex配套试剂,通过XE-2100全自动血液分析仪检测术前最近一次全血细胞计数的参数,包括白细胞计数(WBC)、血小板计数(PLT)、中性粒细胞计数(NEU)、淋巴细胞(LYMPH)、血小板平均体积(MPV)、计算PLR和NLR值。白细胞介素6(IL-6)采用美国贝克曼库尔特流式细胞仪及其配套试剂检测,检测前所有项目的质控均在控。
1.3随访 采用门诊复查及电话的方式对186例患者进行随访,其中失访35例,失访率为18.9%。随访时间(总生存期)为患者术后第1天至2018年10月31日或死亡日为止。随访计划为患者术后第1天至第1年,每3个月随访1次。术后第2~5年每6个月随访1次。术后第5年后,每年随访1次并记录相关信息。
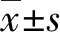
2 结 果
2.1喉鳞状细胞癌患者的临床特点 患者WBC为(7.78±2.89)×109/L,PLT为(229.18±67.62)×109/L,NEU为(4.96±2.63)×109/L,LYMPH为(2.17±0.75)×109/L ,MPV为(11.13±1.13)fL,PLR为117.12±52.11,NLR为2.57±1.89,所有患者的病理类型均为喉鳞状细胞癌。其他相关临床资料见表1。
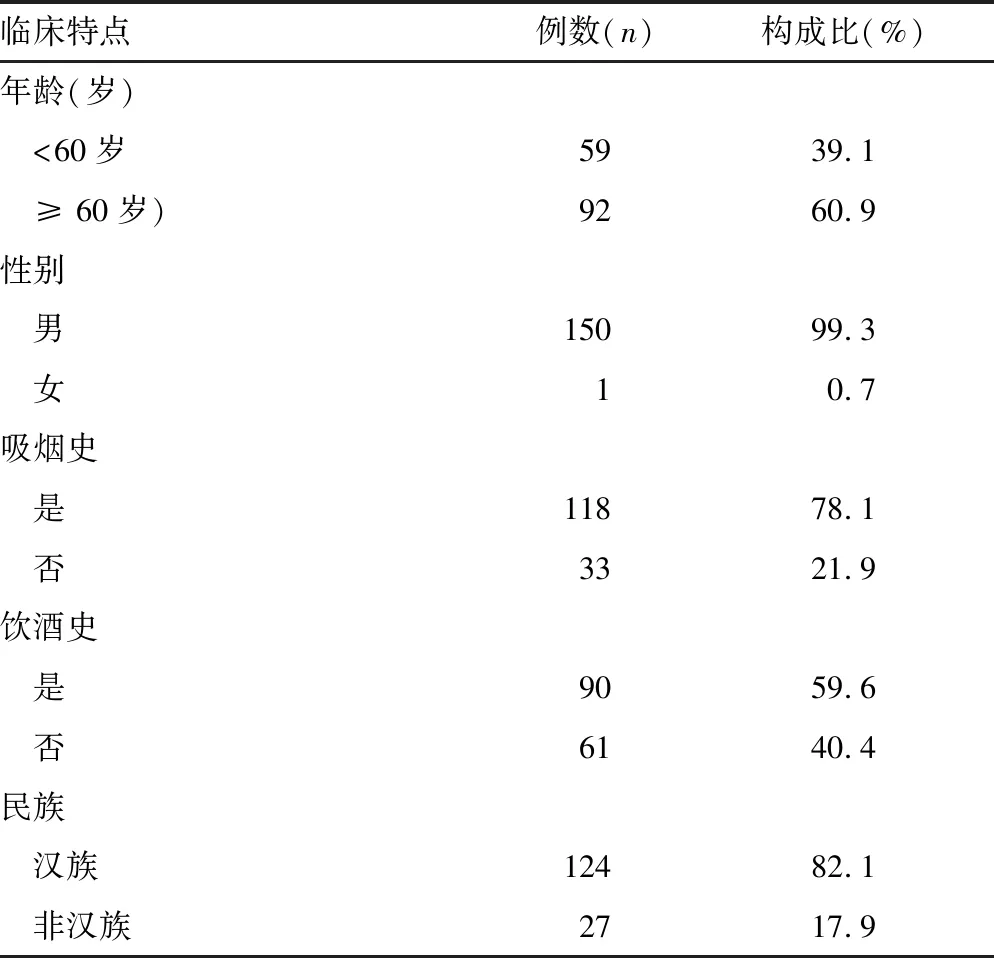
表1 喉鳞状细胞癌患者的相关临床资料
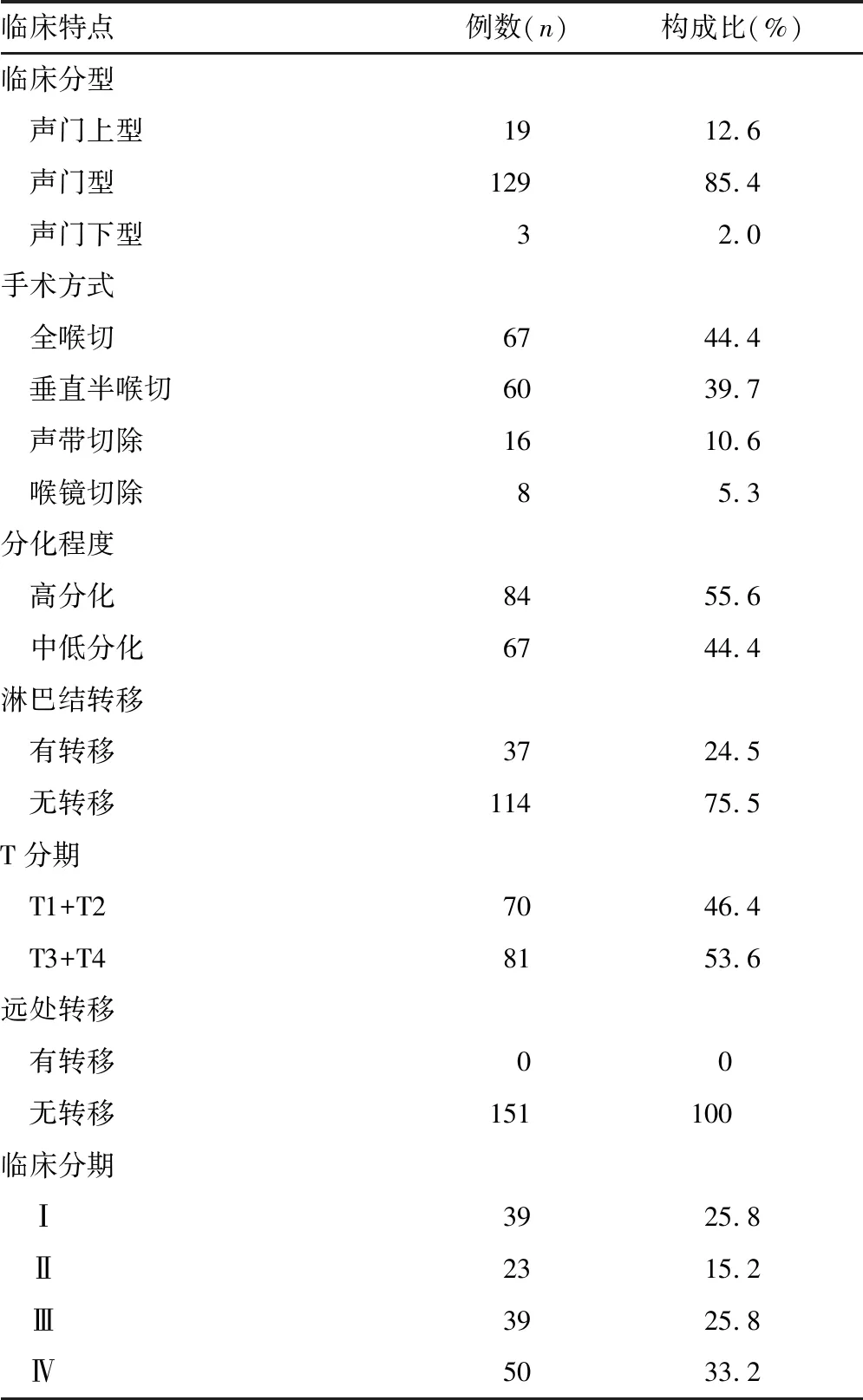
续表1 喉鳞状细胞癌患者的相关临床资料
2.2NLR和PLR在喉鳞状细胞癌中的最佳临界值的确定 采用R语言包(R Core Team,2012.版本号:2.15.0)同时兼顾灵敏度和特异度计算临界值。本次研究中NLR和PLR的最佳临界值分别为2.215及97.720。当NLR的临界值为2.215时,灵敏度为58.0%,特异度为69.5%,见图1A。当PLR的临界值为97.720时,灵敏度为73.9%,特异度为54.9%(图1B)。
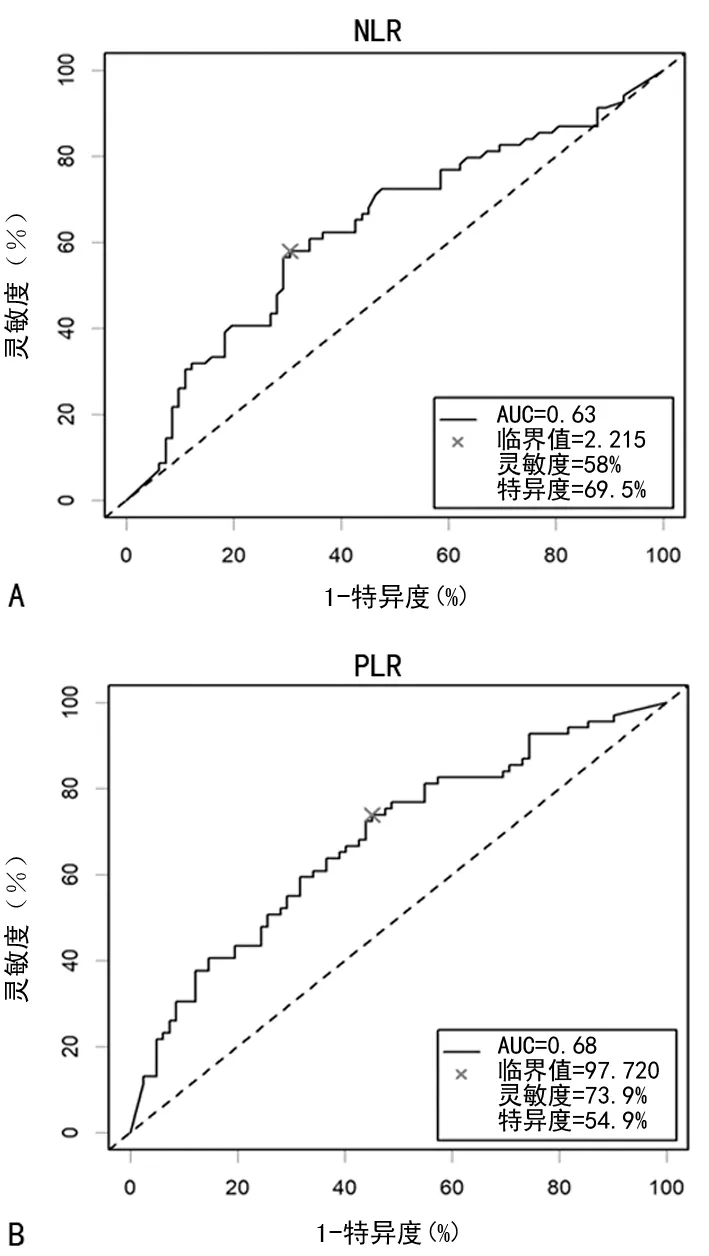
图1 NLR和PLR在喉鳞状细胞癌中临界值的确定
2.3预后因素的Cox回归分析 WBC、PLT、NEU可作为其危险因素(HR=1.13,95%CI:1.04~1.24;HR=1.003,95%CI:1.000~1.007;HR=1.24,95%CI:1.14~1.35;均P<0.05),LYMPH可作为其保护性因素(HR=0.51,95%CI:0.36~0.73,P<0.001)。NLR及PLR高低是喉鳞状细胞癌预后的独立影响因子(HR=3.01,95%CI:1.69~5.36;HR=1.98,95%CI:1.07~3.65;均P<0.05)。见表2。

表2 PLR、NLR及全血细胞计数相关参数对喉鳞状细胞癌预后的Cox回归分析

续表2 PLR、NLR及全血细胞计数相关参数对喉鳞状细胞癌预后的Cox回归分析
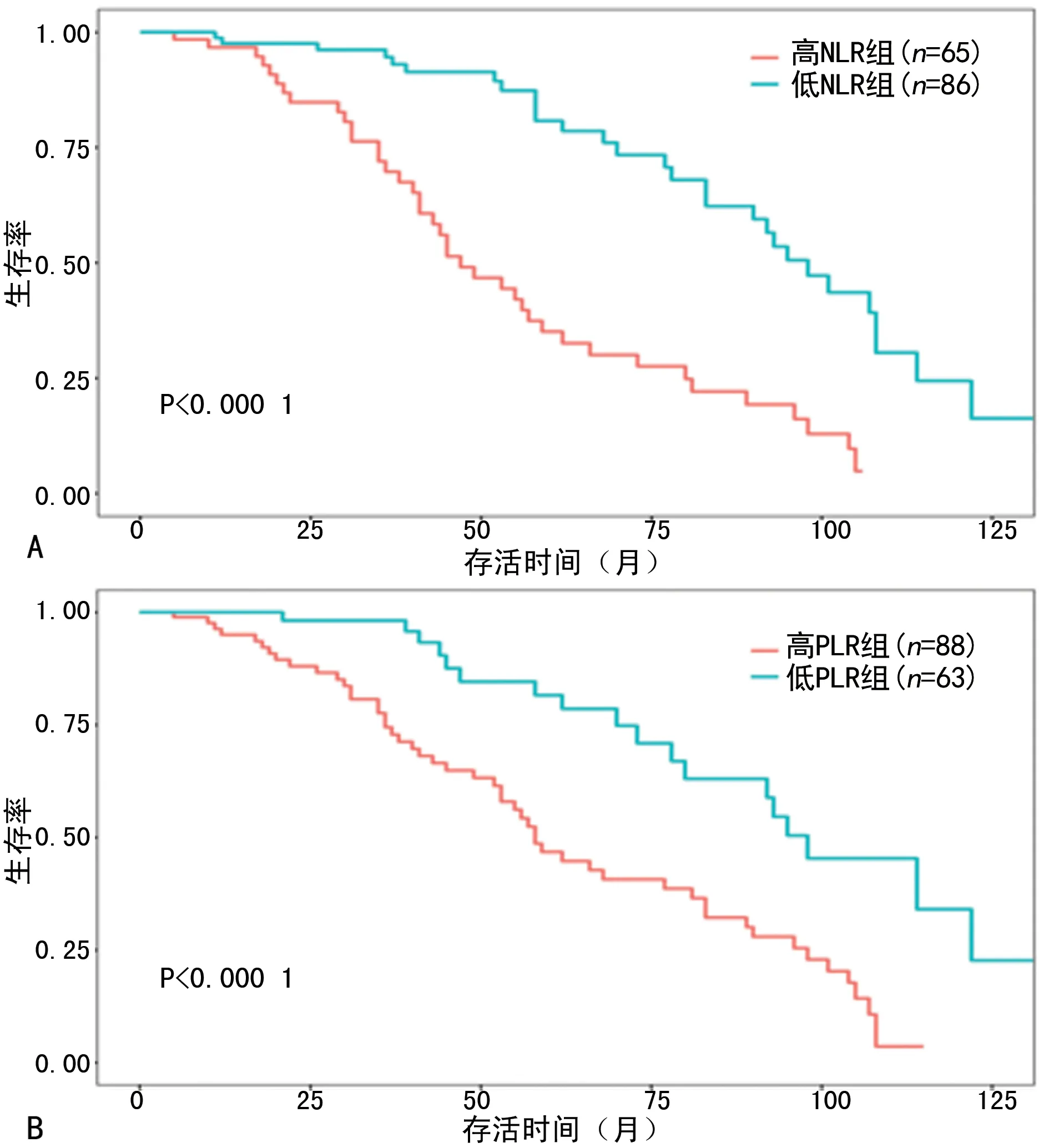
2.4高/低NLR组与高/低PLR组的5年生存率比较 采用Kaplan-Meier法比较不同分组的5年生存率,NLR组的5年总体生存率为56.9%(86/151),PLR组的5年总体生存率为56.3%(85/151)。其中,65例高NLR组(≥2.215)的5年总体生存率为30.8%(20/65),86例低NLR组(<2.215)的5年总体生存率为76.7%(66/86);88例高PLR组(≥97.72)的5年总体生存率为40.9%(36/88),63例低PLR组(<97.72)的5年生存率为77.8%(49/63),经log-rank test比较生存曲线,差异有统计学意义,见图2。
注:A为NLR;B为PLR。
图2高/低NLR组与高/低PLR组的生存曲线图
注:A为NLR;B为PLR。
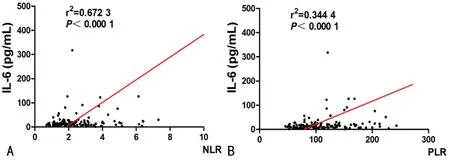
图3 NLR、PLR与IL-6的相关性分析
2.5NLR、PLR与IL-6的相关性分析 本研究中,151例患者IL-6水平为(12.4±5.5)pg/mL,以IL-6水平为纵坐标,分别以NLR、PLR值为横坐标来分析它们之间的相关性,IL-6水平与NLR的相关系数为0.67,相关性较高;IL-6水平与PLR的相关系数为0.34,相关性较弱,见图3。
3 讨 论
喉鳞状细胞癌的病因至今仍不明确,流行病学资料显示其与吸烟、饮酒、病毒感染、环境职业、放射线、微量元素缺乏、性激素代谢紊乱等因素有关,常为多种致癌因素协同作用的结果。近年来大量研究显示,肿瘤相关的免疫应答对于其发生和发展起到了关键作用[5],喉鳞状细胞癌细胞产生的细胞因子及相关的肿瘤微环境激发了宿主的炎性反应,进而促进了NEU、PLT、LYMPH等外周血炎症细胞的激增[6]。有学者研究表明NEU、PLT、LYMPH等炎性细胞可以作为独立或者彼此相关的预后因子在喉鳞状细胞癌的发生和发展中起到预测作用[7]。
NLR是一个新发现的反映宿主免疫应答的生物标志物,它的数值大小和循环池中的NEU和LYMPH密切相关,而且也能够轻易从常规的外周血细胞计数中获得,有研究表明,在各种实体瘤中NLR对于疾病的预后是一个独立的影响因子[8]。同样,PLR是血小板和淋巴细胞比值,能从全血细胞计数中轻易获取且不会增加患者的其他费用,在近年也作为肿瘤预后的独立因子被广泛应用。有学者研究表明,在肝癌、前列腺癌、肺癌等实体肿瘤中,PLR数值越高其预后越差[9-10]。PLT在出血性疾病中一直被认为是一种重要的效应细胞,然而大量的研究表明其在炎症应答中可识别和杀灭各种外来抗原,且释放大量介质修饰免疫及内皮细胞反应[11]。此外,研究表明PLT促进了肿瘤细胞的增殖和转移,高PLT和肿瘤患者的生存时间成反比,且增加了实体肿瘤治疗后复发的概率[12]。而作为宿主免疫监视系统最重要的淋巴细胞,其在各种恶性肿瘤中也扮演着重要作用。LEE等[13]的研究显示,浸润性淋巴细胞会影响恶性肿瘤患者的转归,而高PLT的肿瘤患者如果有浸润性淋巴细胞的升高,往往预示疾病良好的预后。最后,也有研究表明,肿瘤细胞刺激机体产生的细胞因子作为趋化因子入血会使NEU增加[14]。
云南省地处高原,是一个多民族聚集地,在疾病发生发展中势必也存在地区差异。虽然有大量研究表明,NLR在喉鳞状细胞癌中作为独立预后因子预测疾病预后,其数值在2.30~4.39,HR在1.10~3.69[15]。但在高原地区尚未有类似研究,且对喉鳞状细胞癌的预后也存在争议。因此,本次研究单从实验室数据出发,选择了容易获取且经济便捷的外周血细胞计数参数,包括WBC、NEU、LYMPH、PLT、MPV、PDW,RDW,并计算NLR及PLR值,以期通过有效的统计学手段确认其在高原地区喉鳞状细胞癌患者中的预测价值,为临床提供更为有效和准确的实验室数据支持。本研究的病例中,以老年男性为主,60岁以上人群占60%左右,且吸烟饮酒人群占50%以上,少数民族接近20%。首先通过R语言中生存统计分析,同时兼顾特异度和灵敏度,找到NLR、PLR在该疾病中的最佳临界值,并通过Cox风险比例模型得出WBC、PLT、NEU可作为预后的危险因素,NLR及PLR高低是喉鳞状细胞癌预后的独立影响因子。另一方面,NLR组的5年总体生存率为56.9%(86/151),PLR组的5年总体生存率为56.3%(85/151)。其中,65例高NLR组(≥ 2.215)的5年总体生存率为30.8%(20/65),88例高PLR组(≥ 97.72)的5年总体生存率为40.9%(36/88),经log-rank test比较生存曲线,差异具有统计学意义。对于喉鳞状细胞癌预后的影响,NLR的评测效能似乎比PLR更好。LYMPH可作为其保护性因素,这也与之前的研究相符,推测可能与机体的淋巴细胞更倾向于抑制肿瘤生长和促进机体的免疫反应有关[1]。最后,本次研究中高PLR、NLR组中WBC并未同时升高,推测可能原因为本次纳入研究的病例数太少,或喉鳞状细胞癌的发生发展并不是单纯通过白细胞数量改变,而可能与其分泌的细胞因子相关。而IL-6是趋化因子家族的一种细胞因子,其靶细胞众多,包括巨噬细胞、肝细胞、静止的T细胞、活化的B细胞和浆细胞等,其生物效应也十分复杂。为此,通过Pearson相关分析进一步明确IL-6与NLR、PLR的相关性,本次研究中IL-6水平与高NLR的相关系数为0.67,相关性较高;而与PLR的相关系数为0.34,相关性较弱。但其如何影响喉鳞状细胞癌的发生发展,具体机制尚待更加深入的数据研究。
4 结 论
综上所述,术前NLR、PLR的高低可作为影响喉鳞状细胞癌患者术后生存的独立因素,而术前方便经济的检测对喉鳞状细胞癌的预后评估具有重要意义。

