多重耐药性鸡白痢沙门菌的分离鉴定及敏感噬菌体的筛选
张玲 李相安 程晓薇 邹本革 聂凡皓 郑刚 牟思洋 聂凡淇 姜雪萍

摘 要:本研究对潍坊某种鸡场死胚进行病原菌分离鉴定,并从该种鸡场孵化室污水中筛选对其敏感的噬菌体。结果显示:病原菌为鸡白痢沙门菌,命名为WF-1,且呈现多重耐药性。利用从该孵化室污水中分离到的噬菌体WFSp1及实验室分离保存的5株(Sp1、Sp2、Sp3、Sp4和Sp5)沙门菌噬菌体对其进行敏感性测定,发现噬菌体WFSp1对其敏感性最高。体外裂解试验发现,噬菌体WFSp1在160 min内可完全裂解WF-1分離株,裂解增殖后的噬菌体效价高达2.5×1011 PFU/mL。该研究结果为用噬菌体制剂控制鸡沙门菌感染提供了理论依据。
关键词:多重耐药性;鸡白痢沙门菌;分离鉴定;敏感噬菌体
中图分类号:S831.7 文献标志码:A 文章编号:1001-0769(2020)12-0073-07
沙门菌引起的鸡白痢是鸡场常见的细菌性疾病,可经种蛋垂直传播,被污染的种蛋孵化率下降,或孵出带菌雏鸡,并成为鸡场主要传染源[1]。沙门菌还可通过被污染的饲料、饮水、垫料、粪便、老鼠和环境等水平传播[2-3]。种鸡场在临床治疗鸡白痢时,如果盲目用药,会加剧鸡白痢沙门菌的耐药性,进而会给养鸡业造成重大危害和经济损失。
噬菌体是生物界中数量最大的生物群体,也是目前已知的最大病毒群。在自然界,噬菌体的数量估计超过1030~1032个,被称为生物界的“暗物质”,是地球上最丰富的生命体[4-5]。噬菌体可以特异、高效地杀灭细菌,与抗生素相比,能大大地减少对微生物群体自然多样性的破坏。因此,近年来噬菌体作为新型抗菌剂得到广泛的研究,由此产生的产品层出不穷,遍及临床医学、畜牧业、水产养殖业、土壤改良等多个领域[6-7]。本研究从山东省潍坊市某种鸡场孵化室的死胚中分离到一株多重耐药性的鸡白痢沙门菌,并测定其对噬菌体的敏感性,以期为种鸡场利用噬菌体控制鸡白痢提供依据。
1 材料与方法
1.1 样本来源
细菌分离样本来自潍坊和烟台地区种鸡场孵化室的死胚;分离噬菌体的样本来自该孵化场的污水;鸡白痢沙门菌阳性菌株YN-1由本实验室鉴定后保存。
1.2 主要试剂与仪器
1.2.1 主要试剂
微量生化发酵管和药敏试纸片(杭州滨和微生物试剂有限公司),细菌基因组DNA提取试剂盒(北京索莱宝科技有限公司);PCR试剂盒[天根生化科技(北京)有限公司],胰蛋白酶、酵母提取物(OXOID公司),琼脂干粉(日本BOSHARP公司),SS培养基、LB培养基(青岛海博生物技术有限公司),SM缓冲液、LB半固体培养基和双层琼脂培养基等由本实验室自制,其他试剂均为国产分析纯试剂。
1.2.2 主要仪器
恒温培养箱(上海跃进医疗器械厂),Centrifuge 5810R台式冷冻离心机(德国Eppendorf公司),SHAKE SCS-24恒温摇床(上海市离心机械研究所有限公司),0.22 μm滤器(法国Millipore公司)。
1.3 细菌的分离与培养
无菌操作解剖鸡胚,蘸取卵黄液接种到SS培养基上划线分离,37 ℃下倒置培养18 h,观察细菌在培养基上的生长情况,挑选典型菌落,进行细菌纯化,并保存备用。
1.4 细菌的形态学镜检
挑取SS培养基上纯化的单个菌落, 37 ℃下180 r/min振荡培养至对数期,得到新鲜对数期菌液,涂布于载玻片上,干燥固定后进行革兰染色和鞭毛染色,镜检观察细菌的形态特征。
1.5 细菌的生化鉴定
将初步鉴定为沙门菌的菌株划线接种于SS培养基,37 ℃下培养18 h~24 h,取菌落加入到生理盐水中制成均匀悬液,比浊度在0.5~0.65个麦氏单位。将制备好的细菌悬液接种于各种生化反应管中,37 ℃下培养24 h~48 h。根据生化管说明书记录试验结果。参照《食品安全国家标准食品微生物学检验沙门氏菌检验》(GB4789.4-2016)判断结果。
1.6 细菌的PCR鉴定
取细菌菌液提取DNA,利用鸡白痢沙门菌特异性引物对疑似沙门菌进行PCR扩增检测。以鸡白痢沙门菌rfbS基因在第237位和第598位碱基的差异,设计特异性PCR引物。上游引物:5-TGCCTATCAGAGTATTAGTGT-3,下游引物:5-TATTCACGAATTGATATATCCT-3。PCR扩增条件:95 ℃,10 min;94 ℃ 30s,50 ℃ 30s,72 ℃ 40 s,35个循环;72 ℃总延伸10 min。PCR产物用1.5%的琼脂糖凝胶电泳鉴定。
1.7 细菌的耐药性分析
采用纸片琼脂扩散法(Kirby-Bauer法)[临床实验室标准化研究所(Clinical and Laboratory Standards Institute,CLSI),2011],根据CLSI推荐方法进行操作,在无菌条件下,吸取0.2 mL滴度为5×108 CFU/mL 经鉴定的沙门菌菌液,滴入LB琼脂平皿中,涂布均匀,以保证细菌在平皿表面均匀分布,盖上皿盖,室温下放置3 min~5 min,使培养基表面的水分吸收掉,用无菌镊子将10种药敏纸片贴于平皿中,37 ℃下培养18 h~24 h,测量抑菌圈的直径。根据CLSI(2011)标准判断敏感(S)、中介(I)和耐药(R),分析病原菌的耐药谱。
1.8 细菌噬菌体的筛选
以鸡白痢沙门菌分离株为宿主菌,挑取复苏的单菌落,制备细菌悬液备用。取细菌分离相应的孵化场的污水放入鸡白痢沙门菌悬液各500 μL,混匀后37 ℃下浸泡6 h,用无菌纱布滤去多余杂质,经10 000 r/min离心15 min,将上清经0.22 μm滤器过滤。取200 μL滤液与200 μL对数期的宿主菌混匀,37 ℃下孵育5 min,混合液与5 mL上层琼脂培养基充分混匀后迅速铺到琼脂平板上,37 ℃培养3 h~4 h,观察有无噬菌斑出现。
抠取噬菌斑于盛有1 mL生理盐水的EP管中,40 ℃水浴30 min。浸出液10 000 r/min离心5 min,将上清用LB肉汤进行10倍稀释至合适的稀释度,双层平板法得到单个噬菌斑。重复3~5次直至获得大小和形态一致的噬菌斑。
1.9 细菌噬菌体的效价测定
将100 μL培养好的噬菌体液进行不同梯度的稀释,稀释到合适浓度后将200 μL噬菌体与200 μL的宿主菌混匀,37 ℃下孵育5 min。將上述混合液加入50 ℃左右的上层中,混合均匀倒入下层平板中。待上层凝固后倒置放入37 ℃培养箱中培养。培养4 h~6 h后,记录噬菌斑数量,计算噬菌体效价。
1.10 噬菌体对分离菌株的体外裂解作用
选取敏感噬菌体WFSp1进行体外裂解测定。分别吸取200 μL噬菌体增殖液和细菌悬液(银杏对照组加200 μL菌液和 200 μL LB肉汤),于10 mL LB肉汤培养基中180 r/min 37 ℃下振荡培养,观察培养基浑浊情况,并每隔20 min检测培养液的OD600 nm变化,并通过双层平板法检测噬菌体增殖液的效价。
1.11 噬菌体WFSp1的形态观察
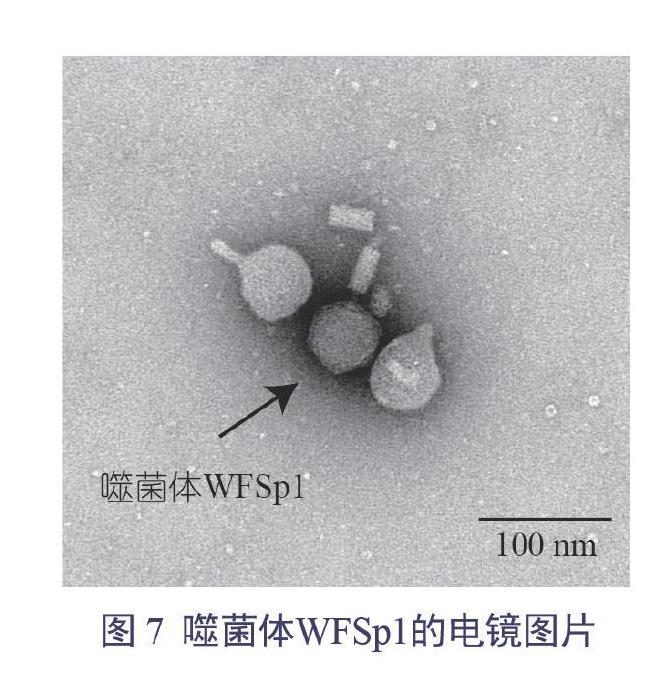
将滴度为2.5×1011 PFU/mL的噬菌体纯化液滴到覆有Foumovar膜的铜网上, 10 min~15 min后滤纸吸去余液,再滴加一滴2%的磷钨酸负染5 min~10 min,滤纸吸去余液,室温晾干,JEM-1011透射电镜下观察并拍照。
2 结果与分析
2.1 细菌的分离培养与镜检结果
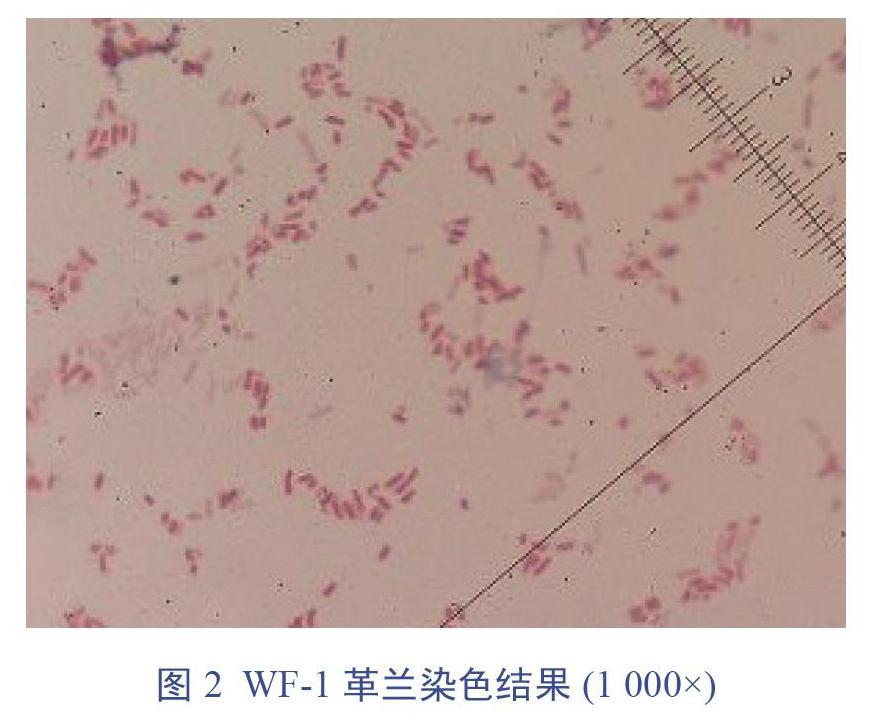
从潍坊市某种鸡场孵化室的死胚中分离到1株细菌,命名为WF-1。在SS培养基上得到形态边缘整齐,稍隆起,表面光滑湿润,有金属光泽的黑色菌落,培养基由红色变为黄色,结果见图1。镜检结果为革兰阴性,单个或成对排列,粗短、两端钝圆的小杆菌(比大肠杆菌细),结果见图2。经过鞭毛染色后,镜检观察到细长成束的鞭毛,结果见图3。
2.2 细菌生化试验结果
将SS培养基上分离到的典型或可疑菌落分别接种至营养琼脂平板上进行纯培养,然后分别接种于三糖铁琼脂(TSI)斜面和HBI沙门菌生化鉴定条进行培养。通过试验鉴定,初步认为WF-1为沙门菌,具体结果见表1。
2.3 细菌的PCR鉴定结果
以分离株WF-1的细菌基因组DNA为模板,利用鸡白痢沙门菌特异性引物进行PCR扩增,得到与预期400 bp大小一致的片段,确定分离菌株WF-1为鸡白痢沙门菌,结果见图4。
2.4 细菌的药敏试验结果
表2列出了鸡白痢分离株WF-1药敏试验结果。由表2可知,与沙门菌对照株YN-1相比,分离株WF-1对临床常用抗生素氟苯尼考、阿奇霉素、大观霉素、林可霉素、阿莫西林、多西环素和新霉素均产生耐药性。
2.5 细菌噬菌体的筛选纯化
以鸡白痢沙门菌WF-1为宿主菌进行噬菌体筛选。挑取噬菌斑,经过4代分离纯化后,噬菌体在双层平板上形成直径5 mm左右、规则透明的噬菌斑,并伴有晕圈,结果见图5。
2.6 噬菌体效价的测定
将Sp1、Sp2、Sp3、Sp4、Sp5和WFSp1共6株噬菌体裂解液进行10倍梯度稀释,采用双层琼脂平板法将噬菌体培养12 h,在平板上均形成形态规则、大小一致的噬菌斑,从中选取噬菌斑数在30~300个的平板,计算噬菌体的效价,并记录结果,结果见表3。
2.7 噬菌体WFSp1对WF-1分离株的体外裂解分析
将分离的噬菌体WFSp1和WF-1混合,振荡培养160 min后,发现噬菌体和细菌混合的培养基液体变清亮,摇动可见细微的细菌碎片,对照组培养基液体浑浊。噬菌体WFSp1对WF-1的体外裂解OD600 nm结果见图6。OD600 nm变化显示,两组混合液中0~ 100 min细菌浓度不断增高,100 min~ 140 min WFSp1+WF-1组菌液浓度开始下降,140 min~160 min WFSp1+WF-1组菌液浓度接近0,同时阴性对照组菌液浓度持续增高。由此可知WF-1被噬菌体WFSp1于 160 min内完全裂解,测得增殖后噬菌体的效价为2.5×1011 PFU/mL。
2.8 噬菌体WFSp1的形态观察
透射电镜观察发现噬菌体WFSp1属于有尾噬菌体目短尾病毒科,二十面体结构,结果见图7。
3 讨论
鸡白痢沙门菌引起的传染性疾病可水平传播和垂直传播,并且可在鸡群中持续循环感染。种鸡感染后,鸡场若不及时采取措施,不仅会影响种鸡生产,还会影响种蛋的孵化率,提高雏鸡的病死率,给养鸡业带来一定的经济损失[8-9]。很多发达国家和地区,如西欧、美国、加拿大、澳大利亚和日本,已经实施并完成了鸡白痢的净化工作,但是在发展中国家,鸡白痢仍然流行和蔓延。鸡白痢沙门菌对抗菌药耐药性日益严重,随着耐药范围扩大和耐药水平增高已成为影响全球公共卫生安全的重要问题[11-13]。噬菌体特异性强,能自我复制,专一性强,源于自然,对环境及动物机体友好,具有杀死耐药性细菌的功能,已有报道用噬菌体在临床上治疗耐药性细菌感染[4-5,10]。噬菌体将在禁抗、限抗、无抗的政策中发挥防治细菌性疾病的独特优势,目前普遍认为其是一种作为新型替代抗生素的生物制剂。
4 结论
本研究针对从潍坊市某种鸡场分离到的鸡白痢沙门菌进行自场噬菌体筛选,并测定其对分离噬菌体的敏感性,体外裂解试验显示噬菌体WFSp1在160 min内可以完全裂解鸡白痢沙门菌WF-1,且裂解后噬菌体WFSp1效价高达2.5×1011 PFU/mL。体外试验结果显示WFSp1对WF-1的裂解效果敏感高效,在临床应用中是否能发挥同样的作用需要进一步细致严谨的评估。在沙门菌耐药性日益严重的情况下,期望噬菌体疗法能够在沙门菌的防控中发挥积极作用。
参考文献
[1] ARORA D,KUMAR S,JINDAL N,et al. Prevalence and epidemiology of Salmonella enterica serovar Gallinarum from poultry in some parts of Haryana,India[J]. Vet World,2015,8(11):1300-1304.
[2] GUPTA S,JINDAL N,KHOKHAR R S,et al. Individual and combined effects of ochratoxin A and Salmonella enterica serovar Gallinarum infection on pathological changes in broiler chickens[J]. Avian Pathol,2008,37(3):265-272.
[3] ATLAS R,MALOY S. One Health and Food-Borne Disease[M]. Washington D C:ASM Press,2014:137-148
[4] ROHWER F,SEGALL A M. In retrospect:a century of phage lessons[J]. Nature,2015,528:46–48.
[5] WTTZANY G. Viruses: Essential Agents of Life[M]. Dordrecht:Springer,2012:61-81
[6] SALMOND G P,FINERAN P C. A century of the phage:past,present and future[J]. Nat Rev Microbiol,2015,13(12):777-786.
[7] KORTRIGHT K E,CHAN B K,KOFF J L,et al. Phage therapy:a renewed approach to combat antibiotic-resistant bacteria[J]. Cell Host Microbe,2019,25(2):219-232.
[8] HAJAM I A,KIM J,LEE J H. Oral immunization with a novel attenuated Salmonella Gallinarum encoding infectious bronchitis virus spike protein induces protective immune responses against fowl typhoid and infectious bronchitis in chickens[J]. Vet Res,2018,49(1):91.
[9] AHIWALE S S,BANKAR A V,TAGUNDE S N,et al. Isolation and characterization of a rare waterborne lytic phage of Salmonella enterica serovar Paratyphi B[J]. Can J Microbiol,2013,59(5):318-323.
[10] AHMADI M,KARIMI TORSHIZI M A,RAHIMI S,et al. Prophylactic bacteriophage administration more effective than post-infection administration in reducing Salmonella enterica serovar enteritidis shedding in quail[J]. Front Microbiol,2016,7:1253.
[11] BISWAS S,BRUNEL J M,DUBUS J C,et al. Colistin:an update on the antibiotic of the 21st century[J]. Expert Rev Anti Infect Ther,2012,10(8):917-934.
[12] 劉志科,杨宁宁,徐锦凤,等.鸡白痢沙门菌病原的分离鉴定及耐药性分析[J]. 中国畜牧兽医,2017,44(9):2792-2800.
[13] 周盼伊. 《全国遏制动物源细菌耐药行动计划(2017-2020年)》提出六大行动[J]. 中国动物保健,2017,19(10):2-3.

