猪支原体对枝原净和泰农的药物敏感性分析
李俊 韦艳娜 刘蓓蓓 熊祺琰 邵国青 肖海君 谭涛 冯志新


摘 要:猪支原体病是造成国内外养猪业严重经济损失的重要疾病之一,抗菌药物是临床治疗猪支原体感染最快速、有效的手段。本研究以会严重危害猪群健康的猪肺炎支原体 (10株)、猪鼻支原体(10株)和猪滑液支原体(1株)作为支原体的代表,采用微量肉汤稀释法测定这些支原体对临床常用抗支原体药物(枝原净和泰农)的敏感性。结果显示猪肺炎支原体对枝原净的敏感性范围为0.015 μg/mL~0.25 μg/mL,对泰农的敏感性介于0.03 μg/mL~ 0.06 μg/mL;猪鼻支原体对枝原净的敏感性范围为0.03 μg/mL~0.5 μg/mL,对泰农的敏感性为0.06 μg/mL~128 μg/mL;枝原净对猪滑液支原体标准株的最小抑菌浓度(Minimum Inhibitory Concentration,MIC)为 0.03 μg/mL,对泰农的MIC为0.25 μg/mL。本研究结果有助于了解当前支原体的临床耐药情况,为猪支原体病的防控以及制定合理的抗菌药物治疗方案提供科学依据。
关键词:支原体;枝原净;泰农;抗菌药物敏感性;猪
中图分类号:S852.62 文献标志码:A 文章编号:1001-0769(2020)12-0025-06
支原体病是目前造成国内外养猪业严重经济损失的重要疾病之一,所产生的影响可分为直接影响(导致猪死亡和淘汰)和间接影响(提高料肉比和降低日增重)[1]。至今为止已发现能引起猪发生支原体病的病原有6种,其中会产生严重危害的支原体主要为猪肺炎支原体(Mycoplasma hyopneumoniae)、猪鼻支原体(Mycoplasma hyorhinis)和猪滑液支原体(Mycoplasma hyosynoviae)[2]。猪肺炎支原体引发的猪喘气病危害最广,又称为猪地方性流行性肺炎,是一种接触性、慢性呼吸道传染病,患病猪主要表现为咳嗽、气喘、生长迟缓和饲料转化率不佳,病理解剖可见肺叶呈胰样或肉样病变[3]。猪鼻支原体主要引起10周龄以下的仔猪发生散发性、急性、多发性浆膜炎、关节炎和肺炎[4]。猪滑液支原体是诱发生长猪和育肥猪关节炎的重要病原体之一[5]。
虽然接种疫苗可以有效减少感染,但抗菌药物仍是临床防治猪支原体病的重要手段[6]。目前兽医临床常用的抗支原体药物主要有四环素类、大环内酯类、林可酰胺类、截短侧耳素类、酰胺醇类、氨基糖苷类以及氟喹诺酮类[7],但抗菌药物的选择性压力可能会导致支原体产生耐药性[8]。支原体生长缓慢,培养条件苛刻,临床分离培养非常困难。相对于细菌,近年来国内外有关畜禽支原体对抗菌药物敏感性及耐药性的研究资料较少[9]。目前,美国临床实验室标准化委员会(Clinical and Laboratory Standards Institute,CLSI)和欧盟抗菌藥物敏感性试验委员会(European Committee on Antimicrobial Susceptibility Testing,EUCAST)尚未建立动物支原体对抗菌药物敏感性检测和结果判定的国际标准[10]。
本研究以临床上危害严重的猪肺炎支原体、猪鼻支原体和猪滑液支原体作为猪支原体的代表,测定其田间分离株对临床常用抗猪支原体药物(枝原净和泰农)的敏感性,以期了解猪支原体的耐药情况,为猪支原体病的临床合理用药及防控提供理论依据和实践指导。
1 材料与方法
1.1 材料
1.1.1 菌株
猪肺炎支原体、猪鼻支原体和猪滑液支原体均由江苏省农业科学院兽医研究所猪病防控研究室保存。猪肺炎支原体10株,2010—2017年分离自江苏的南京和无锡以及安徽等地区的患病猪。猪鼻支原体10株,2010—2018年分离自江苏的南京、泰兴等地区的患病猪。猪滑液支原体标准株,编号为ATCC27095,购自美国模式培养物保藏中心。
1.1.2 培养基
KM2液体培养基由江苏省农业科学院兽医研究所猪病防控研究室提供。
1.1.3 抗菌药物
枝原净(有效成分为延胡索酸泰妙菌素,纯度为80%)和泰农(有效成分为磷酸泰乐菌素,纯度为8.8%)均由礼蓝(上海)动物保健有限公司提供。
1.2 方法
1.2.1 猪支原体菌液储存液的制备
分别取培养至对数期的猪肺炎支原体、猪鼻支原体和猪滑液支原体各0.5 mL,转接到4.5 mL KM2培养基中,待培养猪肺炎支原体与猪鼻支原体的培养基颜色变黄、培养猪滑液支原体的培养基颜色变红后,分装各菌,每管1 mL,作为菌液储存液于 -80 ℃下冻存。
1.2.2 猪支原体的滴度测定与接种悬液制备
将在-80 ℃下保存的猪肺炎支原体、猪鼻支原体和猪滑液支原体解冻后,采用新鲜配制的KM2培养基复苏和传代,测定它们的滴度,即颜色变化单位(Color Change Unit,CCU),根据各支原体不同分离株的滴度(CCU/mL),采用KM2培养基调整菌液量至1×104 CCU/mL~1×105 CCU/mL,作为接种悬液备用。
1.2.3 抗菌药物的配制与工作液制备
根据待试药物的有效成分含量计算所需药物量,准确称取后无菌操作溶解于相应的溶剂中,配制母液浓度为1 280 μg/mL,置于-40 ℃下保存。将各药物母液用KM2液体培养基按二倍稀释法稀释至15个工作液浓度。枝原净与泰农的最终测定浓度梯度范围为0.015 μg/mL~256 μg/mL。
1.2.4 猪支原体对抗菌药物敏感性测定
参考Hannan的方法[11],采用微量肉汤稀释法测定抗菌药物对三种猪支原体的最小抑菌浓度(Minimum Inhibitory Concentration,MIC)。在96孔细胞微孔板中进行MIC测定。首先依次加入0.1 mL各浓度梯度的抗菌药物工作液,再接种等量的猪支原体悬液(1×104 CCU/mL~1×105 CCU/mL),此时药物浓度稀释两倍,同时设置菌株培养液作为阳性对照,KM2液体培养基作为阴性对照,各MIC试验设置三个平行。将 96孔细胞微孔板密封后置于37 ℃培养箱中静置培养,逐日观察颜色变化,记录初始MIC与终末MIC。以阴性对照孔不变色,阳性对照孔变色,试验孔不发生肉眼可见颜色变化的最低药物浓度为该药物对该菌的MIC。
2 结果
2.1 猪肺炎支原体对枝原净和泰农的敏感性结果
由表1和图1可见,枝原净(延胡索酸泰妙菌素)对10株受试猪肺炎支原体的MIC范围为0.015 μg/mL~0.25 μg/mL,经计算,其MIC50为0.06 μg/mL,MIC90为0.12 μg/mL。泰农(磷酸泰乐菌素)对猪肺炎支原体的MIC范围为0.03 μg/mL~ 0.06 μg/mL,各菌株的MIC分布相对集中,其MIC50和MIC90均為0.06 μg/mL。
2.2 猪鼻支原体对枝原净和泰农的敏感性 结果
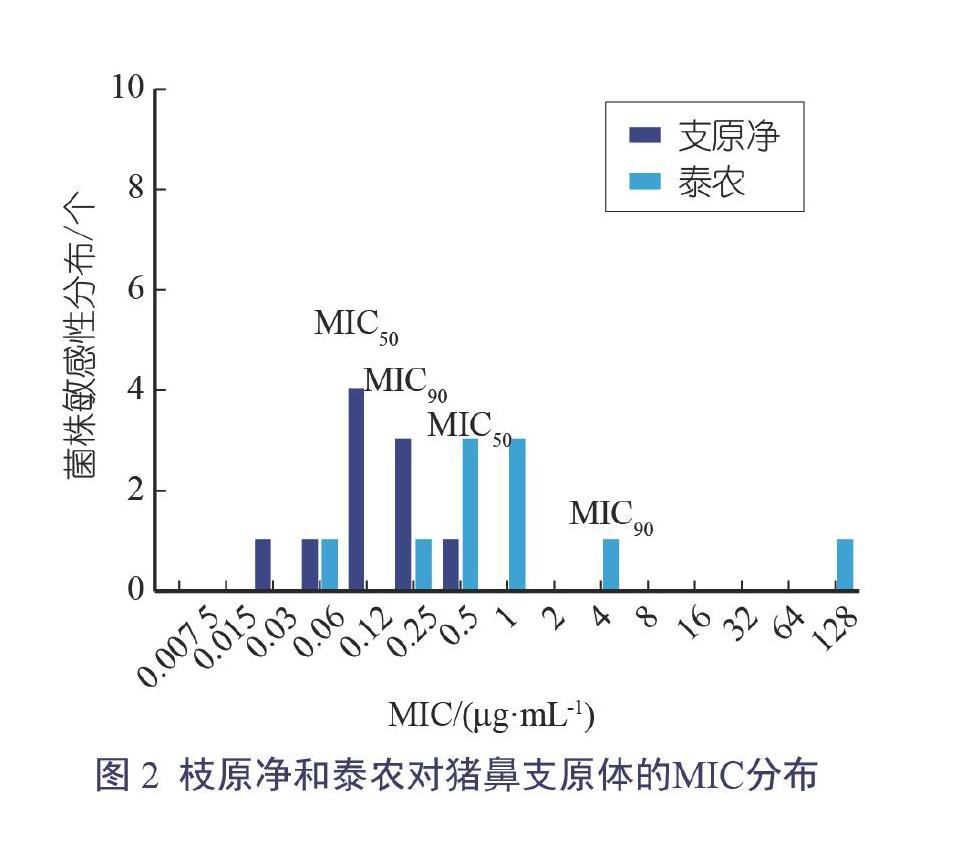
猪鼻支原体对枝原净和泰农的药物敏感性检测结果见表2和图2。
分析可知,枝原净对猪鼻支原体的MIC范围为0.03 μg/mL~0.5 μg/mL,MIC50为0.125 μg/mL,MIC90为0.25 μg/mL。 泰农对猪鼻支原体的MIC范围为 0.06 μg/mL~128 μg/mL,MIC50为 0.5 μg/mL,MIC90为4 μg/mL,其中11071603菌株的MIC高达128 μg/mL,可能为高水平耐药菌株。
2.3 猪滑液支原体对枝原净和泰农的敏感性结果
本研究所测猪滑液支原体为标准菌株ATCC27095,其对两种药物均敏感。枝原净对猪滑液支原体的MIC为0.03 μg/mL,泰农对其MIC为0.25 μg/mL。
3 讨论
支原体缺乏细胞壁结构,作用于细胞壁的β-内酰胺类药物对其无效,而作用于蛋白质合成和DNA复制环节的大环内酯类、四环素类和氟喹诺酮类药物具有较强的抗支原体效果[12]。本研究结果显示猪肺炎支原体分离株对临床常用的抗支原体药物(枝原净和泰农)均较为敏感。
目前国内有关猪肺炎支原体对抗菌药物敏感性的文献报道较少,2013年张纯萍等采用宏量肉汤稀释法测定了4株猪肺炎支原体对多种药物的敏感性,发现猪肺炎支原体对泰妙菌素和氟喹诺酮类药物(环丙沙星)最敏感,其次是四环素类、林可霉素和泰乐菌素,对氟苯尼考的敏感性较差[13]。国外早在1991年测定了10株猪肺炎支原体田间分离株对18种抗菌药物的敏感性,结果是泰妙菌素对猪肺炎支原体的MIC范围为0.03 μg/mL~ 0.06 μg/mL,MIC50为≤0.03 μg/mL,MIC90为0.06 μg/mL;对泰乐菌素的MIC范围为≤0.03 μg/mL~0.12 μg/mL,MIC50为 ≤0.06 μg/mL,MIC90为0.06 μg/mL[14];上述结果与本研究的测定结果较一致。2018年,Anne V Gautier-Bouchardon综述了近年猪肺炎支原体对多种抗菌药物的敏感性变化,发现2000年之前猪肺炎支原体的临床分离株对泰妙菌素的敏感性范围在≤0.006 μg/mL~0.3 μg/mL,对泰乐菌素的MIC范围为≤0.006 μg/mL~6.25 μg/mL;而2000年后分离株对泰妙菌素的MIC范围上升至≤0.01 μg/mL~0.125 μg/mL,对泰乐菌素的敏感性上升至0.008 μg/mL~16 μg/mL[9]。
在本研究中,受试猪鼻支原体对枝原净较为敏感。目前,猪鼻支原体的临床流行病学调查研究较为少见,我国尚未有相关报道。国外的调查数据显示2000年以前猪鼻支原体分离株对泰妙菌素的敏感性介于0.025 μg/mL~0.78 μg/mL,对泰乐菌素的MIC范围为≤0.03 μg/mL~ 25 μg/mL,2000年后分离株对泰妙菌素的MIC上升至0.2 μg/mL~1.56 μg/mL,对泰乐菌素的MIC上升至0.4 μg/mL~ 100 μg/mL,显示猪鼻支原体临床分离株对这两种药物的敏感性呈下降趋势[9]。Katinka Beko等测定了2014—2017年从匈牙利不同地区分离到的38株猪鼻支原体对15种抗菌药物的敏感性,结果发现猪鼻支原体对泰妙菌素的MIC范围为0.156 μg/mL~ 0.625 μg/mL,MIC50为0.156 μg/mL, MIC90为0.312 μg/mL;猪滑液支原体对泰乐菌素的MIC范围较宽,为 ≤0.25 μg/mL~>64 μg/mL,MIC50为 0.5 μg/mL,MIC90高达>64 μg/mL[15],与本研究结果一致。目前尚无临床上对泰乐菌素高度耐药的猪鼻支原体耐药机制的报道,因此值得进一步研究。
本研究測定了猪滑液支原体标准株ATCC27095对枝原净(MIC=0.03 μg/mL)和泰农(MIC=0.25 μg/mL)的敏感性。国内目前尚无猪滑液支原体流行病学的报道。国外相关研究报道了2000年前猪滑液支原体分离株对泰妙菌素的敏感性范围为 0.002 5 μg/mL~0.100 0 μg/mL,对泰乐菌素的MIC介于0.025 μg/mL~>10 μg/mL;2000年后猪滑液支原体分离株对泰妙菌素的MIC上升至≤0.25 μg/mL,对泰乐菌素的敏感性范围为≤0.25 μg/mL[9]~ 1.00 μg/mL[9]。K K Schultz等检测了1997—2011年分离到的24株猪滑液支原体田间分离株对18种抗菌药物的敏感性,结果为猪滑液支原体对泰妙菌素的MIC50为0.12 μg/mL,对泰乐菌素的MIC50为 0.25 μg/mL[16]。
4 结语
猪支原体病是造成国内外养猪业严重经济损失的重要疾病之一,抗菌药物仍是临床治疗猪支原体感染的快速有效的手段。本研究结果表明猪肺炎支原体、猪鼻支原体和猪滑液支原体对枝原净均较为敏感,枝原净可以作为临床治疗猪支原体感染的有效药物。泰农对猪肺炎支原体和猪滑液支原体的抑制效果较好。在兽医临床工作中,应加强对支原体的分子流行病学与抗菌药物敏感性的监测,从而制定科学合理的用药方案,为防控疾病的发生和蔓延提供理论依据和实践指导。
参考文献
[1] KOBISCH M,FRIIS N F. Swine mycoplasmoses[J]. Rev Sci Tech,1996,15(4):1569-1605.
[2] BOYE M,JENSEN T K,AHRENS P,et al. In situ hybridisation for identification and differentiation of Mycoplasma hyopneumoniae, Mycoplasma hyosynoviae and Mycoplasma hyorhinis in formalin-fixed porcine tissue sections[J]. APMIS,2001,109(10):656-664.
[3] MAES D,SIBILA M,KUHNERT P,et al. Update on Mycoplasma hyopneumoniae infections in pigs: knowledge gaps for improved disease control[J]. Transbound Emerg Dis,2018,65 Suppl 1:110-124.
[4] LUEHRS A,SIEGENTHALER S,GRUTZNER N,et al. Occurrence of Mycoplasma hyorhinis infections in fattening pigs and association with clinical signs and pathological lesions of Enzootic Pneumonia[J]. Vet Microbiol,2017,203:1-5.
[5] GOMES-NETO J C,RAYMOND M,BOWER L,et al. Two clinical isolates of Mycoplasma hyosynoviae showed differing pattern of lameness and pathogen detection in experimentally challenged pigs[J]. J Vet Sci,2016,17(4):489-496.
[6] THONGKAMKOON P,NARONGSAK W,KOBAYASHI H,et al. In vitro susceptibility of Mycoplasma hyopneumoniae field isolates and occurrence of fluoroquinolone, macrolides and lincomycin resistance[J]. J Vet Med Sci,2013,75(8):1067-1070.
[7] ROSALES R S,RAMIREZ A S,TAVIO M M,et al. Antimicrobial susceptibility profiles of porcine mycoplasmas isolated from samples collected in southern Europe[J]. BMC Vet Res,2020,16(1):324.
[8] XIONG W,SUN Y,ZENG Z. Antimicrobial use and antimicrobial resistance in food animals[J]. Environ Sci Pollut Res Int,2018,25(19):18377-18384.
[9] GAUTIER-BOUCHARDON A V. Antimicrobial resistance in Mycoplasma spp[J]. Microbiol Spectr,2018,6(4):425-444.
[10] BEKO K,KREIZINGER Z,KOVACS A B,et al. Mutations potentially associated with decreased susceptibility to fluoroquinolones, macrolides and lincomycin in Mycoplasma synoviae[J]. Vet Microbiol,2020,248:108818.
[11] HANNAN P C. Guidelines and recommendations for antimicrobial minimum inhibitory concentration (MIC) testing against veterinary mycoplasma species[J]. Vet Res,2000,31(4):373-95.
[12] MAES D,BOYEN F,HAESEBROUCK F,et al. Antimicrobial treatment of Mycoplasma hyopneumoniae infections[J]. Vet J,2020:259-260.
[13] 張纯萍,沈青春,胡海燕,等. 猪肺炎支原体体外抗菌药物敏感性试验研究[J]. 中国兽药杂志,2013,47(4):10-12.
[14] TER LAAK E A,PIJPERS A,NOORDERGRAAF J H,et al. Comparison of methods for in vitro testing of susceptibility of porcine Mycoplasma species to antimicrobial agents[J]. Antimicrob Agents Chemother,1991,35(2):228-233.
[15] BEKO K,FELDE O,SULYOK K M,et al. Antibiotic susceptibility profiles of Mycoplasma hyorhinis strains isolated from swine in Hungary[J]. Vet Microbiol,2019,228:196-201.
[16] SCHULTZ K K,STRAIT E L,ERICKSON B Z,et al. Optimization of an antibiotic sensitivity assay for Mycoplasma hyosynoviae and susceptibility profiles of field isolates from 1997 to 2011[J]. Vet Microbiol,2012,158(1-2):104-108.

