土壤镉污染的生物毒性研究进展
徐佳慧,王萌,张润,吴玲玲,2,*
1. 同济大学环境科学与工程学院,上海 200092 2. 上海污染控制与生态安全研究院,上海 200092
镉通过施肥、污水灌溉、大气降水和工矿废物排放等途径进入土壤,对现代环境影响日益增大。世界各国对土壤镉污染的评价标准不同,印度土壤中镉的限值为3~6 mg·kg-1[1],我国农用地镉标准为0.3 mg·kg-1(pH≤5)[2]。据报道,镉是印度土壤的主要污染物,土壤中镉平均含量达14.16 mg·kg-1[1]。我国土壤污染主要为无机物污染,镉的点位超标率高达7%,远超过其他无机污染物[3]。与其他重金属相比,镉在土壤中的迁移性较强,容易被动物、植物和微生物吸收、转移并大量积累,影响土壤生物的正常生命活动,并可通过食物链转移到人体,严重损害人类健康。同时,环境条件和生物因素影响土壤中镉的生物毒性。因此,为准确识别土壤中镉的生态风险,亟需全面了解镉对土壤生物的毒性作用。本文在总结近年来国内外相关研究的基础上,综述了镉污染对土壤中微生物、植物和动物的毒性作用,对影响土壤中镉毒性的生物及非生物因素进行总结,介绍了研究土壤中镉生物毒性的方法,并对今后研究方向进行探讨,以期为土壤镉生态风险评价提供重要信息,并为完善土壤环境质量评价体系提供科学依据。
1 土壤中镉的生物毒性(Biotoxicity of cadmium in soil)
土壤镉污染可以对土壤生物产生毒性效应,影响土壤微生物种群和群落结构、氧化还原等生化反应及土壤酶活性;干扰植物对营养元素的吸收,抑制光合作用,引起氧化应激与基因损伤,影响植物的生长代谢;影响土壤动物的氧化还原平衡、基因表达、繁殖能力以及行为等方面,最终导致种群数量与物种多样性下降。
1.1 微生物
过量的镉通过干扰基因的调控而影响微生物酶蛋白的活性,损害土壤微生物代谢途径,导致细胞凋亡,影响土壤微生物的种群和群落结构,硝化、氨化等过程以及土壤酶活性也会受到抑制。
氨氧化细菌对镉非常敏感,镉主要通过消除氨氧化细菌,防止质子产生,从而抑制硝化作用和酸化作用,但镉对氨氧化古菌的生长有刺激作用[4]。古菌具有优越的生理和遗传适应能力,可以在金属胁迫下生存,其渗透性差的膜和有效的转运系统可以充当壁和泵,从而避免毒物进入细胞[4-5]。不过,镉污染土壤中古菌的硝化作用始终很小,这些高度耐受的氨氧化古菌可能会优先通过其他代谢过程而不是氨氧化来获取能量[6]。
镉通过与土壤酶-底物复合物相互作用,使酶蛋白变性或与蛋白活性基团相互作用来降低酶的活性,还可以影响微生物细胞合成酶。Tian等[7]发现不同阴离子镉化合物对土壤脱氢酶和碱性磷酸酶活性的影响不同,乙酸或硝酸盐形式的镉对脱氢酶的敏感性高于硫酸盐和氯化物,而后者对碱性磷酸酶的毒性高于前者,这可能是由于与镉相关的阴离子种类对不同土壤酶的影响机制不同,包括其在土壤中独特的吸附能力、与土壤组分的相互作用以及改变土壤酶对其底物的亲和力。脱氢酶的动力学参数也受到镉影响,在棕壤和红壤中,镉对土壤脱氢酶的抑制动力学机制为反竞争抑制,抑制常数(Ki)分别为4.7 mmol·L-1和12 mmol·L-1[8]。
镉影响土壤微生物数量和群落组成。过量的镉抑制微生物生物量碳和磷脂脂肪酸,阻碍微生物种群的繁殖。Wu等[9]的研究表明,在细菌中,放线菌丰度明显降低,而变形杆菌和厚壁菌门则相应增加,在真菌中,最具优势的亚目(子囊)明显减少,而接合菌科则显著增加。Han等[10]发现在含有0.001~5 mg·kg-1镉的土壤中,革兰氏阳性菌在6~24 h内占优势,相对丰度为45%~60%,而在72 h时,革兰氏阴性菌发展为优势菌,几乎占主导地位,相对丰度为55%,群落组成变化可能与镉对土壤碱性磷酸酶的兴奋效应有关,在兴奋效应前(6 h),革兰氏阳性菌的相对丰度大于革兰氏阴性菌,而在兴奋效应后(72 h),相对丰度正好相反。
1.2 植物
植物体内的氧化还原平衡受镉影响。在一定程度的镉胁迫下,植物可以提高抗氧化酶的活性,从而清除活性氧而存活,但在更高的镉胁迫下,抗氧化酶的活性降低,导致抗氧化防御酶系统性能下降,产生过量的活性氧,造成氧化损伤。研究表明,50 mg·kg-1镉导致菠菜叶片与根系抗坏血酸过氧化物酶活性明显升高[11],6 mmol·L-1镉可引起生菜叶片抗坏血酸盐过氧化物酶与超氧化物歧化酶活性显著增强,9 mmol·L-1镉则导致其活性下降,而过氧化氢酶活性变化均不大[12],小麦对镉的响应与生菜不同,镉导致小麦叶片与根系超氧化物歧化酶活性明显降低,叶片过氧化氢酶活性明显增强,而根系过氧化氢酶活性降低[13]。可见植物抗氧化酶水平变化与镉浓度、植物品种及部位有关。此外,镉还会增加植物体内的丙二醛和离子渗漏水平,引起氧化应激效应。例如,50 mg·kg-1镉引起菠菜叶片与根系丙二醛含量明显升高[11];在栽培60 d后,10、37和55 mg·kg-1镉导致桑树叶片电解质渗出率分别增加9.2%、28.1%和43.7%[14]。
活性氧的过量产生损害DNA修复系统,如错配修复、核苷酸切除修复与碱基切除修复等,造成基因毒性效应[15]。在镉胁迫下,小麦[15]和水稻[16]幼苗基因组模板稳定性明显下降。镉也可抑制植物细胞有丝分裂和损伤染色体。研究发现,5 mg·kg-1镉引起蚕豆初生根尖细胞有丝分裂指数明显降低,10 mg·kg-1镉导致蚕豆次生根尖细胞的微核率与染色体畸变率明显升高[17]。
过量活性氧也可导致叶绿素和类胡萝卜素含量下降,损害光合系统。过量的活性氧阻断光合系统Ⅱ的蛋白合成和恢复,直接或间接地降低D1蛋白水平,最终导致反应中心功能受损,同时,镉可通过抑制光合系统Ⅱ的新生蛋白合成和光活化来增强光合系统Ⅱ的失活[18]。在镉胁迫下,光合系统Ⅱ的电子传递速率下降,从而引起气孔关闭[19]。此外,镉通过降低光合作用相关基因的转录、使参与二氧化碳固定的酶失活、增强蛋白质水解、干扰氮和硫的代谢而阻碍光合作用[20]。
在镉胁迫下,植物对各种营养物质的吸收和积累可能发生较大的变化,简单总结了镉对农作物吸收营养元素的影响(表1)。铜可作为二价或一价阳离子被吸收,铁还原酶将Cu2+转化为Cu+,镉的存在可以优化这种酶的作用,从而可以提高铜的吸收率[21]。磷、锰与镉的解毒有关,植物可以通过吸收更多的磷和锰来降低镉的毒性作用[21-22]。
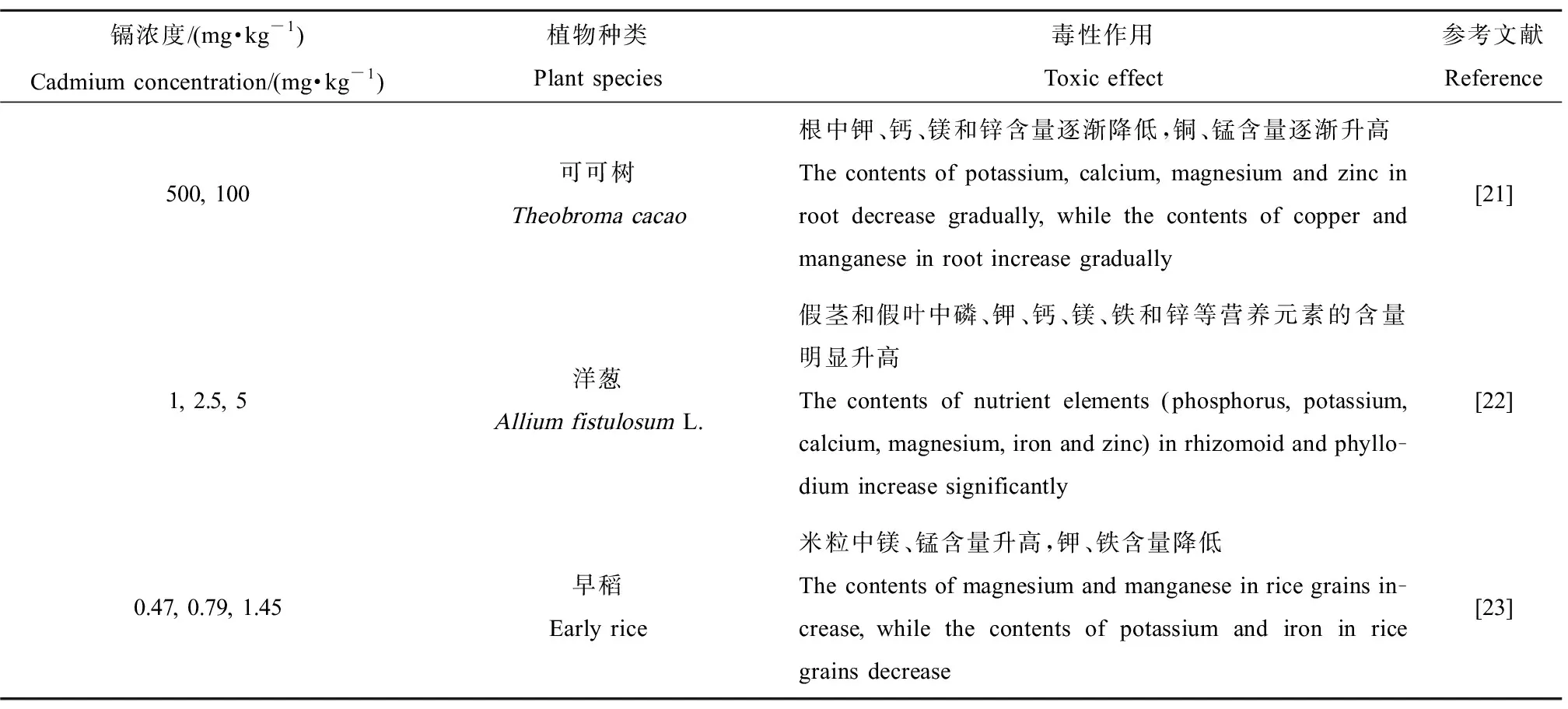
表1 土壤中镉对农作物吸收矿物元素的影响Table 1 Effect of cadmium in soil on the absorption of mineral elements by crops
镉影响植物对养分的吸收和积累,抑制光合作用,引起氧化应激与基因损伤,进而导致植物生长迟缓。在镉胁迫下,植物不同部位(如叶片、茎和根)生长受抑制。例如,6 mg·kg-1镉导致水稻幼苗的根与茎长度、面积和数量均显著下降[24]。200 mg·kg-1镉引起萝卜的茎和块根长度、鲜生物量和干生物量明显下降[25]。
镉除了抑制植物的营养生长,其生殖生长也受到镉的影响。镉显著降低花粉萌发率,影响花粉管发育。近年来的研究表明,青扦花粉对镉高度敏感,镉通过破坏内膜细胞器,抑制胞吞/胞吐作用和形成酸性液泡来强烈抑制花粉萌发和管子生长,导致花粉管头肿胀和管直径不规则加宽[26]。Pan等[27]发现,镉对茶花花粉萌发和花粉管生长的抑制作用与镉浓度呈正相关关系,其花粉管顶端透明区也会受到镉的破坏,这可能与线粒体丙酮酸脱氢酶复合物E1α(CsPDC-E1α)基因过量表达有关。此外,镉抑制种子萌发,活性氧浓度过高也会导致种子不可逆损伤。
1.3 动物
土壤动物是土壤生态系统中的重要组成部分。镉污染可以导致土壤动物产生氧化应激、基因表达异常、生长迟缓、繁殖能力下降和行为改变等,最终导致动物数量和多样性降低。
镉胁迫会诱发土壤动物体内产生过量活性氧和醛类物质,破坏氧化还原平衡状态,引起氧化应激,对动物造成氧化损伤。研究表明,镉对蚯蚓氧化应激效应与镉暴露时间、剂量及蚯蚓种类有关。Maity等[28]对比了赤子爱胜蚓(Eiseniafetida)和沃真云蚓(Eutyphoeuswaltoni)经镉暴露14 d后的氧化应激反应,结果表明,随着镉暴露剂量和暴露时间的增加,赤子爱胜蚓体内谷胱甘肽水平逐渐降低,而沃真云蚓体内谷胱甘肽水平均随着镉暴露剂量和暴露时间增加显著升高。Sinkakarimi等[29]的研究表明,250 μg·g-1的镉暴露可引起梯形流蚓(Aporrectodeatrapezoides)、玫瑰色蚯蚓(Aporrectodearosea)和赤子爱胜蚓体内丙二醛含量明显升高,前2种蚯蚓体内丙二醛含量明显高于赤子爱胜蚓。
在镉胁迫下,土壤动物的基因表达水平发生变化。0.6 mg·kg-1的镉可诱导赤子爱胜蚓体内金属硫蛋白基因(MT)表达,其表达量与镉剂量呈显著正相关,这是由于作为一种应对机制,在镉胁迫下,可以诱导MT表达,从而缓解镉中毒,而低剂量镉诱导钙网蛋白基因表达,加速蚯蚓内质网的蛋白质合成、折叠和加工过程,在高剂量镉胁迫下,可能会损害包括内质网在内的细胞功能,从而降低钙网蛋白基因表达[30]。在10、30和60 mg·kg-1镉胁迫下,赤子爱胜蚓体内凋亡抑制因子1(TRIAP1)基因表达量显著增加[31]。而TRIAP1基因作为一种细胞存活因子,在低水平基因毒性刺激下可减少细胞死亡。这说明,在低水平镉胁迫下,蚯蚓会产生应激反应,引起TRIAP1基因过表达,从而减少细胞凋亡。0.3 mg·kg-1镉会诱导白符跳(Folsomiacandida)体内类金属硫蛋白(MTC)基因表达[32],表明MTC基因的差异表达可作为检测土壤中低水平镉污染的生物标志物。
土壤动物的生长速率与镉呈现显著负相关关系。研究表明,赤子爱胜蚓暴露于镉含量为2.51 mg·kg-1的土壤中30 d后,其体重下降11%[33]。5.7 mg·L-1的镉暴露可引起秀丽隐杆线虫(Caenorhabditiselegans)的体长缩短一半[34];Nica等[35]发现蜗牛肝胰腺中镉浓度最高时,壳生长受到显著抑制,受损壳出现频率最高。此外,研究发现,镉会抑制土壤动物的繁殖,在镉胁迫下,白符跳体内排卵激素基因表达量随镉浓度增加而降低,从而抑制其繁殖能力[30]。蚯蚓幼虫的阴蒂形成延迟,产茧受到抑制,并对成虫的生殖有抑制作用[36]。
土壤动物的正常行为受到镉的干扰,如产生回避行为、运动能力下降。牛晓倩[37]发现,通卷甲虫、多霜腊鼠妇和中华蒙潮虫等在爬行中明显回避镉污染的土壤区域。镉影响线虫在琼脂板上和液体培养基中的运动能力,其爬行速度和摆动频率明显下降[38]。蚯蚓的挖穴能力也受到镉的干扰,掘穴时间、蚓洞长度与土壤受镉污染程度呈现显著的负相关关系[39]。
镉污染可以降低土壤动物的存活率。研究表明,随着土壤镉浓度的增加,蚯蚓密度和辛普森多样性指数呈反比下降,在镉污染程度较高的土壤中,蚯蚓幼虫死亡率较高[40]。目前,镉对线虫的毒性研究大多采用水溶液培养秀丽隐杆线虫的标准生态毒理试验,在水试系统中秀丽隐杆线虫对镉很敏感。暴露于21 mg·L-1镉中48 h,秀丽隐杆线虫的死亡率达50%[38]。然而,Johansen等[41]发现,暴露于镉含量高达2 000 mg·kg-1的土壤中14 d,线虫的存活率才有较大降低。这是由于在土壤系统中,镉会与土壤颗粒结合,降低镉的生物利用度。
2 影响土壤中镉生物毒性的因素(Factors affecting the biotoxicity of cadmium in soil)
土壤中镉的生物毒性主要受非生物和生物因素影响,非生物因素包括土壤理化性质、老化作用、元素间的相互作用和化学添加剂等,生物因素包括生物类型、母体转移、生物活动和土壤中促进植物生长的微生物等。
2.1 非生物因素对镉生物毒性的影响
2.1.1 土壤理化性质
土壤的阳离子交换能力(CEC)、氧化还原电位(Eh)和水分等,在一定程度上影响镉的生物毒性。研究表明,镉对脱氢酶与碱性磷酸酶的抑制作用与土壤CEC负相关[45];稻米中镉含量与土壤Eh正相关[46];随着土壤水分逐渐升高,稻苗和稻草中镉含量逐渐降低[47]。
镉的释放行为与土壤的盐度也密切相关,在相同条件下,土壤镉释放量随着土壤盐度的增加而增加,交换性或还原性镉的含量升高,从而镉的生物毒性也随之增加,此外,镉的氯络合作用也可提高其生物利用度。在高镉水平下添加氯化钠可显著提高碱蓬和黄花补血草的镉生物利用度[48]。土壤盐渍化可降低镉污染土壤中的古菌丰度和多样性,改变其主要的古菌类群(丰富奇古菌门和广古菌门的类群)[49]。
2.1.2 老化作用
在老化进程中,镉可通过各种机制包括微孔扩散、空穴截留、固相表面沉淀或共沉淀等转化为更稳定的部分(铁锰氧化物部分和矿物晶格部分),从而逐渐降低其迁移率和生物利用度。随着老化时间的增加,镉对赤子爱胜蚓半数致死浓度(LC50)显著增加,土壤中交换性镉含量和赤子爱胜蚓组织中交换性镉含量显著降低[50]。刘彬等[51]发现,在老化进程中,镉对水稻生长毒性的半抑制浓度(EC50)值明显增加。因此,在含镉土壤老化进程中,镉的生物毒性逐渐降低。
2.1.3 元素间相互作用
土壤中存在多种污染物,其他污染物也会影响镉的生物毒性。不同污染物对镉生物毒性的影响机理复杂,涉及二元、三元及以上混合物的毒性。部分有机污染物可减轻镉对生物的毒性作用。研究发现,抗生素恩诺沙星能降低镉对土壤酶活性和微生物功能多样性的抑制作用[52]。菲可显著降低镉引起的蚯蚓死亡率和体重损失[33]。部分有机污染物也可增强镉的毒性效应。例如,四溴双酚A增强镉对蚯蚓的急性毒性、生长抑制、体壁组织病理学改变和氧化应激等毒性作用[53]。农药阿特拉津增强镉对赤子爱胜蚓的毒性作用,而阿特拉津与毒死蜱的存在明显降低镉对蚯蚓的毒性效应[54]。因此,多种混合污染物共同暴露可能会改变其中一种污染物对镉的毒性作用的影响机理。在不同污染物浓度下,土壤中其他污染物对镉的毒性作用影响可能不同。低水平的镉与除草剂环草隆联合暴露对赤子爱胜蚓表现出强烈的协同作用,而在高水平下产生拮抗作用[55]。在低水平镉胁迫下,铅增强镉对赤子爱胜蚓的DNA损伤,而在高水平镉胁迫下,铅减轻镉对蚯蚓的DNA损伤[56]。
2.1.4 化学添加剂
钙可以作为外源物质,通过减轻植物的生长抑制、调节镉的吸收和转运、改善光合作用和减轻氧化损伤来保护植物免受镉毒害[57]。在50 μmol·L-1镉胁迫下,添加氯化钙可使蚕豆根尖有丝分裂指数明显升高,其微核率与染色体畸变率显著降低[58]。施用硫化物和甜菜碱也可减轻镉对植物的毒害。硫化氢通过保护光合作用机制、调节抗氧化防御系统、抑制镉向地上部分转移、促进气孔开放和减少落叶等,促进镉胁迫下种子萌发和植株生长[59]。在镉胁迫下,向菠菜叶面施用甜菜碱也能降低镉的吸收量和改善抗氧化防御系统,减轻菠菜中镉的毒性[11]。
2.2 生物因素对镉生物毒性的影响
2.2.1 生物类型
不同种类生物对镉的敏感性不同,镉胁迫对土壤动物、植物和微生物会产生不同的毒性效应。部分植物可超富集镉。作为我国居民常见蔬菜之一的白菜对土壤镉有很强的耐受性,根部可积累大量的镉[60]。金银花也可以吸收大量镉,而镉对金银花的光合速率、总生物量和叶绿素含量无明显影响[61],可以用此类耐镉植物来修复土壤镉污染。
2.2.2 母体转移
母体转移增强镉对其后代的毒性。Fajana等[62]发现,成年奥甲螨(Oppianitens)将其体内39%~52%的镉转移给幼螨,而母源性获得的镉占幼螨体内镉的41%。镉世代遗传的可能性意味着,F1后代除了从土壤中吸收镉外,还承受其父母体内的镉。
2.2.3 生物活动
蚯蚓通过挖穴、摄食和排泄等活动影响镉的迁移和利用率。Coeurdassier等[63]将蜗牛分别暴露在有蚯蚓和无蚯蚓的含镉土壤中2周,结果表明,有蚯蚓的含镉土壤处理组中蜗牛体内的镉含量高于无蚯蚓的含镉土壤处理组。成杰民等[64]发现,蚯蚓活动使黑麦草根部吸收更多的镉,且黑麦草相对于土壤从蚓粪中可吸收更多的有效态镉。研究表明,在含蚯蚓的土壤中,玉米根际土壤的微生物种类随镉浓度的增加而增加[65]。
2.2.4 土壤中促进植物生长的微生物
一些有益的细菌和真菌作为促进植物生长的微生物,可以通过诱导对抗植物病原体的防御机制、产生促进植物生长的物质和分泌特定酶来减轻镉对植物的毒性和间接刺激植物生长,还可以通过各种机制(如酸化、沉淀、螯合、络合和氧化还原反应)改变土壤中镉的生物利用度,降低镉对植物的毒性作用[66]。
3 土壤镉生物毒性的研究方法(Methods of research on biotoxicity of cadmium in soil)
3.1 土壤微生物
相比于植物和动物,微生物对镉更敏感。研究指标主要包括微生物数量和多样性、土壤呼吸、土壤酶、磷脂脂肪酸、净硝化速率、硝化势以及铵耗率等。通过颜色平均变化率、香农指数、麦金托什指数、辛普森指数和底物利用率等指标以及聚合酶链反应-变性梯度凝胶电泳、amoA基因定量PCR、高通量测序、荧光原位杂交和荧光定量PCR等技术研究土壤微生物群落结构,其中,常用amoA基因定量PCR技术研究氨氧化微生物的多样性。土壤酶对镉污染敏感,常被用作生物指标,用于检测和定量镉的毒性,通常采用生态剂量(EDx)指数作为镉对酶毒性的指标,然而,基于酶活性测量的EDx值可能会随着用于测量酶活性的底物类型和浓度以及用于描述响应行为的生态剂量-响应模型而变化。酶动力学可以表征酶在镉胁迫下的催化能力(Vmax)和底物亲和力(Km),进而可以用来计算反映镉与土壤酶相互作用内在性质的抑制常数(Ki)。这些基于酶动力学的参数不随底物浓度变化,因此,为镉对土壤酶的抑制强度提供了更直接、更现实的测量方法[8]。此外,采用土壤酶作为生物指标评估镉污染也应当考虑不同阴离子镉化合物对土壤酶的影响[7]。
3.2 植物
从氧化应激、基因表达、养分吸收、光合作用、营养生长和生殖生长等方面研究镉对植物的毒性作用。通过光合色素含量、净光合速率、有效量子产率、光合光子通量密度、电子传递速率、光化学猝灭、气孔导度和叶片蒸腾速率等指标研究镉对光合作用的影响。在遗传水平上,随机扩增多态性DNA分析(RAPD)可有效检测镉诱导的遗传多态性,目前主要以基因组模板稳定性、微核率、有丝分裂指数和染色体畸变率等表征镉对植物的基因毒性。在氧化应激方面,主要以抗氧化酶活性、非酶抗氧化剂(抗坏血酸、谷胱甘肽、类胡萝卜素、生物碱、生育酚、脯氨酸、酚类化合物、黄酮类化合物和丙二醛)含量[12]和电解质渗出率等作为生物标志物。也有研究利用镉污染土壤浸提液或者淋洗液进行毒性试验,例如,利用种子在土壤浸提液中进行发芽和根伸长毒性试验。为了进行细胞毒性和基因毒性评估,将青葱的根暴露于土壤浸提液中,以根的生长、有丝分裂的频率、根分生组织细胞的有丝分裂和染色体异常、脂质过氧化水平和DNA损伤为毒性终点[67]。
3.3 土壤动物
目前重点研究了镉对土壤动物的酶反应、能量储备反应、神经冲动传导率的反应、溶酶体膜稳定性、基因表达、繁殖能力、行为方式的影响以及组织病理学损伤和氧化损伤。研究主要以活性氧、抗氧化酶和丙二醛作为氧化应激的生物标志物。在遗传水平上,通过转录组测序技术(RNA-Seq)、RAPD分析和实时荧光定量PCR技术等检测基因表达水平。也可采用彗星试验、荧光原位杂交法和8-羟基脱氧鸟苷(8-OHDG)含量等测定DNA损伤。
3.4 水生生物
土壤中镉在雨水、生活废水等冲刷下流向水体,因此,也可采用水体生物来测试土壤中镉的生物毒性,常用的如大型蚤、发光细菌。通常先对含镉土壤进行浸提或者淋洗获得土壤溶液,基于土壤溶液进行水体生物毒性试验。大型蚤在镉污染土壤测试中,主要研究指标为运动抑制率,其运动能力对镉污染土壤的浸提液较敏感[68]。镉抑制发光细菌的发光强度,以发光强度的变化表征镉的毒性,常用的发光细菌包括费氏弧菌、明亮发光杆菌和青海弧菌。
4 结论与展望(Summary and outlook)
镉可导致土壤生物数量和多样性减少、生长代谢减缓、氧化损伤与基因表达异常等。影响镉生物毒性的因素较多,主要通过影响镉生物有效性引起毒性变化,其中,pH和有机质为主要影响因素,部分生物也影响镉的迁移性和溶解度,可利用超富集植物来修复土壤镉污染,施用有机质、钙、硫化物和甜菜碱等也能减轻镉的毒性作用。总体而言,土壤镉生物毒性研究取得了较大进展,但尚有一些方面值得进一步研究:
(1)关于土壤无脊椎动物中镉的母体转移研究甚少,需要更多深入研究。母性的镉在土壤无脊椎动物体内的转移对土壤无脊椎动物种群具有生态学和毒理学意义,在制定镉和其他非必需重金属的环境土壤质量准则时,应将母源性转移纳入标准。
(2)目前,镉对蚯蚓的毒性研究主要基于人工土壤,以赤子爱胜蚓作为实验对象。然而,天然土壤的性质影响镉的毒性,且本土蚯蚓与赤子爱胜蚓对镉的敏感性存在差异,因此,应该利用天然土壤和本土蚯蚓进行田间试验,提高研究结果的可靠性与有效性;同样地,镉对土壤线虫的毒性研究主要在水系统中以秀丽隐杆线虫为实验对象,其毒性效应与实际在土壤中产生的毒性作用相差较大,应加强线虫的原位测试,提高实验结果和风险评估的真实性与可靠性。
(3)对不同镉胁迫条件下植物根部中央组织和细胞的变化研究较少;与镉对营养生长的影响相比,关于镉对植物的生殖发育阶段影响的知识仍然相对匮乏,今后应引起更多的关注。
(4)土壤藻类可能是一种有效的生态毒性测定生物,关于镉对陆生藻类的毒性研究相对匮乏,需要更多深入研究;不同土壤类型的土壤酶在自然镉污染梯度上的动力学特性也需要进一步研究;镉对土壤硝化细菌的生态毒性仅限于功能基因的定量拷贝,其转录水平可能有待进一步研究。
(5)今后可采用更多的水体生物深入研究土壤中镉的生物毒性,如斑马鱼等模式生物。

