蚯蚓肠道细菌生态功能及毒理学研究进展
晁会珍,孙明明,*,朱国繁,叶茂,张胜田,刘满强,胡锋
1. 南京农业大学资源与环境科学学院,土壤生态学实验室,南京 210095 2. 合肥工业大学资源与环境工程学院,地下水实验室,合肥 230009 3. 中国科学院南京土壤研究所,土壤环境与污染修复重点实验室,南京 210008 4. 生态环境部南京环境科学研究所,国家环境保护土壤环境管理与污染控制重点实验室,南京 210042
蚯蚓肠道中富含大量内生细菌,肠道中每克干重需氧菌和厌氧菌的数量大约是土壤中的12倍~40倍和10倍~4 000倍,它们不仅对蚯蚓自身新陈代谢及机能稳定具有重要调节作用,而且还有利于蚯蚓对土壤中有机物质的分解及养分元素(碳、氮和磷)的转化[1-2]。蚯蚓肠道是接近于厌氧状态的微环境,其中,内生细菌群落主要来源于土壤,但与土著细菌群落结构和组成因环境的不同而存在显著差异[3]。由于特殊的生境体系,蚯蚓肠道细菌群落具有富集碳、氮和磷元素的能力,其含量约为土壤的2倍~5倍,这使得蚯蚓肠道细菌在促进土壤中有机污染物、微塑料和抗生素的降解以及重金属的解毒过程中发挥了重要作用[4]。但是,过量污染物的存在也会对蚯蚓自身免疫系统及肠道细菌的群落多样性产生负面影响。因此,进一步探明蚯蚓肠道细菌群落结构和功能多样性的特征规律,挖掘蚯蚓肠道细菌环境功能潜力,对于促进农业生产及污染土壤可持续修复治理具有重要的理论和现实意义。
1 蚯蚓肠道细菌群落组成(Bacteria community in earthworm gut)
蚯蚓通过吞食土壤而摄入的土著菌群,其结构会随着肠道的运转和发酵发生变化;后期蚯蚓又通过排出蚓粪等方式改变土壤细菌群落,这就使土壤、蚯蚓肠道和蚓粪中的细菌群落既相互联系又有一定的区分度[5]。蚯蚓肠道细菌群落组成对蚓粪的产出速率和质量有重要的影响,而蚓粪中细菌的种类和数量是抑制土传病害、缓解土壤污染物毒害的关键因素[6]。因此,探明3种介质中细菌群落结构的内在关联和差异能够为土壤养分管理及蚓粪的品质的提升提供科学依据。
1.1 蚯蚓肠道细菌群落组成特点
蚯蚓肠道是蚯蚓消化系统最重要的器官之一,肠道为厌氧环境,且pH接近于中性(6~7)[4,7],因而,蚯蚓肠道优势细菌通常是在厌氧或兼性厌氧条件下可以生存的特殊菌群,例如:变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria)[8];同时内生菌群的结构组成也会随着蚯蚓种类、生活习性和周边土壤生境特征发生动态变化。Knapp等[9]对粉正蚓(Lumbricusrubellus)的肠道菌群进行检测,该蚯蚓取自阿尔卑斯山脉中部的高山牧场,并且在牛粪中喂养6周后,利用聚合酶链反应-变性梯度凝胶电泳技术检测发现变形菌门、厚壁菌门、拟杆菌门、疣微菌门(Verrucomicrobia)和放线菌门为肠道优势菌群,在肠道总细菌群落的丰度占比分别为36%、20%、17%、10%和3%(表1);Pass等[3]利用16S rRNA焦磷酸测序技术对砷污染地区粉正蚓的肠道细菌群落进行检测,发现该蚯蚓肠道中以变形菌门、放线菌门、拟杆菌门和酸杆菌门(Acidobacteria)为优势菌群,丰度分别为总细菌群落的50%、30%、6%和3%(表1)。Meier等[10]利用高通量技术检测到草地中陆正蚓(Lumbricusterrestris)的肠道优势菌群分别为变形菌门(30%)、放线菌门(28%)、软壁菌门(Tenericutes)(13%)、绿弯菌门(Chloroflexi)(7%)、浮霉菌门(Planctomycetes)(7%)和疣微菌门(4%)(表1)。爱胜蚓属(Eisenia)是一类分布较为广泛的蚯蚓,因其生活周期短、繁殖力强和易于饲养等特点,被应用于许多研究。Wang等[11]为探究牛粪堆肥中赤子爱胜蚓(Eiseniafetida)的肠道细菌组成,利用高通量技术检测出蚯蚓肠道菌群共有24个门,优势菌群丰度由大到小分别为变形杆菌(50%)>软壁菌门(33%)>放线菌门(9%)>拟杆菌门(7%)(表1);Singh等[12]用木质纤维素生物基质喂养赤子爱胜蚓(Eiseniafoetida)和Perionyxexcavates30 d后,利用宏基因组测序技术分析2种蚯蚓肠道细菌群落组成,发现2种蚯蚓肠道细菌均以厚壁菌门为优势菌,疣微菌门和绿弯菌门只在赤子爱胜蚓中检出,而螺旋体门仅在Perionyxexcavates肠道内检测出(表1)。周艳玲等[13]对峨眉山秉氏环毛蚓(Pheretimacarnosa)肠道的可培养细菌进行分离培养,发现细菌全部属于厚壁菌门、变形菌门和放线菌门,丰度分别为68%、29%和3%(表1)。因此,蚯蚓肠道细菌群落的种类和丰度随着蚯蚓的品种和外界环境等多因素发生相应的变化,且变形菌门、厚壁菌门、放线菌门和拟杆菌门通常是蚯蚓肠道中主要的优势菌群。
1.2 蚯蚓肠道和土壤细菌群落组成差异
土壤是蚯蚓掘穴、摄食、消化和排泄的场所,为蚯蚓的生存提供了适宜的条件;同时,蚯蚓也通过自身活动改善土壤结构、提高土壤通透性、参与土壤能量传递和物质循环等。土壤是相对开放的空间,受外界扰动较大,氧气含量、土壤含水量、pH值以及养分随着土壤质地的改变而变化;相较于土壤,蚯蚓肠道的厌氧环境和高含量的碳、氮则给内生细菌的定殖和存活提供了一个相对稳定的空间。芽孢杆菌属(Bacillus)和梭状芽胞杆菌属(Clostridium)是土壤中常见的细菌,但是其在土壤中的数量通常比蚯蚓肠道低,主要是因为肠道中高含量的氨基酸和糖底物能刺激它们的定殖和增殖,因此,当芽孢杆菌属和梭状芽胞杆菌属的细菌进入蚯蚓肠道后,数量和活性均会显著增加[14]。一些厌氧或兼性厌氧菌,如葡萄球菌属(Staphylococcus)、气单胞菌属(Aeromonas)在蚯蚓肠道中的生存能力也相应增强[15]。此外,如表1所示,蚯蚓肠道、土壤及蚓粪中细菌群落组成具有一定的同源性,然而在门的水平的相对比例上有一定差异。Montagna等[16]利用高通量检测技术发现阿尔卑斯山脉原状土壤中,变形菌门的相对丰度为15%,未检测到厚壁菌门;而在同地区的粉正蚓肠道中,变形菌门的相对丰度高达36%,厚壁菌门的相对丰度为20%[9](表1);指出该地区土著蚯蚓对于土壤中变形菌门和厚壁菌门具有亲和性和共生关系。Liu等[17]将秉氏环毛蚓放置在黄棕壤中培养10 d后,发现蚯蚓肠道变形菌门的相对丰度为45%,而土壤中变形菌门的丰度只占22%,并且还检测到蚯蚓肠道中厚壁菌门的比例大于黄棕壤,相对丰度分别为42%和2%(表1)。Navrátilová等[18]利用高通量技术分析草地土壤中细菌群落组成,发现土壤中的放线菌门(8%)为优势菌群,丰度比例明显小于草地中粉正蚓肠道放线菌门(30%)(表1)。然而,并不是所有细菌均能适应蚯蚓肠道环境。Pass等[3]在研究砷对粉正蚓体内微生物组影响时发现,酸杆菌是土壤微生物主要的群落组成之一,占总数的35%,但在同一地区发现蚯蚓肠道中的酸杆菌门只有总数的3%(表1);Liu等[17]同样发现蚯蚓肠道中酸杆菌门的数量小于土壤,丰度分别为1%和31%(表1);Naether等[19]在探究不同环境因子对酸杆菌的影响时,发现该类菌在土壤养分缺乏的环境能生长良好,且有与碳、氮含量呈负相关的趋势,而蚯蚓肠道碳、氮含量往往是土壤的2倍~5倍,这可能是导致土壤中酸杆菌数量高于蚯蚓肠道的原因。因此,土壤和蚯蚓肠道细菌群落组成差异主要来源于二者环境的不同,且蚯蚓肠道中的厌氧或兼性厌氧菌的数量普遍高于土壤。
1.3 蚯蚓肠道和蚓粪中细菌群落组成差异
蚯蚓粪是自然界中多种有机废弃物经发酵后,在蚯蚓体内消化酶系统的综合作用下,迅速分解转化而成的一类环境友好型高效养分有机肥资源。因此,蚓粪中细菌群落的组成和蚯蚓肠道内生菌群有着密不可分的关系。由于蚯蚓肠道更加适合厌氧或兼性厌氧菌的生存,所以细菌经过肠道运转后,蚓粪中厌氧菌的数量高于原始基质[20]。Koubová等[5]将安德爱胜蚓(Eisentiaandrei)放入由牛粪、稻草杆和有机废弃物组成的基质中进行饲养,并利用聚合酶链-变性梯度凝胶电泳技术,对基质、蚯蚓肠道及蚓粪中细菌群落进行检测,发现在基质中厚壁菌门丰度为总细菌群落的19%,而蚯蚓肠道和蚓粪中厚壁菌门的丰度比例分别达到63%和36%(表1)。Huang等[20]以果蔬残余和赤子爱胜蚓进行堆肥,利用定量聚合酶反应-变性梯度凝胶电泳技术对蚓粪中的细菌群落进行检测,发现蚓粪中厚壁菌门丰度高于原始基质。另外,通过蚯蚓肠道的运转,可能会使肠道和蚓粪中革兰氏阴性菌和革兰氏阳性菌的比例发生改变。Villar等[21]将安德爱胜蚓和污泥进行堆肥,并利用磷脂脂肪酸(phospholipid fatty acid analysis, PLFAs)分析蚓粪细菌群落的组成,发现经过肠道后,革兰氏阳性菌的数量会减小,进而造成蚓粪中革兰氏阳性菌/革兰氏阴性菌的比例减小。蚓粪细菌群落的组成还受到基质种类的影响。Aira等[22]分别以马粪、猪粪和牛粪为基质,添加安德爱胜蚓进行堆肥,后期利用16S rRNA焦磷酸测序和宏基因组测序检测蚯蚓肠道菌群组成,结果显示,以马粪和牛粪为基质的蚓粪中变形菌门丰度最高,为总细菌丰度的82%和76%;以猪粪基质的蚓粪中厚壁菌门所占的比例最高,为57%。Wang等[11]利用高通量技术,对牛粪、赤子爱胜蚓以及牛粪和赤子爱胜蚓产出的蚓粪进行了细菌群落检测,分别在牛粪、蚯蚓肠道和蚓粪中检测到15、24和33个门,79、182和184个属。因此,蚓粪细菌群落组成与蚯蚓种类及蚓粪基质具有密不可分的联系,且通过蚯蚓肠道运转后,蚓粪中厌氧菌的数量会有所增加,同时蚓粪中细菌群落通常具有比蚯蚓肠道内容物和原始基质更高的物种多样性。
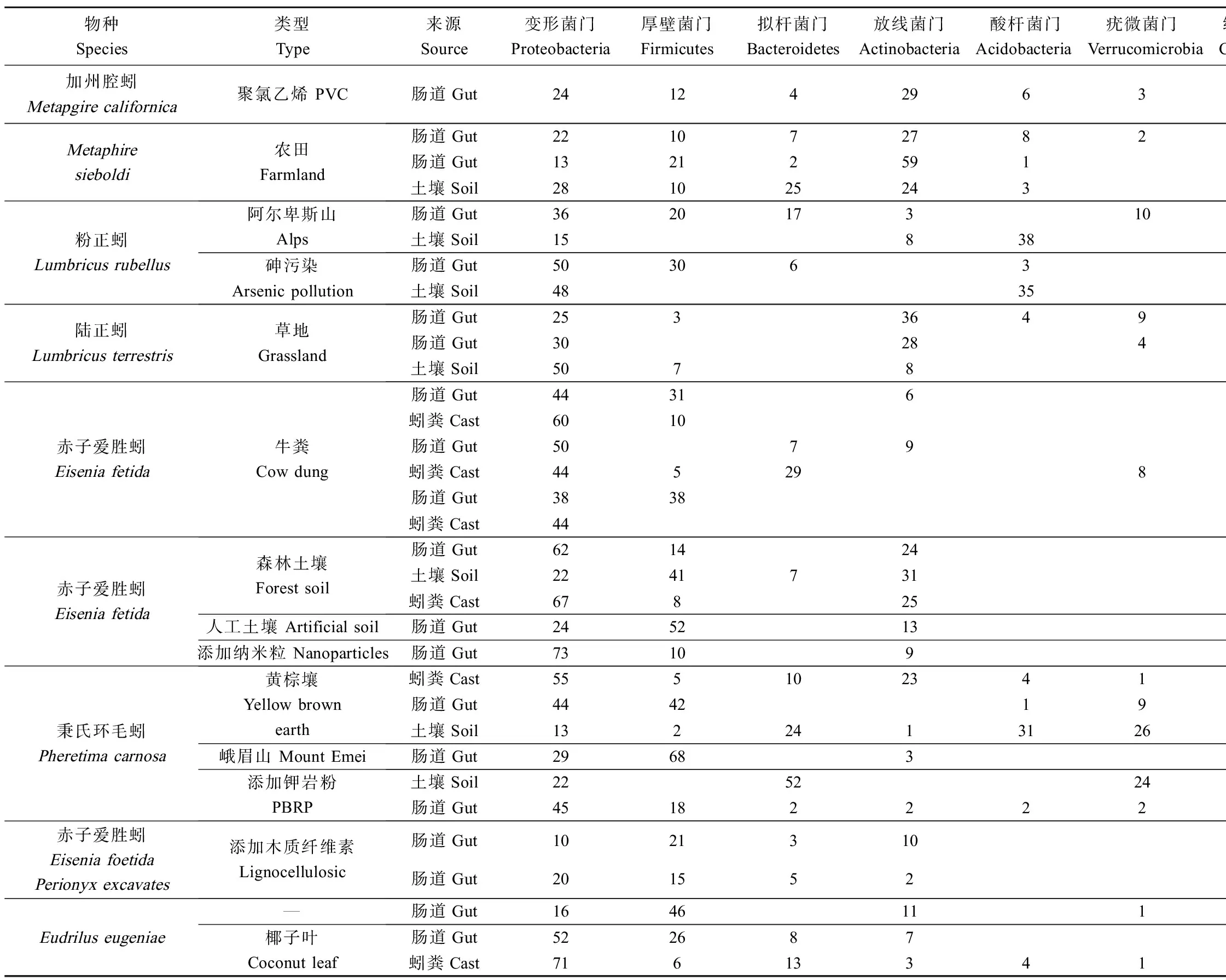
表1 蚯蚓肠道、土壤和蚓粪细菌群落组成(%)(门水平)Table 1 Bacteria community of phylum in earthworm gut, soil and cast (%)
2 蚯蚓肠道细菌对土壤中污染物的解毒作用(Detoxification of earthworm intestinal bacteria to soil pollutants)
近年来,随着我国工农业的迅猛发展,重金属、有机污染物、微塑料和抗生素等物质在土壤中的检出率不断增加,给场地土壤的污染治理、农业的安全生产及人体健康带来较为严重的威胁,因此,找到安全、经济和有效的治理方法尤为重要[23-25]。蚯蚓在土壤中广泛分布,其肠道菌群可以通过生物降解、吸附转化和生物积累等方式对环境中的污染物进行积累或降解,且不产生二次污染,有利于土壤生态系统的稳定及环境的可持续发展[26-29]。
2.1 蚯蚓肠道细菌对土壤中重金属的解毒作用
蚯蚓作为陆地生态系统生物量最大的无脊椎动物,已被广泛的应用于重金属污染土壤的毒理学研究。蚯蚓之所以能够在缓解重金属毒害的过程中发挥作用,主要是因为其自身强大的代谢系统以及肠道内生菌群的参与[6]。已经有许多研究表明,可以在蚯蚓肠道中分离出具有重金属抗性并能有效降低重金属毒害作用的内生细菌。Biswas等[26]在土后腔环蚓(Metaphireposthuma)肠道中分离一株对二价铜离子和二价锌离子具有显著抗性的菌株,通过16S rDNA序列系统发育分析方法确定为地衣芽孢杆菌(Bacilluslicheniformiastrain KX 657843);该菌株对二价铜离子和二价锌离子的最大耐受浓度分别为8 mmolL-1和6 mmolL-1,而且在重金属浓度为25 mg·L-1的LB培养基上培育72 h后,通过分泌胞外聚合物(extracellular polymeric substances, EPS)对金属离子的络合作用,使二价铜离子和二价锌离子的浓度分别降低35%和54%。后期Biswas等[30]在土后腔环蚓中又相继分离出3株具有抗二价铜离子和二价锌离子的磷酸盐增溶菌(Phosphate solubilizing bacteria, PSB),分别为巨大芽孢杆菌(Bacillusmegateriumstrain MF589715)、地衣芽孢杆菌(Bacilluslicheniformiastrain MF589720)和溶血葡萄球菌(Staphylococcushaemolyticusstrain MF589716),此类菌株可以增加磷酸盐的溶解,促使土壤中磷酸根和金属离子形成络合物,以减轻金属离子带来的危害,同时对二价铜离子和二价锌离子的最大耐受浓度范围为2~6 mmolL-1。此外,蚯蚓肠道中丰度较高的假单胞菌属(Pseudomonassp.)也具有固定金属离子的能力。如恶臭假单胞菌(Pseudomonasputida)通过增加磷酸盐的溶解使铅离子转化为铅羟基磷灰石和磷氯铅进而达到对铅的固定,减小铅离子带来的危害[31]。Goswami等[32]将赤子爱胜蚓和Lampitomauritii置于锌、砷和锰等重金属胁迫的环境中,为缓解重金属毒性,蚯蚓肠道细菌分泌大量的金属硫蛋白,以实现对重金属的吸附络合(图1)。代金君等[33]以重金属污染土壤为基质培养1周后,在赤子爱胜蚓肠道中发现了分泌金属β-内酰胺酶(β-lactamase)的细菌,如香味菌属(Myroidessp.)和不动杆菌属(Acinetobacter),该细菌可以分泌金属β-内酰胺酶对土壤中的锌离子吸附络合。因此,蚯蚓肠道细菌可以通过生物吸附、生物积累和生物转化等方式缓解或降低重金属对土壤生物的毒害作用[34-36]。
2.2 蚯蚓肠道细菌群落对土壤中有机污染物的降解作用
有机污染物是指以蛋白质、碳水化合物、脂肪和氨基酸等形式存在并对人类和环境造成危害的有机化学物质。其中,持久性有机污染物(persistent organic pollutants, POPs),如多环芳烃(polycyclic aromatic hydrocarbons, PAHs),因其具有难降解、高毒性和半挥发等特点,对生态环境的可持续发展产生了较大的负面影响。已有许多研究发现蚯蚓肠道细菌能够有效降解环境中的有机污染物[37]。Verma等[27]在土后腔环蚓肠道中分离出一株可以降解硫丹的菌株RhodococcusMTCC 6716,该菌株在硫丹存在的情况下通过酶促反应,将硫丹降解为硫丹二醇和硫丹硫酸酯2种无毒的代谢产物,且15 d内菌株对硫丹的降解率高达97%(图1)。Mudziwapasi等[38]通过16S rRNA技术在赤子爱胜蚓肠道中分离出具有降解4,4-滴滴涕(4,4-dichlorodiphenyltrichloroethane, 4,4-DDT)能力的红球菌(Rhodococcus)和芽孢杆菌,该类菌株通过分泌4,4-DDT还原性脱卤素酶将污染物降解为毒性更小的4,4-滴滴滴(4,4-1,1-dichloro-2,2-bis(4-chlorophenyl) ethylene, 4,4-DDD),并且降解率分别高达88%和85%;Singh等[12]利用宏基因组测序对赤子爱胜蚓和掘穴环爪蚓(Perionyxexcavatus)这2种蚯蚓的肠道微生物的功能和分类进行了研究,发现在赤子爱胜蚓肠道中有22%的细菌可以参与脱卤过程,有4%和2%的肠道细菌可以降解氯酚和萘;在掘穴环爪蚓肠道中同样发现了可以参与脱卤过程的细菌,丰度为总细菌群落的17%。蚯蚓肠道低氧化还原电位及丰富的葡萄糖为发酵提供了可能,肠道中产甲烷菌群可以通过发酵生成甲烷,甲烷可以为厌氧微生物如假黄色单胞菌属(Pseudoxanthomonas)提供电子供体,促进甲基橙(methyl orange, MO)等有机污染物的降解[39]。因此,蚯蚓肠道菌群对土壤中有机污染物的解毒及共代谢降解具有巨大的潜力。
2.3 蚯蚓肠道细菌群落对土壤中微塑料的分解作用
微塑料是粒径<5 mm的塑料固体颗粒,因其具有易吸附重金属和有机污染物且难降解等特点,给环境治理带来了较为严重的挑战[23,40-41]。目前,已有研究报道,蚯蚓肠道是富集微塑料的重要场所,肠道内生细菌具有分解微塑料的能力。Lwanga等[28]在陆正蚓肠道中分离出放线菌门和厚壁菌门,并将其培养在密度值为1%(w/w)的低密度聚乙烯(low density polyethylene, LDPE)的环境中,21 d后检测到细菌对低密度聚乙烯的降解率达到60%,粒径减小34%~56%,降解产物主要是正十八烷、二十烷、二十二烷和二十三烷等(图1)。短芽孢杆菌(Brevibacillusborstelensis)是蚯蚓肠道常见的细菌种类,在Hadad等[42]的研究中发现,短芽孢杆菌可降解低密度聚乙烯的CH2主链,并可将低密度聚乙烯作为碳源进行利用,30 d内使聚乙烯的分子量降低30%。芽孢杆菌因抗逆性较强可广泛存在于土壤、水以及肠道等环境中,已有研究表明,芽孢杆菌是蚯蚓肠道的优势菌[8,13]。Auta等[43-44]发现芽孢杆菌具有降解聚丙烯(polypropylene, PP)的能力,后期将其置于含有聚丙烯的培养基中,培养40 d后发现该菌株主要是通过分泌胞外酶破坏聚丙烯的表面,致使菌株进入空隙内部定殖生长,进而实现逐步分解聚丙烯的过程。然而,蚯蚓肠道菌群在降解微塑料的同时,微塑料也会对蚯蚓及其肠道菌群产生影响。Wang等[45]将加州腔蚓(Metaphirecalifornica)培养在聚氯乙烯(polyvinyl chloride, PVC)浓度为2 000 mg·kg-1的土壤中28 d,通过高通量技术发现聚氯乙烯的存在降低了肠道中绿弯菌门和酸杆菌门的相对丰度。Lwanga等[46]将陆正蚓置于不同含量的低密度聚乙烯(<150 μm)污染土壤中培养60 d,发现在清洁对照土壤中蚯蚓的生长率为10 mg·worm-1·d-1,而添加了浓度为60%的低密度聚乙烯的污染土壤中,蚯蚓的生长率受到显著抑制,生长率<0。Zhu等[47]将Enchytraeuscrypticus暴露在纳米聚苯乙烯(nano-polystyrene)含量为10%的土壤中,后期蚯蚓体重明显下降,而且肠道中根瘤菌科(Rhizobiaceae)和伊索菌科(Isosphaeraceae)的丰度分别下降6%和33%。因此,蚯蚓肠道细菌不但能减小微塑料的物理粒径,还能对环境中的微塑料化学结构进行降解。但是当微塑料含量过高时,会降低蚯蚓自身的机能以及改变蚯蚓肠道细菌群落组成。
2.4 蚯蚓肠道细菌群落对土壤中抗生素的消减作用
抗生素是由微生物或高等动物产生的具有抗病原体或其他活性的一类次级代谢产物,由于抗生素的不规范使用,已经在很多畜禽养殖厂、河海渔厂和垃圾填埋场等热点区域周边土壤中检测到多种抗生素的长期残留,对人体健康和生态环境安全造成了潜在威胁[48-49]。微生物菌群共代谢强化降解是土壤中残留抗生素去除的重要途径[50]。蚯蚓肠道作为土壤中移动的厌氧微域,通过增加土壤中厌氧菌的数量、改变土壤细菌群落组成来消减土壤中残留的抗生素。Cao等[29]将赤子爱胜蚓放置在土霉素(oxytetracycline, OTC)浓度为100 mg·kg-1的土壤中56 d,与未添加蚯蚓的土壤相比,蚯蚓的存在增加了土壤中黄杆菌科(Flavobacteriaceae)和假单胞菌属的丰度,进而促进土霉素的降解;同时在添加蚯蚓的土壤中检测到土霉素浓度下降至33 mg·kg-1,并伴有降解产物4-差向土霉素(4-epi-oxytetracycline, EOTC)和2-乙酰基-2-甲酰氨基土霉素(2-acetyl-2-decarboxamido-oxytetracycline, ADOTC)的生成(图1)。环境因子尤其是氧气含量是蚯蚓肠道内生细菌和土壤菌群产生差异的重要原因[51]。蚯蚓通过排泄的方式将肠道内的细菌带入土壤,造成周边环境细菌群落发生改变,促进细菌对抗生素的共代谢,以达到对环境中抗生素消减的目的。假单胞菌和葡萄球菌是蚯蚓肠道中常见的细菌种类,已有研究发现,在污泥和土壤中分离出来的假单胞菌和葡萄球菌可以通过分泌酶(如:氨基糖苷类乙酰转移酶(aminoglycoside phosphotransferase, APH)、氯霉素乙酰转移酶(chloramphenicol acetyltransferase, CAT))修饰钝化环境中的抗生素[52-55]。因此,蚯蚓肠道细菌具有较大的潜力降解或钝化土壤中残留的抗生素。此外,环境中过量的抗生素对蚯蚓本身及其肠道菌群也有一定的损伤。Ma等[56]用土霉素浓度为10 μg·g-1的菜地土壤将Enchytraeuscrypticus培养21 d,并利用高通量技术检测到土霉素的存在降低了肠道中变形菌门的丰度(由48%下降到24%)、增加了浮霉菌门的丰度(由28%上升到47%)。Wang等[57]将赤子爱胜蚓培养在环丙沙星(ciprofloxacin, CIP)浓度为0~51 mg·kg-1的土壤中,15 d后发现蚯蚓超氧化物歧化酶(superoxide dismutase, SOD)及抗坏血酸过氧化物酶(ascorbateperoxidase, APX)的含量均有提高,活性氧(reactive oxygen species, ROS)的过量产生导致羟基化蛋白质的氧化损伤。Li等[58]探究了不同浓度的环丙沙星对赤子爱胜蚓的影响,发现当环丙沙星的浓度为2 g·kg-1时,赤子爱胜蚓的繁殖能力下降到原先的1/6,躲避行为达到100%。因此,土壤中过量的抗生素对蚯蚓的生长繁殖及氧化防御系统具有较大的负面影响。目前已有较多的研究发现抗生素对蚯蚓具有毒害作用,但是关于肠道菌群对抗生素的降解机制仍有待进一步探究。

图1 蚯蚓肠道细菌对土壤中污染物的解毒作用Fig. 1 Detoxification of earthworm intestinal bacteria to soil pollutants
3 蚯蚓肠道细菌对土壤物质循环的影响(The effect of earthworm intestinal bacteria on soil substance circulation)
土壤中物质循环是组成生物体的化学元素在土壤无机环境和生物群落之间的迁移、转化及物质交换的过程,有利于物质的更新和生态系统的稳定。蚯蚓肠道独特的原位条件为厌氧微生物提供了适宜的生存空间,肠道中的厌氧微生物对促进土壤碳、氮和磷等元素的循环具有重要的影响[59-60]。
氮循环是自然界中各种形态的氮相互转化的过程,其中,固氮作用、硝化作用、反硝化作用和氨化作用是细菌促进氮循环的重要过程。有研究表明,蚯蚓肠道中富含大量与固氮、硝化、反硝化和氨化作用密切相关的细菌群落[51]。Hussain等[59]在赤子爱胜蚓肠道中发现2种固氮菌,经鉴定后为沙雷氏菌属(Serratia)和芽孢杆菌属,并且首次分离出具有固氮功能的抗坏血酸克吕沃尔氏菌(Kluyveraascorbata)。Wüst等[61-62]发现陆正蚓后肠排放氧化亚氮的能力高于前肠和中肠,亚硝酸盐的含量则呈现相反的趋势,随后对蚯蚓肠道不同位置的内生细菌进行了分析,发现后肠中反硝化细菌(denitrifying bacteria, DNB)群落物种多样性显著高于前肠和中肠反硝化细菌的群落,同时证实不同种类的蚯蚓(粉正蚓、Aporrectodearosea、Octolasioncyaneum和Octochaetusmultiporus)均能排放氧化亚氮(图2)。Depkat-Jakob等[63]通过对编码硝酸还原酶的基因(narG)、编码亚硝酸还原酶的基因(nirK)和编码氧化亚氮还原酶的基因(nosZ)的序列进行焦磷酸测序,发现蚯蚓肠道中存在的反硝化菌主要来自于摄入的土壤菌群,其中占主导地位的为根瘤菌目(Rhizobiales),证明土壤中根瘤菌的存在是蚯蚓排放氧化亚氮的重要原因之一。氨氧化菌是硝化作用的主要参与者,可以将氨氧化为硝酸[64]。在Singh等[12]的研究中,分别在赤子爱胜蚓和掘穴环爪蚓肠道中检测出24%和14%的氨氧化菌,同时,还在2种蚯蚓肠道中检测到固氮菌(7%和2%)、亚硝酸盐还原菌(15%和9%)的存在。因此,蚯蚓肠道内生菌群是土壤氮循环的重要驱动因素。
细菌通过碳固定和甲烷代谢等过程参与土壤中的碳循环,对全球气候变化和陆地生态系统的稳定有着重要的作用。蚯蚓肠道是富含糖类的厌氧环境,给肠道细菌进行产甲烷反应创造了便利的条件,对土壤碳循环有一定的促进作用[65]。Depkat-Jakob等[65]通过对甲基-CoM还原酶相关的基因(mcrA)转录后进行系统发育分析,发现Eudriluseugeniae具有排放甲烷的能力是因为肠道中含有球菌科(Methanosarcinaceae)、甲烷菌科(Methanobacteriaceae)和甲烷微菌科(Methanomicrobiaceae)等细菌;这些细菌可以参与肠道中的葡萄糖发酵,生成甲烷并伴有二氧化碳的产生,进而促进碳的循环[60](图2)。此外,蚯蚓还可通过加快有机质的分解实现对碳的转化。姜炳棋等[66]利用14C示踪技术,探究了威廉腔环蚓(Metaphireguillelmi)对14C-土壤有机质转化的研究,结果表明,蚯蚓肠道对有机质的转化有着显著影响,并发现蚯蚓肠道内生细菌对于原始有机质的矿化具有促进作用,同时对矿化后的有机质残留物有稳定化作用。蚯蚓肠道细菌不但可以矿化有机质,还通过肠道糖发酵产生二氧化碳和甲烷实现对碳的转化,对土壤的碳循环具有积极的影响。
土壤中95%~99%的磷是难溶性的,只有通过无机磷酸盐的溶解和有机磷酸盐的矿化之后才能转化为可利用的形态[67]。有研究表明,蚯蚓肠道细菌具有溶解无机磷酸盐、增加有效态磷的能力[30,59]。Biswas等[30]在土后腔环蚓肠道中分离出3株具有溶解磷酸盐的细菌,经鉴定后分别为Bacillusmegateriumstrain MF 589715、Staphylococcushaemolyticusstrain MF 589716和Bacilluslicheniformisstrain MF 589720;将这3种菌置于营养琼脂培养基上培养96 h后,分别产生214、194和222 mg·L-1的可溶性磷酸盐,被视为可溶性磷酸盐的潜在供体,具有非常高的利用价值(图2)。另外,Hussain等[59]发现赤子爱胜蚓肠道中有溶磷菌的存在,如沙雷氏菌属、芽孢杆菌属,能将堆肥中的可利用磷含量由初始的46 mg·kg-1上升到215 mg·kg-1(第60天)。Sahariah等[68]的研究表明,蚯蚓肠道细菌能溶解磷酸盐是因为部分细菌能分泌磷酸酶(phosphatase),将磷酸酯转化为无机磷。因此,利用蚯蚓肠道细菌溶解磷酸盐是增加磷可利用态的有效途径之一。
4 蚯蚓肠道细菌群落的功能基因多样性(Functional gene diversity of earthworm intestinal bacterial communities)
反硝化作用是土壤生态系统中氮元素循环转化的重要途径,在厌氧环境中可以利用硝酸盐还原酶(nar)、亚硝酸还原酶(nir)和一氧化亚氮还原酶(nos)等逐步还原硝酸盐和亚硝酸盐,最终生成含氮气体的过程,因此,nirS、nirK、narG和nosZ等基因丰度波动情况可以反映反硝化菌的活性和数量变化[69-70]。Kotzerke等[69]为探究磺胺嘧啶(sulfadiazine, SDZ)对赤子爱胜蚓肠道反硝化菌的影响,将蚯蚓喂养在被磺胺嘧啶污染的环境中,2周后检测到蚯蚓肠道中的nirK和nirS的丰度降低近一个数量级,进而得出磺胺嘧啶对肠道中的反硝化菌的活性存在抑制作用;Depkat-Jakob等[70]对粉正蚓和陆正蚓肠道内容物中narG和nosZ进行转录和系统发育分析,发现肠道和土壤上层的narG转录物与放线菌门有较高的同源性,同时蚯蚓肠道和土壤中nosZ的转录物与变形菌门具有较高的同源性。因此,得出肠道中反硝化菌源自土壤,并且绝大多数属于放线菌门和变形菌门。蚯蚓肠道中的厌氧发酵菌(anaerobic fermentation bacteria, AFB)在[NiFe]和[FeFe]2种氢化酶的作用下参与发酵并产生氢气。因此,对[NiFe]和[FeFe]2种氢化酶转录物进行多样性分析可以推测肠道中厌氧发酵菌群[71](图3)。Schmidt等[71]分别对陆正蚓肠道中2种氢化酶的转录物进行系统发育分析,发现178个[FeFe]转录物中有177个与梭菌目(Clostridiales)相关,而84个[NiFe]转录物中,79%与肠杆菌科(Enterobacteriaceae)有关。因此,得出梭菌目和肠杆菌科是肠道中活跃的发酵群。Wang等[72]对Metaphiresieboldi肠道中砷生物转化基因(arsenic biotransformation genes, ABGs)进行了定量,发现在16个砷生物转化基因中,绝大多数为砷外排基因和砷氧化还原基因,进而得出蚯蚓肠道砷生物转化细菌(arsenic biotransformation bacteria, ABB)主要通过砷外排和氧化还原来减轻砷的毒害(图3)。此外,当蚯蚓受到外来污染物侵染,并且细胞受到氧化伤害时,为了抵御这种氧化应激(oxidative stress, OS),蚯蚓会通过调控一些功能基因的表达来维持自身机能的稳定,例如,调控超氧化物歧化酶相关的基因(sod)和谷胱甘肽S-转移酶相关的基因(gst)[73]。Shi等[74]将赤子爱胜蚓培养在含400 mg·kg-1六溴环十二烷的土壤中,14 d后发现蚯蚓体内sod和gst表达量分别是对照组的2倍和4倍。另外,蚯蚓还可以通过解毒基因削弱污染物带来的负面效应,例如,编码细胞色素P450的基因(CYP450)。Li等[75]发现当恩诺沙星的浓度为1 mg·kg-1时,CYP450表达量是对照的2倍,蚯蚓的解毒能力得以提升;而当恩诺沙星的浓度为100 mg·kg-1时,基因表达仅为对照的一半,蚯蚓的解毒能力受到了抑制,因此,CYP450的表达状态可以作为蚯蚓解毒能力的指示参考。综上,蚯蚓肠道功能基因的丰度变化不但能用来指示肠道功能细菌结构、数量、功能及活性,而且还可以作为化学物质对蚯蚓毒理学作用的重要指标。

图2 蚯蚓肠道细菌对土壤物质循环的影响Fig. 2 The effect of earthworm intestinal bacteria on soil substance circulation
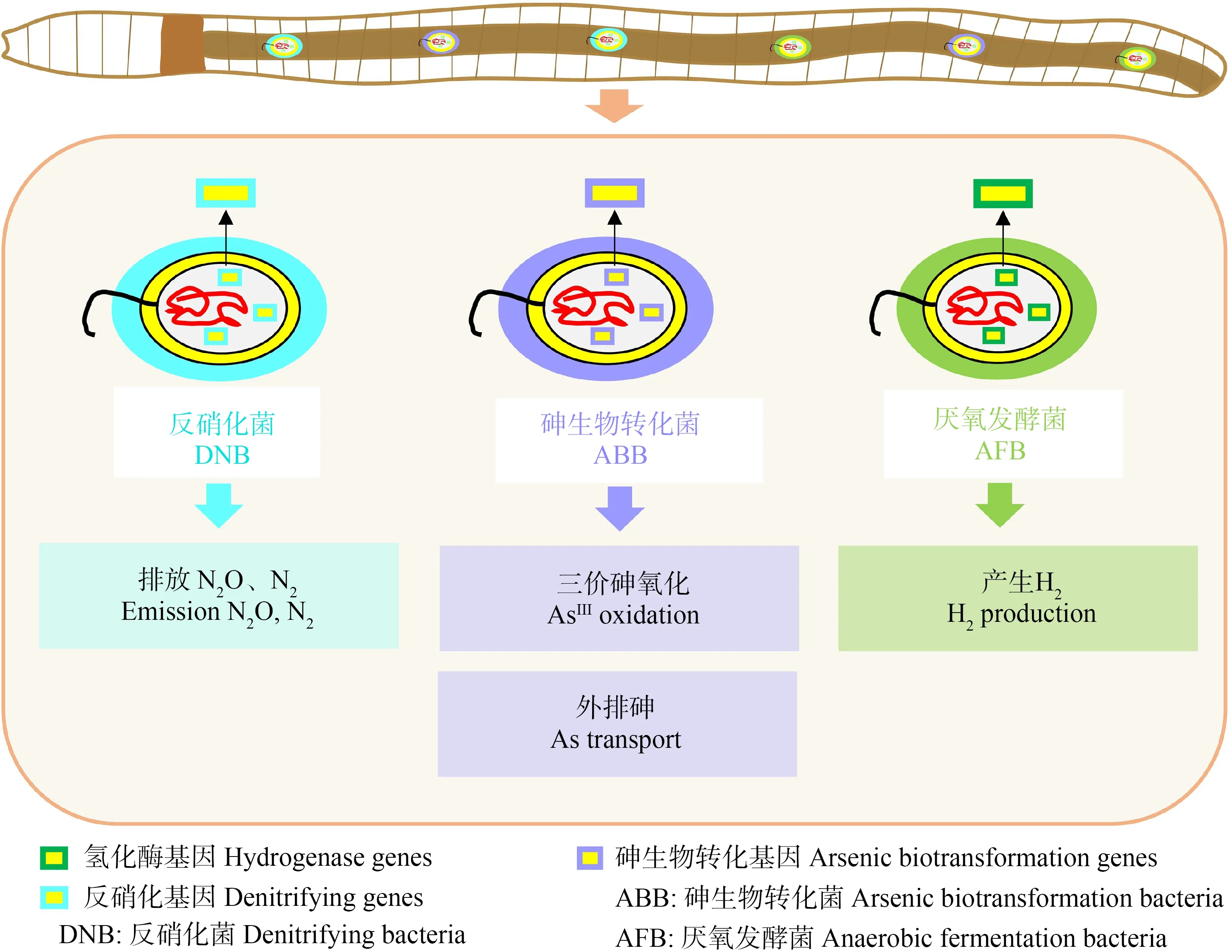
图3 蚯蚓肠道细菌群落的功能基因多样性Fig. 3 Functional gene diversity of earthworm intestinal bacterial communities
5 总结与展望(Conclusion and prospect)
近年来关于蚯蚓肠道微生物群落组成的研究受到了越来越多的关注,然而针对蚯蚓肠道功能细菌及功能基因的研究还相对较少,仍有一些关键科学问题需要阐明。(1)蚯蚓肠道菌群对土壤中污染物的降解与解毒机制。目前,已有较多研究表明,蚯蚓在促进污染土壤的生态修复过程中扮演了重要的作用,但是关于蚯蚓肠道内生细菌对有机污染物的降解及重金属毒害的解毒机制仍有待进一步探明。(2)蚯蚓肠道细菌功能基因的耦合作用机制。蚯蚓肠道细菌的生态功能与其功能基因的表达密不可分,目前,已有研究对蚯蚓肠道内的硝化基因、反硝化基因和产甲烷基因赋存规律及表达特点进行研究,然而针对肠道中有机污染物降解基因、抗生素抗性基因和重金属解毒基因的报道却相对较少,特别是针对不同功能基因之间的耦合作用机制,都是值得深入探究的科学问题。(3)蚯蚓肠道微生物组在土壤物质循环的作用机制。蚯蚓肠道微生物组囊括了内生细菌群落结构、组成与功能多样性和稳定性的综合特征,同时也包括肠道微生物群落中关于养分元素吸收、转运、同化和异化作用等系列功能基因的表达,这些都会直接影响蚯蚓对不同类型碳、氮、磷和硫等元素的转化过程,进而间接影响土壤物质元素循环的周转速率、迁移途径与赋存形态,因此,蚯蚓肠道微生物组在土壤物质循环的作用机制仍是今后关注的研究热点。

