新型全氟和多氟烷醚类化合物的环境分布与毒性研究进展
陈家苗,王建设
1. 河北大学生命科学学院,保定 071000 2. 中国科学院动物研究所,北京 100101
全氟和多氟烷基化合物(per- and polyfluoroalkyl substances, PFASs)是分子中全部或部分C—H被C—F取代的一类人工合成有机物。因C—F键赋予其疏水、疏油等独特的物理化学性质,PFASs被用于各种工业生产中,例如消防泡沫以及商品中的表面活性剂和表面保护剂等[1]。在众多PFASs中,全氟辛烷磺酸(PFOS)和全氟辛酸(PFOA)是最常见的2种类型。PFASs在生产和使用过程中释放进入环境后,高能量的C—F键导致它很难经水解、光解和微生物降解去除,因此具有环境持久性[2]。研究表明,长链PFASs还具有生物蓄积性和多种潜在毒性,当前PFOS和PFOA已经被《斯德哥尔摩国际公约》列为持久性有机污染物(POPs),其使用被禁止或受到严格限制。PFOS和PFOA这2种化合物的禁用,促进了一系列替代物的研发和生产。对于众多PFASs新型替代品,已有研究者对其分类方式和类型作过详细综述[3-4]。替代品研发的一种思路是在分子骨架中插入其他元素或功能基团,从而缩短全氟碳链长度,期望在保留其优良理化特性的同时,降低其生物蓄积性[5-6]。在众多的长链PFASs替代品类型中,在主链碳原子间插入“O”形成的全氟和多氟烷醚类化合物(per- and polyfluoroalkyl ether substances, PFPEs)为一类重要的替代品。如今,PFPEs正取代PFOA被用于四氟乙烯和含氟单体物质在水乳液中聚合成为含氟聚合物的加工助剂[4,7-8]。PFPEs种类繁多,根据疏水基团分类主要包括全氟和多氟烷醚磺酸和羧酸(PFESAs和PFECAs)等类型。当前环境中PFESAs的代表化合物为一种氯代多氟烷醚磺酸盐(chlorinated polyfluoroalkyl ether sulfonate, Cl-PFESA),其商品名为F-53B;最常见的PFECAs是4,8-二氧杂-3-氢-全氟壬酸(dodecafluoro-3H-4,8-dioxanonanoate, ADONA)和六氟环氧丙烷二聚体铵盐(Gen-X)(Gen-X为六氟环氧丙烷二聚体羧酸(hexafluoropropylene oxide dimer acid, HFPO-DA)的铵盐)。F-53B的主要成分为6:2 Cl-PFESA,另外含少量8:2 Cl-PFESA和10:2 Cl-PFESA,F-53B作为抑铬雾剂替代PFOS用于镀铬业中,是中国研发的产品且仅有中国生产,有关F-53B这一化合物的环境分布和毒性效应笔者曾专门作过介绍[9],不再作为本文的重点。ADONA是PFOA的替代品,主要用作制造氟聚合物的乳化剂[8]。HFPO-DA作为PFOA的替代物已在氟化工业中使用了一段时间,其同系物还有六氟环氧丙烷三聚体羧酸(hexafluoropropylene oxide trimer acid, HFPO-TA)和六氟环氧丙烷四聚体羧酸(hexafluoropropylene oxide tetramer acid, HFPO-TeA)等。这些PFPEs的分子式和名称等信息如表1所示。自从F-53B、Gen-X和ADONA等在多地水域中被频繁检出后,备受重视,这些PFPEs在地表水和饮用水中的分布已成为PFASs环境监测的重点[10-11]。由于插入“O”,PFECAs与全氟羧酸(PFCAs)相比亲水性增加,可能会降低其生物累积性,导致其更容易从生物系统中消除。但实际上化合物的生物蓄积性涉及蛋白和DNA等大分子结合、肾小球滤过和重吸收等众多复杂的生物因素,难于简单通过辛醇水分配系数(Kow)等理化参数来预测,PFPEs在生物体内的蓄积性、效应和潜在危害需要更多的现场实测和实验数据。
简言之,PFPEs作为传统PFASs替代品目前已广泛应用于工业生产中,但其生物蓄积性和对生态系统和人体健康潜在的影响等尚有待明确。本文将重点就PFPEs在环境介质和生物体内分布特征、蓄积能力及其毒性数据进行综述。
1 PFPEs的环境介质分布、生物体暴露水平和蓄积性(Environmental medium distribution, exposure levels and bioaccumulation of PFPEs)
环境介质中的PFPEs就其来源而言可分为直接和间接2种,直接来源是指在生产和使用过程中直接排入环境;间接来源主要是其前体物质的降解及远距离迁移,除大气沉降外,还包括水和空气中的PFPEs进入生物体和食物链,并随着生物的活动和迁徙导致的广泛传播[12]。近年来,PFPEs在世界多个地方的水体、沉积物和生物体中被检测到,在相关工厂附近检出的浓度较高。已有研究者对新型PFASs在水环境和生物样品中的分布做过详细综述[10-11]。
1.1 水体和沉积物中PFPEs的分布现状及去除技术
相关工厂排出的废水是地表水PFPEs污染的一个重要来源。GenX于2015年首次在美国开普菲尔河水中测出[13]。在Heydebreck等[14]的研究中,中国小清河流域HFPO-DA的最高浓度为3 825 ng·L-1(检出率76%),欧洲莱茵河下游流域其最高浓度达107.6 ng·L-1(检出率为17%)。Pan等[15]对采集于中国、美国、英国、德国、韩国和瑞典等多个国家河流和湖泊水体中的样品进行了GenX及其同系物的检测,GenX和HFPO-TA在上述水体中均有检出,浓度为0.25~68 500 ng·L-1,表明此类化合物已成为全球广泛分布的PFASs。迄今为止,自然水体中测得的GenX和HFPO-TA的最高浓度均来自中国一家含氟聚合物生产厂的下游水域,GenX和HFPO-TA的最高浓度分别为3 825 ng·L-1[14]和68 500 ng·L-1[16]。尽管更长链的HFPO-TeA尚未在地表水中检出,但其在沉积物中的浓度呈现上升趋势[17]。在使用F-53B约40多年后,Wang等[18]于2013年首次在接收电镀厂废水的污水处理厂进水(43~78 mg·L-1)和出水(65~112 mg·L-1)中检测到这类污染物。随之,6:2 Cl-PFESA在地表水、污水和沉积物中均被检出[9]。例如,Wang等[19]在中国的某些河流中检测出6:2 Cl-PFESA的浓度为<0.56~78.5 ng·L-1,检出率为51%;Ruan等[20]在中国20个省市的城市污水处理厂的污泥样品中都检测到6:2 Cl-PFESA,最高浓度为209 ng·g-1(以干重计)。除了6:2 Cl-PFESA这一主要化合物外,作为其杂质的长链同系物8:2 Cl-PFESA和10:2 Cl-PFESA等成分也经常被检测到,只是浓度较6:2 Cl-PFESA低得多;其中,由于当前还没有10:2 Cl-PFESA的商业化标准品,该化合物浓度为相对定量的数据。
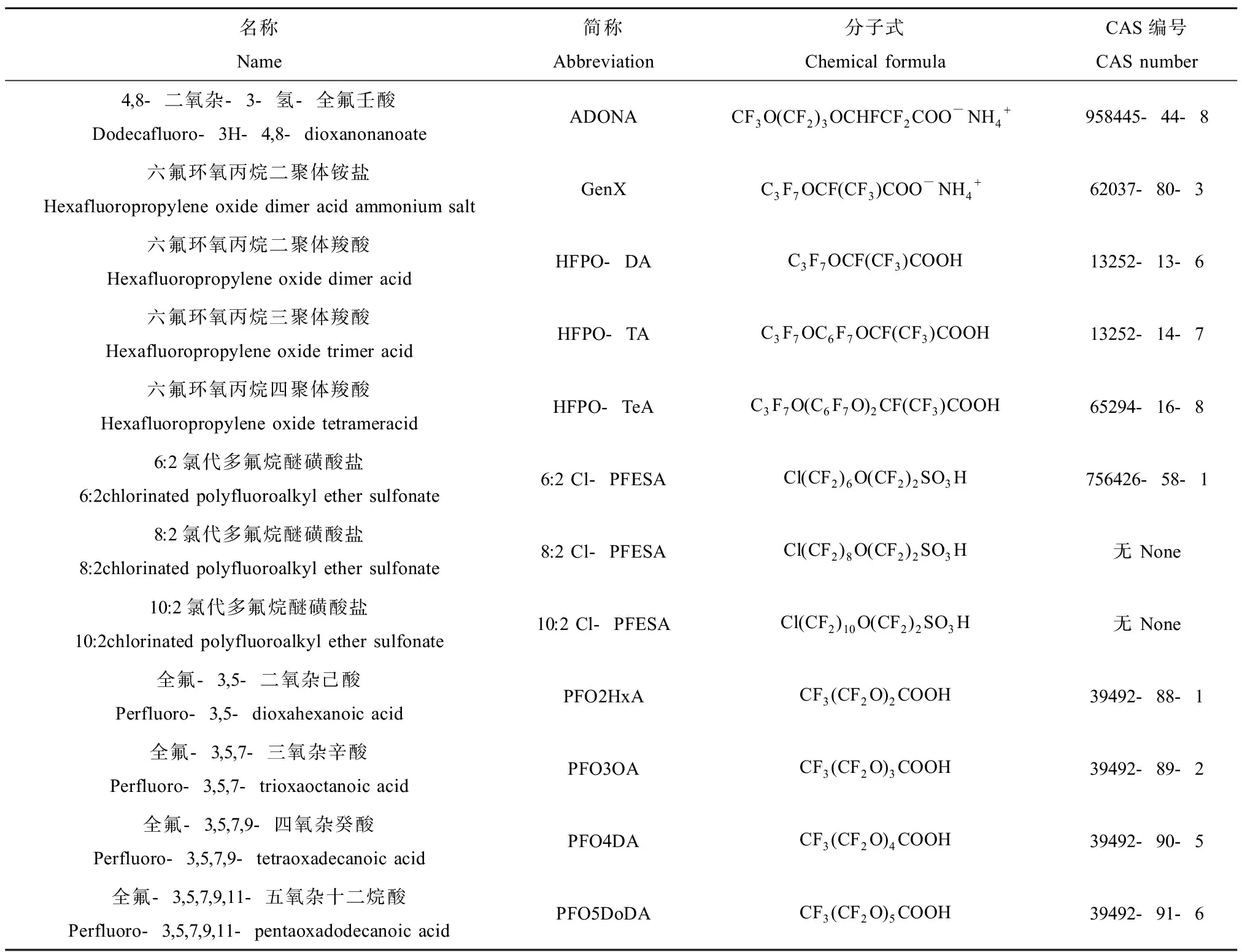
表1 全氟和多氟烷醚类化合物(PFPEs)名称与分子式Table 1 Name and molecular formula of per- and polyfluoroalkyl ether substances (PFPEs)
常规水处理工艺主要包括混凝—沉淀—过滤—消毒等流程,很难将水中PFPEs去除,从而无法消除PFPEs对人体健康造成的潜在威胁。已有研究者比较了颗粒活性碳(GAC)、粉末活性碳(PAC)和阴离子交换树脂(IRA400和IRA67)对GenX的吸附性,发现IRA67对GenX的吸附容量最高。在较低pH下,PAC更适合于GenX的去除,而IRA400在较高pH下使用效果更好。分别用25 ℃乙醇和92 ℃ NaCl水溶液对吸附饱和的活性碳(AC)和树脂进行再生,再生率达95%以上[21]。Huang等[22]还开发了可重复使用的水凝胶吸附剂去除全氟聚醚类化合物。对PFECAs的吸附量低于相同链长的PFCAs(例如全氟-4-甲氧基丁酸(perfluoro-4-methoxybutanoic acid, PFMOBA)<全氟己酸(perfluorohexanoic acid, PFHxA)),表明用醚氧原子取代CF2基团降低了PFASs与PAC的亲和力。但多醚取代和单醚取代的化合物在吸附性上并没有规律性的差异[23]。
1.2 生物及人体中PFPEs污染现状及蓄积性研究
PFPEs经工业废水排放进入自然水体导致水生生物受到污染。在中国小清河流域一家含氟聚合物生产厂下游捕捞的野生鲤鱼血清中,HFPO-TA浓度中值达1 540 ng·L-1,血清中的生物放大因子(logBCF=2.18)显著高于PFOA(logBCF=1.93)[16],在工厂附近的青蛙体内也检测到HFPO-TA,生物累积系数(BAF)为0.76 L·kg-1,高于PFOA的(0.37 L·kg-1)[24]。中国为F-53B生产国,但在格陵兰岛的北极熊、海豹和虎鲸等哺乳动物中均有检出,浓度分别为0.27、0.045和0.023 ng·g-1,表明F-53B具有长距离迁移特性[25]。通过采集和检测自来水样品发现,美国北卡罗来纳州的新汉诺威县中,GenX污染已进入“大多数”居民的家中,检测到的浓度中值为50 ng·L-1;采集了包括氟化学工厂附近居住的志愿者的血液和尿液进行分析,却没有在任何受试者体内检出GenX。对于居民经自来水接触GenX却未在其血液和尿液样本中检测GenX的原因,研究者推测可能GenX在人体内的半衰期短,很快被排出了体外[26]。与GenX不同,很多其他类型的PFPEs在人体中被检出,于美国北卡罗来纳州居住在化工厂附近的志愿者血清中检测到了全氟-3,5,7,9-四氧杂癸酸(perfluoro-3,5,7,9-tetraoxadecanoic acid, PFO4DA)和全氟-3,5,7,9,11-五氧杂十二烷酸(perfluoro-3,5,7,9,11-pentaoxadodecanoic acid, PFO5DoDA),浓度中值分别为2 ng·mL-1和<0.5 ng·mL-1,且2种化合物检出率均达98%[27]。在中国东部发达地区,人体内6:2 Cl-PFESA浓度仅次于或与PFOS和PFOA等相当,成为最主要的PFASs类型。例如,6:2 Cl-PFESA在配对的孕妇血清样本和脐带血中检出浓度的平均值分别为0.8~2.3 ng·mL-1,仅次于PFOA和PFOS[28]。
虽然环境负荷和饮食习惯等因素决定了个体的PFPEs外暴露量,PFPEs在人体中蓄积和清除能力是影响其体内暴露量的重要因素,也是其潜在的健康危害的重要参数。一项研究分析了嗜鱼者、镀铬工人及普通人的血清和尿液中F-53B和PFOS的浓度,发现与普通人相比,嗜鱼者血清中F-53B的浓度中值增加了20倍,这表明鱼类可能是人类摄入F-53B的重要来源,而镀铬工人血清中F-53B的浓度中值是普通工人的10倍,这表明经呼吸道暴露可能是镀铬工人F-53B暴露的重要途径。人体对血液中的F-53B清除较慢,F-53B的半衰期(15.3 a)显著长于PFOS(6.7 a)[29]。PFASs与脂肪酸的结构相似,在体内可能会与脂肪酸结合或与运输蛋白发生相互作用。研究发现,与PFOA相比,HFPO-TA与人类肝脂肪酸结合蛋白(hl-FABP)及血清白蛋白(ALB)的结合能力更强,这可能是HFPO-TA在血清和肝脏中积累的重要原因[30]。Gannon等[31]比较了大鼠、小鼠和猴子等雌雄个体对GenX的清除率,发现雌性大鼠对GenX的清除率比雄性约高10倍,这可能是雄性大鼠对GenX敏感性高于雌性大鼠的原因;GenX在猴子体内的药代动力学与大鼠类似,呈现明显的性别差异,且雌性清除率高于雄性;与此不同,小鼠在GenX清除方面没有明显性别差异。Rushing等[32]将雄性和雌性小鼠暴露于GenX中1、2、3、5、10和14 d后,检测血清中GenX浓度,GenX浓度在不同时间、不同性别之间没有统计学差异,表明GenX在小鼠中不存在生物累积。
2 PFPEs的生物毒性及健康风险(Toxicity and health risk of PFPEs)
PFPEs可通过饮食、呼吸和皮肤接触等多种途径进入生物体内。体内PFPEs主要分布在血液和肝脏等中,具有多种潜在的毒性效应。根据已有研究结果,将其毒性归纳为以下几点。
2.1 器官毒性
ADONA在大鼠体内的毒性存在性别差异,对雄性以肝脏为主要靶器官,对雌性则以肾脏为主要靶器官[8]。用GenX对大鼠和小鼠进行连续灌胃28 d,雄性大鼠暴露于0.3、3和30 mg·kg-1浓度的GenX,雌性大鼠暴露于3、30和300 mg·kg-1浓度的GenX,小鼠两性均暴露于0.1、3和30 mg·kg-1浓度的GenX,除了雌性大鼠和小鼠的最低浓度组外,其他浓度组中动物的肝β氧化活性均增加,恢复28 d后,酶活性恢复到正常水平[33-34]。小鼠连续暴露于GenX中90 d后,随暴露剂量增高,其肝脏重量/体重比率和肝脏中酰基-CoA氧化酶活性显著升高,肝细胞增生明显[35]。大鼠暴露于GenX中90 d后,均出现肝细胞肿大、肝脏和肾脏重量/体重比率增加等症状,而引发上述症状的剂量,雌性(≥1 000 mg·kg-1)比雄性(≥10 mg·kg-1)更大[36]。上述研究说明,性别是影响大鼠体内PFPEs代谢和毒性的一项重要因素。小鼠暴露于全氟-3,5-二氧杂己酸(perfluoro-3,5-dioxahexanoic acid, PFO2HxA)和全氟-3,5,7-三氧杂辛酸(perfluoro-3,5,7-trioxaoctanoic acid, PFO3OA)28 d后,肝脏重量未发生明显改变,而相同剂量的PFO4DA则能显著增加肝脏重量/体重比率,升高血中丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)等肝损伤指示物的水平;此外,PFO2HxA和PFO3OA几乎不在体内积累,而PFO4DA则肝脏或血清中均有累积。PFO4DA暴露不但引起肝肿大和肝脏细胞核溶解等,还抑制尿素循环相关酶的活性,导致血氨等含氮化合物在体内积累[37]。与PFO4DA类似,随HFPO-TA暴露浓度升高,小鼠血清ALT增加,肝肿大,肝细胞出现核溶解、细胞质空泡化和局部性坏死等。HFPO-TA尤其容易在肝脏中累积,且表现出比PFOA更高的生物累积潜力[38]。
2.2 遗传毒性、发育毒性和潜在致癌性
对雌性小鼠从配对前14天开始进行GenX暴露,直到哺乳期第20天,结果表明,虽然最高剂量(5 mg·kg-1·d-1)组F0代雌鼠表现出体重和肝重量增加,肝细胞肥大和点坏死等,但没有发现小鼠的繁殖能力受到影响。但是由于哺乳期内F0雌鼠的食物消耗量显著下降,导致幼鼠的体重较低[39]。在GenX对雌性大鼠的暴露实验中,100 mg·kg-1和1 000 mg·kg-1组的母鼠表现为肝脏局部性坏死和肝脏重量增加,F1代大鼠体重降低,1 000 mg·kg-1组中母鼠摄食量显著降低[40]。这2项研究证明,GenX会对母体本身造成伤害,但GenX不太可能具有遗传毒性。大鼠的ADONA暴露实验研究结果也证明其不具有遗传毒性[8]。上述对啮齿动物的研究均表明GenX和ADONA等PFPEs可能不是致突变剂。但在一项小鼠的HFPO-TA暴露实验研究中,肝脏转录组分析结果表明,28 d的HFPO-TA暴露能显著改变“化学致癌途径”和/或“肿瘤发生”相关基因的表达,提示即使PFPEs类物质不具有致突变性,也可能通过活化细胞生长和增殖信号通路呈现致癌潜力[38]。F-53B暴露会导致斑马鱼胚胎的发育毒性,导致孵化延迟,畸形率增加,存活率降低等。畸形呈现心包和卵黄囊水肿,脊椎异常,尾巴弯曲和鱼鳔未充气等多种类型,并且畸形的发生率随着暴露时间和剂量增加呈现明显的时间-效应和剂量-效应关系[41]。在PFO3OA、PFO4DA和PFO5DoDA致斑马鱼胚胎鱼鳔充气不足的研究中,发现外援添加甲状腺激素能改善鱼鳔充气状态,表明这类斑马鱼胚胎发育毒性可能与甲状腺激素不足等有关,不属于遗传毒性[42]。
2.3 其他毒性
有学者对ADONA的眼和皮肤刺激性和皮肤致敏性做了评估,结果表明,ADONA对家兔皮肤有轻度刺激性,对眼部有中度到重度刺激性,小鼠局部淋巴结检测实验证实,ADONA对小鼠皮肤有微弱的致敏效应[8]。经GenX暴露28 d,小鼠肝脏中酰基-CoA氧化酶活性显著增加,但T细胞依赖的抗体反应(TDAR)试验并未发现GenX具有免疫毒性[32]。GenX的90 d暴露还会造成大鼠血清碱性磷酸酶升高,红细胞数减少,血红蛋白和红细胞压积降低,然而这些影响经28 d恢复后均能得到缓解[36]。
3 总结与展望(Summary and prospect)
PFASs因优良的理化特性,当前在工业生产领域具有无可替代的地位。但是,一旦释放到自然环境中,PFASs不容易通过物理、化学或生物降解等方式消除。PFOS和PFOA等长链PFASs的环境持久性、生物累积性和潜在健康危害已经引起国际社会重视,并将PFOS和PFOA列入持久性有机物进行管控。然而管控又催生了包括PFPEs在内的大量新化合物的研发和使用,进而导致这类物质近些年在环境样品中频繁检出。究其来源,这些新物质或者直接作为替代品被合成,或者属于替代品合成或应用过程中产生的副产物。值得关注的是,PFPEs等物质较传统PFASs引入了更多的结构和修饰,导致替代品的种类更趋繁杂多样;同时,对于PFPEs等替代品的应用和排放带来的潜在生态和健康安全隐患,我们还没有明确的认识,甚至缺乏足够的重视。事实上,现有的部分毒理学数据已表明,包括6:2 Cl-PFESA、HFPO-TA和PFO4DA等在内的PFPEs的毒性较PFOA和PFOS并未有明显改观,甚或体内半衰期更长,毒性也更强。总之,PFPEs已成为环境健康领域需面对的新问题,当前需要借助更强有力的分析手段明确环境中PFPEs的类型和负荷;进一步强化PFPEs的生物体蓄积能力和环境健康危害的研究,尤其不能囿于传统PFASs毒性认知范围。通过完善PFPEs的环境行为和潜在健康风险信息,科学评估其管控举措,积极探讨环境友好型替代方式,才能从根本上改变类似对PFOS和PFOA等物质“事后管控”的被动局面。

