雌激素干扰物的联合毒性研究进展
杨蓉,马梅,王子健
1. 北京市南水北调水质监测中心,北京 100093 2. 中国科学院生态环境研究中心,中国科学院饮用水科学与技术重点实验室,北京 100085 3. 中国科学院大学资源与环境学院,北京 100190
最近数十年来,合成及天然化合物干扰生物体内分泌系统这一问题已经受到越来越多的关注,分析测试技术的发展和持续不断的污染物排放也造成了水体中环境内分泌干扰物(endocrine disrupting chemicals, EDCs)的检出率和检出浓度越来越高[1]。广泛的证据表明,EDCs会对野生生物乃至人类繁殖和发育产生不良效应,而生物体在环境浓度(ng·L-1)的EDCs下长期暴露所受到的影响备受关注[2-4]。
雌激素干扰物(estrogenic disruptors, EEs)是最先被研究的一类EDCs。由于生物体对内源雌激素高度敏感,雌激素在很低浓度下即可发挥作用,因此,环境中的EEs可以在低浓度下模拟或干扰雌激素的正常功能和生理过程,从而干扰免疫系统、神经系统和生殖系统等功能。EEs导致的人类生殖系统肿瘤、野生生物的双性化和雌性化、水生动物种群生存力和资源量下降很早就引起科学界和大众的关注。很多药品、农药、工业产品和副产品都被证明具有雌激素干扰效应,包括作为避孕药主要成分的乙炔基雌二醇、效应弱于天然激素但环境水平较高的双对氯苯基三氯乙烷(DDT)[5-6]、塑料中常含有的双酚A[7-8]、用作冷却剂和润滑剂的多氯联苯类化合物[9]等。随着在全世界的广泛使用,EEs汇入或残留在环境中,对生态系统和人类健康造成威胁[10]。
单一化合物由于其在环境中非常低的浓度和效应水平使得人们忽视其可能的环境和健康风险;然而,EEs通常不会在环境中单独存在,而是和不同来源多种物质共存,这就意味着可能对生物造成与单独作用完全不同的联合毒性,造成所谓的“something from nothing (无中生有)”和“a lot from a little (积少成多)”现象。因此,监测和评价环境中EEs的影响,仅通过测定一种或几种典型污染物的浓度远远不够。需要跳出传统的毒性研究和环境管理思路,从整体毒性和联合效应的角度看待复合污染问题。近年来,出于对EEs混合物的重视,科学界从数学和生理生化等角度开展了大量研究。笔者总结和评述了这一领域常用的模型方法,并展望了未来的发展方向。
1 EEs与加和模型(EEs and additional models)
对环境中的EEs进行监测和评估,化学分析和生物测试都是常用的方法。化学分析能对样品中目标化合物进行准确定量,离体生物测试一般是对样品进行快速初筛,确定其中是否含有效应贡献物,活体生物测试一般用于提供化合物与生物体更复杂详细的相互作用信息。因此,化学分析和生物测试、不同的生物测试方法之间需要相互结合和互为补充,而对联合效应的探讨在其中起到桥梁的作用。
1.1 常用的EEs联合效应研究方法及预测模型
目前,对于EEs的联合效应研究,离体(invitro)和活体(invivo)方法均有涉及(表1)。这些研究通过比较模型预测获得的和实验测定获得的混合物效应,评价预测模型的准确性,并考量所选模型的适用性[11-24]。
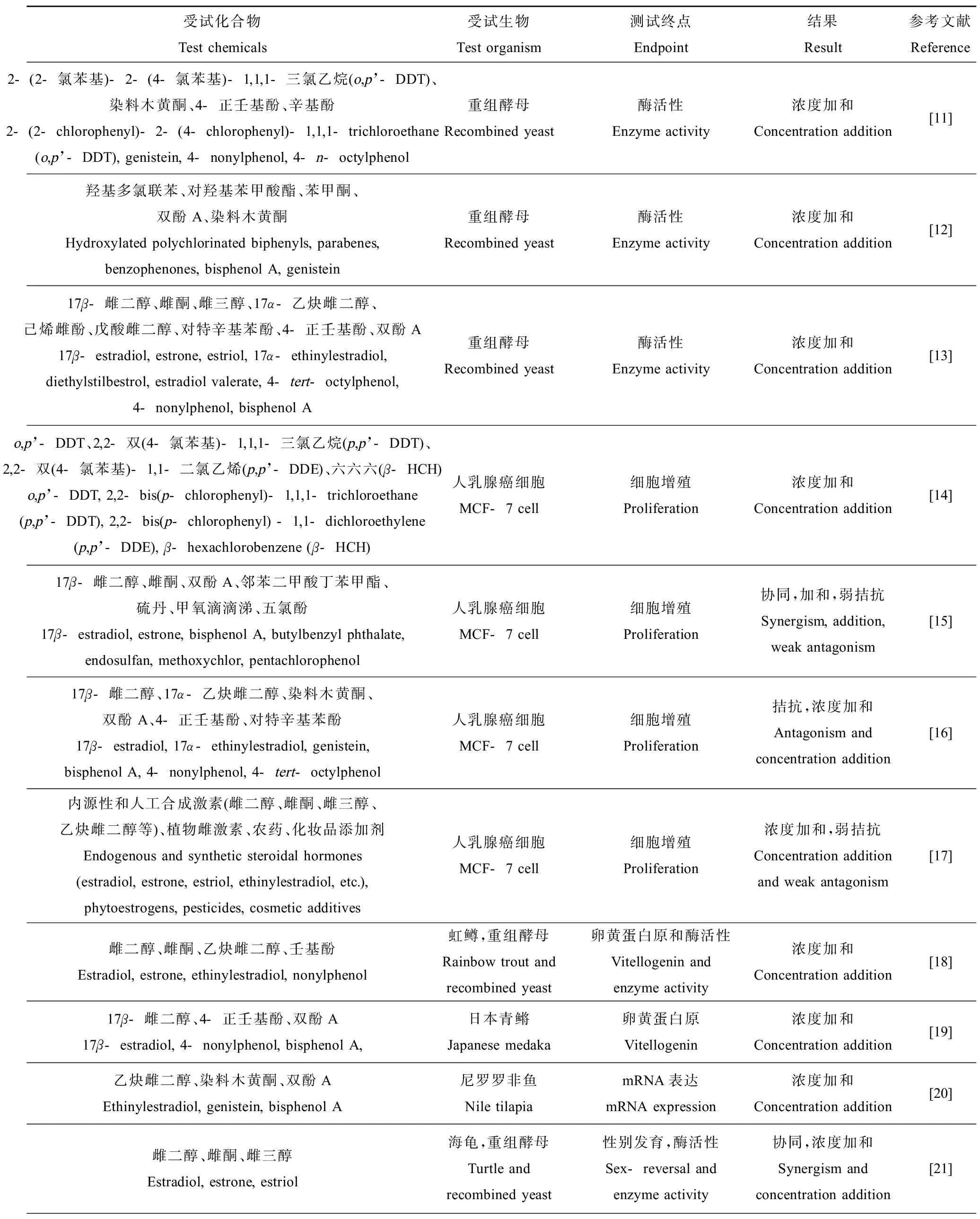
表1 雌激素与类雌激素联合效应的研究Table 1 Published researches on combined effects of estrogenic agonists
由表1可知,虽然目前已有许多研究相互作用的方法被开发和报道,但实际上在雌激素和类雌激素联合作用的研究中,基本还是用最经典的浓度加和(concentration addition, CA)模型进行混合物毒性描述。很多研究证明,EEs的联合效应符合CA模型,这一点在测试酶活性的重组酵母实验和检测卵黄蛋白原含量的鱼类暴露实验中更加常见。然而,尽管CA模型在混合物毒性研究中广泛应用,它并不适用于所有情况。当生物过程涉及到多种作用方式(mode of action, MoA)时,例如以细胞增殖、性别决定和子宫增重作为测试终点,混合物会表现出非加和现象(non-additivity)。此时用CA模型预测联合效应会产生结果偏差,且偏离方向(协同作用或拮抗作用)与受试混合物中的组分有关。
例如,研究者发现使用雌激素、酚类、邻苯二甲酸酯和有机氯农药组成的二元混合物联合染毒MCF-7细胞时,雌二醇和双酚A具有明显的协同作用,而其他8个混合物呈现出弱协同、加和和弱拮抗作用[15]。另一项针对天然雌激素、合成雌激素和酚类化合物的联合毒性研究表明,MCF-7细胞在包含雌二醇、乙炔雌二醇、染料木黄酮和双酚A的三元和四元混合物暴露下的增殖符合CA模型,但当添加了壬基酚和辛基酚时,观察到出现拮抗作用[16]。因此,选择哪个效应终点开展生物测试,在一定程度上决定了模型是否适用。在多重MoA的情况下,可采用CA模型作为基准判断相互作用方向,但当研究中涉及混合物效应预测,对CA的使用应当谨慎。
尽管如此,CA模型依然在环境管理中得到了最广泛的应用。它的数据处理方式相对简单,而且会在一定程度上高估联合作用,有利于潜在风险的识别和预防,这些都是推广过程中的天然优势[25]。与之相比,为深入阐释联合毒性开展的毒理学过程研究涉及过多的效应终点和MoA,形式复杂,目前基本限于实验室研究,距离解决实际问题还有很长的路要走。
1.2 CA模型的改进
在长久的实际应用中,研究人员也在根据实际需要对CA模型进行修正。传统的CA模型及其衍生出的雌二醇当量(estradiol equivalent, EEQ)法建立在一个前提下:混合物各组分仅与单一的作用位点(target of action, ToA)发生作用,所有物质的剂量-效应曲线具有相同的最大作用效力和斜率,沿x轴互相平行,仅在毒性强度上有所区别[26]。因此,仅需得到不同组分的半数效应浓度(half-effective concentration, EC50),即可通过下式计算雌激素效应[27]:
式中:ci表示第i个化合物在联合作用时的浓度,ECxE2和ECxi分别代表作为标准雌激素的17β-雌二醇(E2)和第i个组分在产生x%效应时的浓度,此处一般为EC50。
这一前提在完全诱导物(如类固醇激素)上是适用的。然而,还存在大量的部分诱导物(如酚类化合物),它们在任何浓度下都达不到完全诱导物的最大效应,这种最大作用效力上的差异完全不在CA模型的考量之内,导致预测结果不够全面。为解决这个问题,广义浓度加和模型(generalized concentration addition, GCA)将最大作用效力也纳入考量,便可更准确地预测含有部分诱导物的混合物或环境样品的整体效应[28]。其可表示为:
式中:Emix表示混合物的联合毒效应,ci、ai和EC50i分别表示组分i的暴露浓度、最大作用效力和EC50值[29]。
在此基础上更进一步的是完全Logistic模型(full logistic model, FLM),它将剂量-效应曲线几乎所有拟合参数(包括混合物组分的最大和最小作用效力、EC50、斜率)全部囊括其中。即使这些参数各不相同,FLM也能提供令人满意的预测结果[30]。其可表示为:
式中:Emix表示混合物的联合毒效应,Maxi、Mini、ci、EC50i和pi分别表示组分i的最大作用效力、最小作用效力、暴露浓度、EC50值和曲线斜率。FLM甚至可以将模拟天然激素作用的诱导物和拮抗这一作用的拮抗物纳入一个体系,认为拮抗物是部分诱导物的极端情况(最大作用效力为零),只能结合受体,但无法启动后续生物过程[31]。
Schlotz等[32]用受体结合试验、细胞增殖试验和计算机模拟比较了CA、GCA和FLM这3种方法的预测能力,结果表明,CA模型更适合预测毒性强度(EC50),GCA在预测最大作用效力上更有优势,而FLM在计算机模拟混合物毒性方面表现良好,且集合了CA和GCA的优点。我们经常探讨CA模型的适用性和适用范围,强调为特定情况选择合适的模型。但从另一个角度,不断发展和修正CA,让这个在接近100年前提出的模型适应更多的实际情况,不断焕发出新的活力,这也具有非常重要的意义。
2 EEs混合物暴露下的生物过程(Action mechanisms under exposure to EEs mixture)
经过数十年的应用,CA模型在环境管理的角度解决了混合物风险预测和评估的很多现实问题。然而,作为一个数学模型,CA模型几乎不对生物体的复杂性进行描述。生物在其框架下只是一个黑箱,CA模型负责在单一MoA的假设下给出计算结果。
当混合物毒性研究进一步发展,终归无法绕开对生物过程和信号通路的详细探索。研究者需要得知混合物中的每个组分在生物体内是如何影响通路和改变酶活性,进而改变生物大分子的浓度水平,最终影响测试终点的。
通常而言,EEs可以通过以下几种作用方式在生物体内发挥作用:
(1) 与雌激素受体(estrogen receptor, ER)直接结合:可以模拟天然激素与ER相互作用的受体诱导物,称为雌激素或类雌激素[33];
(2) 与天然激素竞争结合受体:同ER有亲和力、但结合受体后不进行后续生物过程、对基因转录没有明显影响的受体拮抗物,称为抗雌激素[34];
(3) 影响受体的数量:某些EEs(如酚类化合物)的存在会干扰ER的合成与分解代谢,从而导致受体体内水平的改变[35];
(4) 影响激素的合成-分布-代谢-排出(absorption-distribution-metabolism-excretion, ADME)过程:不与受体发生作用,而是通过干扰信号调节、干扰受体合成、刺激激素或受体表达等过程影响内分泌系统;
(5) 影响内分泌系统与其他系统的调控作用:使神经系统、免疫系统等受到伤害,干扰神经发育过程,引发免疫毒性和致癌性,对认知功能、情感反应和应激反应均有影响,甚至导致脑组织形态发生变化[36]。
经常有化合物同时具有几方面的作用机制,其本身就在体内多个靶位点上产生影响。这使混合物的作用更加复杂,若选择较为综合的效应终点,如致死率、孵化率等,会大大增加解释和预测结果的难度。
2.1 抗雌激素的联合作用
抗雌激素可以干扰或阻断天然激素在体内与生物大分子的作用过程,抑制雌激素效应。在经典的基因组通路中,抗雌激素和天然激素竞争结合受体,但不具有激素的生理效应,降低了内源激素的作用[34]。因此,雌激素和类雌激素在“具有相同的MoA和ToA”的分类框架下属于同一类物质,而抗雌激素属于另一类[37]。因此,绝大部分EEs联合作用研究的受试物都是雌激素和类雌激素。针对不同种类EEs(如雌激素和抗雌激素)所组成的混合物的研究较少。
部分涉及抗雌激素联合作用的研究常使用特定浓度的雌激素和抗雌激素分别和共同暴露。在一篇EEs混合物对斑马鱼胚胎联合毒性的报道中,研究者考察了固定浓度的类雌激素2-(2-氯苯基)-2-(4-氯苯基)-1,1,1-三氯乙烷(o,p’-DDT)和3个浓度梯度抗雌激素氟维斯群单独以及联合暴露时胚胎的孵化率、孵化时间、畸形率和相关基因转录水平的变化[38];另一项研究采用了相似的实验设计,受试物是固定浓度的雌二醇和3个浓度梯度的来曲唑或他莫昔芬混合物,效应终点包括日本青鳉的孵化率、孵化时间、性别比、血浆卵黄蛋白原(vitellogenin, VTG)浓度和vtg1基因表达量[39-40]。
这种雌激素浓度保持不变的实验设计更适用于研究和评估药效,描述抗雌激素药物如何降低生物体内特定雌激素水平。名为考察二者的联合效应,实际上重点考察了抗雌激素对雌激素效应的拮抗效果。实际环境中情况更加复杂,更常见的是随着样品浓缩和稀释,EEs混合物的各组份浓度同比例变化。在这种实验设计下,重组基因双杂交酵母测试结果证明,抗雌激素的存在会改变测试结果的剂量效应曲线,当其与雌激素达到某一比例时能完全掩蔽雌激素的作用[41]。因此,不仅是环境风险和人类健康,从环境监测和管理的角度看,对抗雌激素联合效应的评估也需要受到关注。
更进一步地,上文所述FLM方法从数学角度给出了更加普适的解决方案。雌激素和抗雌激素进入生物体内,第一步都是结合ER,导致受体构象发生改变。二者区别在于第二步,配体-受体复合物暴露的结合位点可募集不同的辅助调节因子,影响靶基因的转录和表达[42]:雌激素、ER和共激活因子的复合物可增强转录,抗雌激素、ER和共抑制因子的复合物则可抑制转录。若从“受体亲和性”和“作用效力”2个维度考察EEs,它们的关系如图1所示。抗雌激素被看作“作用效力为零”的雌激素,弱雌激素则可以在“作用效力和受体亲和性都比较低的雌激素”和“这2项均远低于雌二醇,因此在体内共存时表现出一定拮抗能力”的2个角色之间转换,全部通过FLM的体系进行预测和评价。
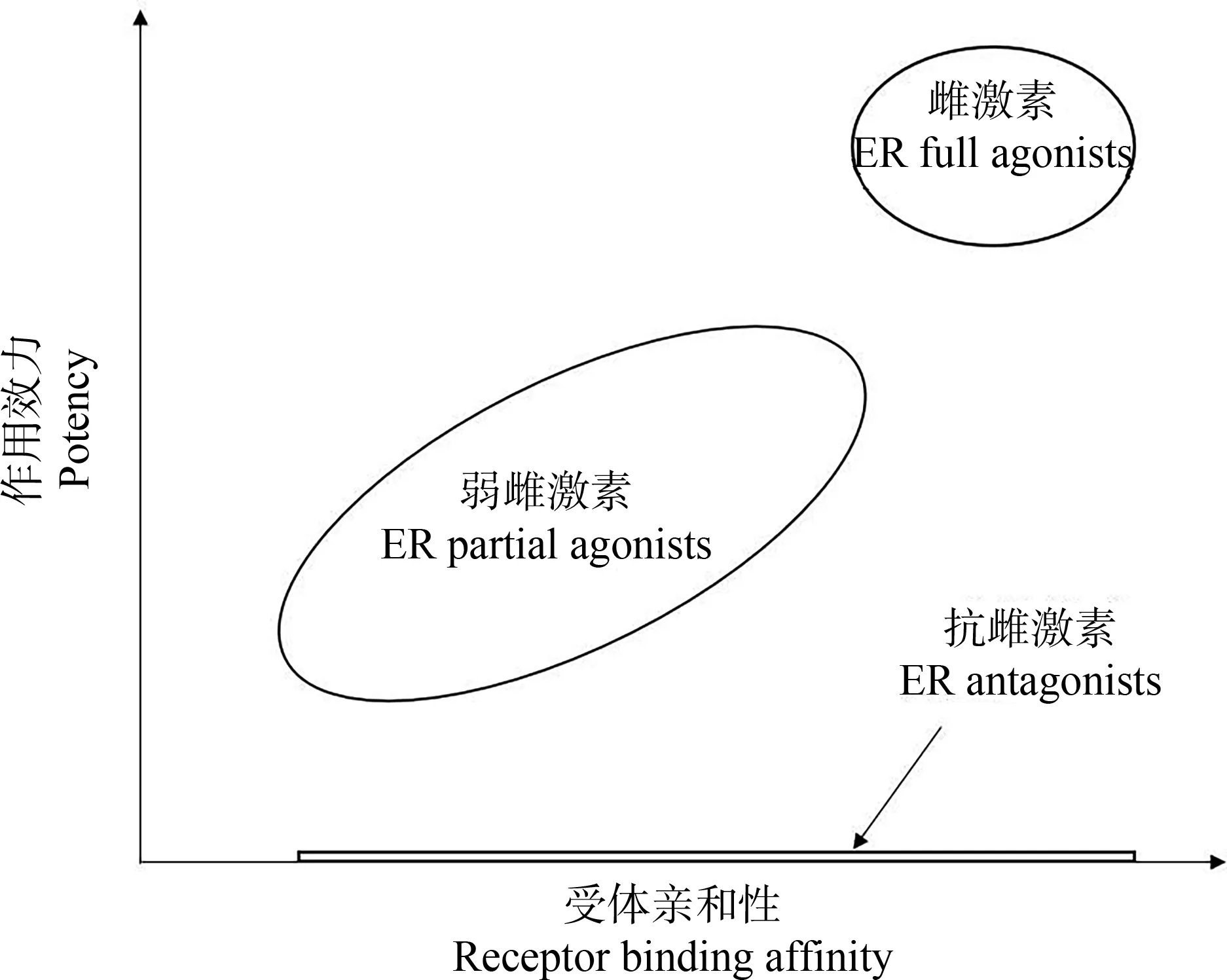
图1 雌激素、弱雌激素和抗雌激素的关系Fig. 1 Relationship between estrogen, weak estrogen and anti-estrogen
要注意的是,抗雌激素并不是全部通过基因组作用发挥拮抗效力。例如,与和雌二醇竞争受体的他莫昔芬不同,来曲唑可在体内抑制睾酮向雌二醇的转化,降低雌激素浓度水平,通过干扰激素的ADME过程引起雌激素调节紊乱[39]。这种类型的拮抗用FLM方法是无法处理的。
2.2 生物体的复杂通路:以MCF-7细胞为例
MCF-7细胞增殖试验是一种识别雌激素活性物质的简单有效的方法,被广泛用于各种化合物的雌激素效应评估[43-44]和环境样品的风险评价[45-46],可在细胞水平上反映EEs的作用。目前已有很多研究关注雌激素诱导MCF-7细胞增殖的机理,大多数研究者相信雌激素是通过结合细胞核中的ERα,通过雌激素反应元件(estrogen response element, ERE)与DNA结合,调节与细胞周期控制有关的关键基因,从而导致细胞增殖。但除此之外,也有报道指出人体内大约1/3能被ER调控的基因中并不含ERE片段,说明ER还可通过其他机理调节基因表达[47]。甚至有研究证明,雌激素可以不直接通过受体和DNA发挥作用,而是通过抑制一些调控细胞凋亡的蛋白活性(如MLK3和NFκB)导致癌细胞失控生长[48]。
增殖相关的主要MoA可分为以下3类:(1) ER通过ERE与DNA直接结合;(2) ER与DNA通过转录因子(transcription factor, TF)间接结合,可与前者合称为基因组作用;(3) 非基因组作用,雌激素配体受体复合物在细胞核外诱导一系列蛋白激酶的变化,导致细胞增殖[49]。后2个MoA扩充了传统上对ER的MoA的认知:与DNA间接结合的发现说明不含ERE的基因也可受到ER调节,使一大部分参与细胞增殖调节的基因进入我们的关注范围;而非基因组作用说明ER和配体的复合物甚至不需要进入细胞核与DNA作用,就可在细胞质里直接调控蛋白激酶的磷酸化和去磷酸化。因此,细胞增殖是数量繁多的受体、酶和基因在配体的存在下相互作用的综合结果,这加大了分析和预测EEs混合物诱导细胞增殖的联合作用的难度,也预示着活体生物联合毒性研究的难度。
有研究者考察了EEs暴露对核受体、非核受体及PI3K/AKT通路相关基因表达的影响。发现以17β-雌二醇为代表的雌激素主要通过调节核受体ER发挥作用,而以双酚A为代表的酚类化合物主要通过影响非基因组作用的G蛋白偶联受体30(G protein-coupled receptor 30, GPR30)产生效应。当二者联合暴露时,混合物对PI3K/AKT通路的数个基因显示出部分加和、部分等效、部分拮抗等复杂影响,导致细胞增殖的结果偏离了CA,而效应加和模型能更好地描述其结果[24]。但是就研究清楚17β-雌二醇和双酚A对MCF-7的增殖效应而言,仅PI3K/AKT通路的数据还不够,甚至转录组的数据都远远不够,因此尚有大片的空白需要填补。
2.3 新方法的探索
环境中的EEs数量众多,生物通过食物、饮水和呼吸等多种途径暴露其中。我们无法测试所有的污染物组合,现有的完全混合物的毒性数据局限在有限数目的混合物上,基于组分的评价方法也缺乏大量的毒性、剂量效应和MoA等基础资料。所以,我们需要能提供更多信息并综合处理这些信息的实验方法和计算工具。
在这些新方法中,毒代动力学、离体测试方法、组学(包括转录组、蛋白组和代谢组)和定量构效关系(quantitative structure-activity relationship, QSAR)等都可以补充缺乏的混合物暴露和毒性的数据资料。这些信息被综合到有害结局路径(adverse outcome pathway, AOP)的研究框架内,从每个混合物组分的分子起始事件(molecular initiating event, MIE)开始,通过一系列关键事件(key event, KE)导向有害结局(adverse outcome, AO)(图2)[50]。这种数据整合还可以逆向快速识别导致AO和联合效应的化合物组分,找到数据缺乏的位置,并计划之后的测试需求;也可用于基于MoA的化合物分组,这是混合物风险评价中的一个重点步骤。
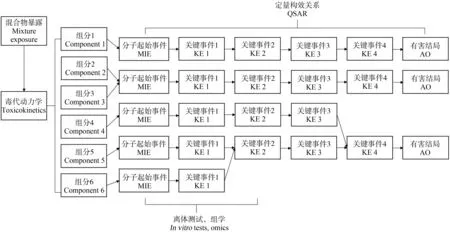
图2 有害结局路径(AOP)框架整合单一化合物的毒性信息Fig. 2 Toxicity information of mixture components under the adverse outcome pathway (AOP) frameworkNote: MIE stands for molecular initiating event; KE stands for key event; AO stands for adverse outcome; QSAR stands for quantitative structure-activity relationship.
目前,环境组学、AOP和QSAR等方法还未得到足够的验证和充分的发展,而且缺乏政策和立法的推动[51]。但即使如此,业界也普遍承认它们未来的价值。有研究者利用离体测试和毒代动力学数据推测双酚A、染料木黄酮和4-正壬基酚在活体测试中的雌激素效应,最后发现预测结果和实际结果有偏离。作者认为偏离的原因为研究中仅考虑了肝脏清除速率,对ADME这一复杂过程考虑得不够全面[52]。但这种尝试对推动EEs及EEs混合物风险评价是有益的,也符合综合组学、靶向测试技术和计算毒理学方法来取得突破性成果的研究方向。
3 展望(Perspective)
EEs的联合毒性研究是一个意义非凡而又极具挑战性的课题。一方面,对EEs混合物环境风险的研究早已广泛开展,无论是针对水体、土壤等环境样品的整体混合物方法还是以加和模型为代表的基于组分的方法均有大量的研究和应用;另一方面,通过生物测试和模拟计算对EEs生物行为的详细探讨也取得了诸多成果,有利于深入了解组分之间的相互作用,以降低联合效应预测结果的偏离。
然而,现实中这两者经常是割裂的。由于体内代谢、靶位点和MoA等数据和资料的缺乏,与生物过程相关的联合效应预测和评价方法很少得到实际应用,且它们复杂的公式和计算工具令人望而生畏。因此,我们需要系统地、有计划地开展代表性EEs的生理毒理信息获取及汇总;同时,对新方法的研发需要更多地考虑其应用,仔细评价它与旧模型预测效果的差异,寻找推广的关键优势。不可否认,CA模型拥有简单易用的公式和在一定范围内完全可接受的预测效果,这种便捷有效在很大程度上冲淡了它的模糊粗糙等缺点,就算新方法的预测精度极高,一旦使用不易,CA还是很难被其替代。
在我国,科学界对EEs的研究已有20多年,在此期间就其环境分布、迁移转化、生物效应和风险评价等方面获得了大量数据。但目前EEs还未受到监测部门的关注,我们面临的现状是,相关国家标准如《地表水环境质量标准》(GB3838—2002)、《生活饮用水卫生标准》(GB5749—2006)都是10多年前颁布的,不能反映近年来对新型污染物的重视。另外,我国的水质标准是建立在单一污染物的浓度限值之上,而环境中工业、农业和生活来源的多种物质都具有内分泌干扰效应,如何从复合污染的角度控制EEs排放,保护人体健康,也是管理部门需要思考的问题。对监测单位而言,对EEs的管理和监控还需转变一味关注目标化合物的思路,以效应为导向的方法结合主要贡献物识别和溯源可能是未来的发展方向。

