水旱轮作模式下马铃薯根际土壤细菌群落多样性分析
苏燕 李婕 曹雪颖 莫宛 郑虚 姚姿婷 邹承武


摘要:【目的】比較水旱轮作与旱地轮作两种种植模式下的马铃薯根际土壤及病株块茎的细菌群落多样性,为利用土壤细菌多样性优化马铃薯种植模式和防治马铃薯病害提供科学依据。【方法】分别采集前作为水稻的水旱轮作和前作为玉米的旱地轮作模式下马铃薯根际土壤样品(旱地轮作和水旱轮作健康马铃薯根际土壤样品分别记为HD.J和SH.J,旱地轮作和水旱轮作发病马铃薯根际土壤样品分别记为HD.B和SH.B)及马铃薯病株块茎样品(旱地轮作和水旱轮作发病马铃薯块茎样品分别记为P.HD.B和P.SH.B),基于高通量测序技术对样品中细菌16S rDNA的V3~V4区域进行测序,分析2种种植模式下的马铃薯根际土壤样品和病株块茎样品的细菌种类及丰度差异。【结果】 对马铃薯根际土壤样品及病株块茎样品的细菌多样性分析结果显示,HD.J、HD.B、SH.J和SH.B的细菌种类(OTU数目)、丰富度(Chao1指数)及多样性(Shannon指数)均高于P.SH.B和P.HD.B,且健株根际土壤细菌群落丰富度高于病株土壤。马铃薯种植模式是影响根际土壤细菌群落变化的最主要因素,贡献率为39.1%,而马铃薯植株健康状况是影响根际土壤细菌群落变化的第二大因素,贡献率为34.7%。病株根际土壤样品中,HD.B无丰度在1.00%以上的优势种,而SH.B特有的优势种中包含软腐病果胶杆菌(Pectobacterium carotovorum)、雷尔氏菌(Ralstonia solanacearum)和不动杆菌(Acinetobacter rudis),相对丰度分别为2.03%、1.46%和1.22%,其中软腐病果胶杆菌和雷尔氏菌是马铃薯的主要病原细菌,可分别导致马铃薯黑胫病和青枯病发生。病株块茎样品中,P.SH.B除了包含P.HD.B检测到的23个属,还有5个属是其所特有;P.SH.B特有的5个属中有3个优势属在SH.B中未检测到。HD.B特有的优势功能是产甲烷作用,相对丰度为1.18%;SH.B特有的优势功能包括硝酸盐呼吸作用、氮呼吸作用、亚硝酸盐呼吸作用、亚硝酸盐氨化作用和硝酸盐氨化作用,均属于氮利用及代谢功能,相对丰度为1.48%~1.95%。【结论】与旱地轮作模式相比,水旱轮作模式可提高马铃薯根际土壤的细菌群落多样性,但在该种植模式下要重点预防马铃薯发生细菌性病害。
关键词: 细菌群落多样性;马铃薯;水旱轮作;旱地轮作;根际土壤
中图分类号: S344.17;S532 文献标志码: A 文章编号:2095-1191(2020)10-2374-09
Diversity analysis of bacterial community in potato rhizosphere soil under the mode of paddy-upland rotation
SU Yan1, LI Jie1, CAO Xue-ying1, MO Wan1, ZHENG Xu2, YAO Zi-ting1*,
ZOU Cheng-wu1*
(1National Demonstration Center for Experimental Plant Science Education, College of Agriculture, Guangxi
University, Nanning 530004, China; 2Cash Crops Research Institute, Guangxi Academy of
Agricultural Sciences, Nanning 530007, China)
Abstract:【Objective】The microbial community diversity in rhizosphere soil and tuber between paddy-upland rotation and upland rotation in potato planting was compared in order to optimize potato planting modes and provide scientific basis to develop potato industry from the perspective of plant-microbiome ecology. 【Method】Soil samples of potato rhizosphere and tuber samples of potato diseased plants were collected from the rotation of rice paddy-upland rotation and maize upland rotation, respectively. The rhizosphere soil samples of healthy potato in upland rotation and paddy-upland rotation were marked with HD.J and SH.J, respectively. The rhizosphere soil samples of diseased potato in upland rotation and paddy upland rotation were marked with HD.B and SH.B, respectively. Tuber samples of diseased potato in upland rotation and paddy-upland rotation were marked with P.HD.B and P.SH.B, respectively. V3-V4 region of 16S rDNA amplicon of bacteria in the rhizosphere soil and tuber samples were sequenced using high throughput sequencing. Then the bacteria species and abundance differences of potato rhizosphere soil samples and diseased tuber samples in two cultivation modes were analyzed. 【Result】The results of bacterial diversity analysis of rhizosphere soil samples and tuber samples of diseased potato showed that the bacterial species, richness(Chao1 index) and diversity(Shannon index) of HD.J, HD.B, SH.J and SH.B were higher than those of P.SH.B and P.HD.B. The abundance of bacterial community in rhizosphere soil of healthy plants was higher than that of diseased plants. Potato planting pattern was the most important factor affecting the change of bacterial community in soil, with the contribution rate of 39.1%, while the health status of potato plant was the second most important factor with the contribution rate of 34.7%. There was no dominant species with abundance of more than 1.00% in HD.B, while the dominant species in SH.B included Pectinium carotovorum, Ralstonia solanacearum and Acinetobacter rubis with abundances of 2.03%, 1.46% and 1.22%, respectively. Among them, Pectinobacteria and Ralstonia were the main potato pathogens, which could cause potato black leg and potato bacterial wilt, respectively. In the tuber samples of diseased plants, P.SH.B contained not only twenty-three genera detected from P.HD.B, but also contained five genera which were endemic to P.SH.B. Among the five genera which endemic to P.SH.B, three dominant gene-ra were not detected in SH.B. The dominant function of HD.B was methanogenesis, with a relative abundance of 1.18%. In SH.B, the dominant function was nitrogen utilization and metabolism, containing nitrate respiration, nitrogen respiration, nitrite respiration, nitrite ammonification and nitrate ammonification, with the relative abundance of 1.48%-1.95%. 【Conclusion】Compared with the upland rotation mode, the paddy-upland rotation mode can improve the bacterial community diversity of potato rhizosphere soil, but the bacterial diseases of potato should be prevented under this planting mode.
Key words: bacterial community diversity; potato; paddy-upland rotation; upland rotation; rhizosphere soil
Foundation item: Guangxi Innovation Driven Development Project(Science and Technology Major Project)(Guike AA17204054); Guangxi Postdoctoral Science Foundation(BH2018065)
0 引言
【研究意义】根际土壤微生物是植物微生态系统的重要组成部分,其活性和群落结构多样性可影响土壤肥力的形成和植物对土壤有效养分的吸收及营养物质转化,与植物健康生长发育和生产力密切相关(Ling et al.,2014;李忠奎等,2019)。土壤微生物群落在维持土壤肥力方面发挥着重要作用,是评价土壤环境优劣状况的重要生态指标之一(Kumar et al.,2017)。种植方式不同会影响土壤微生物生长环境,使土壤微生物数量、组成及活性产生较大差异,并最终导致土壤微生物群落结构和功能发生改变。广西是典型的马铃薯冬作区,主要采用水旱轮作或旱地轮作种植马铃薯(韦本辉等,2005)。因此,研究水旱轮作和旱地轮作2种种植模式下马铃薯根际土壤微生物群落结构多样性,可为评估其对马铃薯健康生长的影响及选择合适的马铃薯种植模式提供科学依据。【前人研究进展】微生物扩增子高通量测序技术理论上可直接获得环境中所有微生物的基因信息,能快速而全面地诠释土壤中的微生物群落结构多样性,为根际土壤微生物研究提供新思路。姚华开等(2018)使用MiSeq高通量测序平台对混栽组合茄子根际土壤中细菌的16S rDNA基因V3~V4区片段进行测序,发现混栽组合茄子根际土壤的细菌多样性指数(H)、丰度(S)和均匀度指数(Eh)均显著高于对照,而且茄子混栽组合种植还能有效提高主栽作物茄子的根际土壤肥力;张笑宇等(2018)采用实验室微生物培养联合微生物高通量测序技术对玉米—烤烟轮作和烟叶连作2种种植模式下的烟株根际土壤微生物数量、群落结构及其多样性进行研究,发现轮作烟田根际土壤中的细菌和放线菌数量均高于连作烟田根际土壤;廖咏梅等(2019)基于Illumina MiSeq测序平台对真菌ITS1~ITS2区域和细菌16S rDNA扩增子V3~V4区域进行双末端测序,分析稻鸭共育模式与常规管理模式稻田土壤真菌和细菌的种类及丰度差异,发现与常规管理模式种植水稻比较,稻鸭共育模式的水稻根际土壤pH略低,有机质稍高,真菌的种群结构丰富,而细菌的优势门和优势属无明显差异;王悦等(2019)使用MiSeq高通量测序平台对连作、轮作和套作种植模式下丹参根际土壤细菌16S rDNA基因V3~V4区片段和真菌18S rDNA基因V4区片段进行测序,发现不同种植模式下微生物间的群落结构变化显著,相互作用关系也有明显差异;杨潇湘等(2019)基于扩增子高通量测序技术对豆—油轮作模式下的大豆与油菜根际土壤微生物群落结构多样性进行研究,发现与油菜根际土壤微生物相比,大豆根际土壤特异性富集具有固氮功能的根瘤菌属、慢生根瘤菌属和丛枝菌根真菌以及具有生防作用和促进植物生长的微生物。水旱轮作模式比常规连作模式的土壤微生物含量和多样性更高,有助于减少病害发生和提高农作物产量。苏婷等(2016)研究发现,水稻—玉米的水旱轮作模式不仅能调节土壤pH,还能显著增加土壤细菌、真菌和放线菌含量,促进土壤生态系统的平衡;谭雪莲等(2016)的研究表明水旱轮作可提高马铃薯产量,可能是因为水旱轮作提高了土壤微生物的数量和活性,从而促进了马铃薯根系生长及营养吸收。正是由于水旱轮作模式具有改善土壤理化性质、减少病害发生和提高作物产量的优点,同时还能充分利用冬闲田,目前已成为南方冬季种植马铃薯的主要模式。【本研究切入点】前人主要对马铃薯不同耕作模式的产量进行比较,并主要研究不同的连作/间作/轮作模式对土壤性质及微生物总体群落的影响,而针对马铃薯在不同耕作模式下的根际土壤及块茎的细菌群落多样性研究鲜见报道。【拟解决的关键问题】选取相同地点不同轮作模式的一组田块,通过16S rDNA高通量测序分析前作为玉米的旱地轮作和前作为水稻的水旱轮作模式下马铃薯根际土壤及块茎的细菌种类及丰度差异,明确水旱轮作种植模式对土壤细菌群落结构的潜在影响,为利用土壤细菌多样性优化马铃薯种植模式和防治马铃薯病害提供科学依据。
1 材料与方法
1. 1 样品采集
试验地点位于广西贺州市昭平县五将镇,试验设置2个田块,二者相邻,种植的马铃薯品种均为费乌瑞它,采用相同的常规田间管理措施。试验田块1的种植模式为玉米—马铃薯旱地轮作,于马铃薯收获期(2018年3月)采集样品,记为HD;试验田块2的种植模式为水稻—马铃薯水旱轮作,于马铃薯收获期(2018年3月)采集样品,记为SH。同一个采样地点,部分马铃薯发生细菌性软腐病。采用五点法采样,采样地中心定一个采样点,等距离等角度辐射4点。在每个采样点分别采集健康马铃薯和发病马铃薯的根际土壤样品及病株块茎样品,分别装入无菌密封塑料袋,保存于冰盒中,其中旱地轮作健康马铃薯和发病马铃薯根际土壤样品分别记为HD.J和HD.B,水旱轮作健康马铃薯和发病马铃薯根际土壤样品分别记为SH.J和SH.B,旱地轮作发病马铃薯和水旱轮作发病马铃薯块茎样品分别记为P.HD.B和P.SH.B。
1. 2 微生物基因组DNA提取及16S rDNA高通量测序
取样点的土壤样品置于研钵中磨碎,过80目筛后,5个取样点的样品各称取1.0 g混匀,随机取约0.5 g土壤用于提取微生物总DNA。马铃薯块茎样品洗净后切成小块置于研钵中研磨,5个取样点各称取1.0 g研磨后的样品混匀,随机取约0.5 g組织用于提取微生物总DNA。使用BioFast土壤基因组DNA提取试剂盒(杭州博日科技有限公司)提取土壤及马铃薯块茎的微生物基因组DNA,采用NanoDrop-2000(美国赛默飞世尔科技公司)测定DNA浓度,并通过1%琼脂糖凝胶电泳分析DNA完整度。对样品中的细菌16S rDNA基因V3~V4区域进行扩增并建库,继而使用Illumina HiSeq 2500平台进行高通量测序。
1. 3 生物信息学分析
测序原始数据去除低质量读段(Reads),然后根据双末端测序(Paired-End,PE)数据间的叠连(Overlap)关系将成对的读段拼接成1条序列,为得到高质量的读段,去除标签(Tags)两端的条形码(Barcode)序列及引物序列,再去除嵌合体及其短序列等得到干净序列标签(Clean tags)。拼接过滤后的干净序列标签在97%相似度下利用QIIME(v1.8.0)将其聚类为用于物种分类的操作分类单元(OTU),统计各样品每个OTU的丰度信息。获得的OTU与RDP数据库(Release 11.1,http:// rdpcme.msu.edu/)比对,通过核糖体数据库项目贝叶斯分类法(Ribosomal Database Project Bayesian,RDP Classifier)鉴定OTU代表性序列的微生物分类地位。应用R语言Vegan软件包进行基于Bray-Curtis距離的主坐标分析(PCoA)及非度量多维标定法(NMDS)分析。应用Mothur计算微生物Alpha(α)多样性指数。应用原核生物类群的功能注释方法(FAPROTAX)(Louca et al.,2016),将本研究的16S rDNA测序数据与FAPROTAX数据库对比,分析功能基因在生物代谢通路上的丰度。
2 结果与分析
2. 1 马铃薯根际土壤样品及病株块茎样品细菌多样性分析结果
6个马铃薯根际土壤样品和病株块茎样品测序共获得685267条原始序列标签(Raw tags),质控过滤后共产生650335条干净序列标签,每个样品至少产生103692条干净序列标签,平均产生108389条干净序列标签,最终得到的干净序列标签平均长度集中在406~415 bp。在97%的相似水平下对序列进行OTU聚类,共获得843个OTUs。
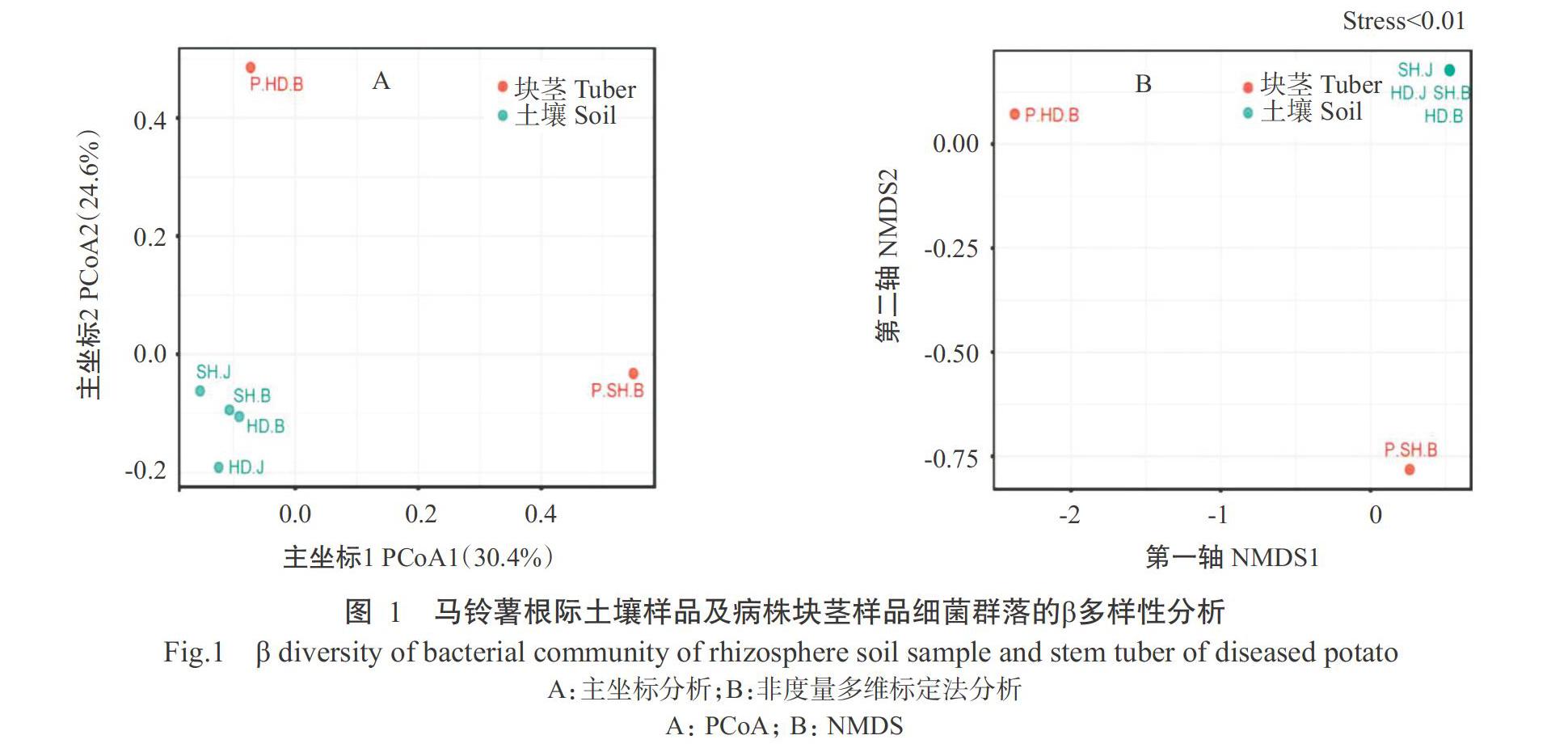
以OTU水平对6个样品进行PCoA分析,结果(图1-A)发现4个土壤样品聚在一起,说明土壤样品间的细菌群落结构更接近;而病株块茎的2个样品间距离较远,且均与土壤样品完全分开,说明病株块茎样品的细菌群落结构与土壤样品的细菌群落结构存在较大差异。进行NMDS分析获得的结果(图1-B)与PCoA分析结果一致,4个土壤样品几乎完全重叠,而2个病株块茎样品间的距离很远,且与土壤样品的距离也很远,说明与病株块茎相比较,土壤样品的细菌群落结构非常相似,细菌群落结构与样品来源相关。
以α多样性指数对土壤样品与病株块茎样品的细菌群落多样性进行比较,结果(表1和图2)发现土壤样品的细菌种类(OTU数目)、丰富度(Chao1指数)和多样性(Shannon指数)均高于病株块茎样品,说明土壤样品的细菌群落多样性高于病株块茎的细菌群落多样性。
2. 2 马铃薯根际土壤细菌群落组成分析结果
对马铃薯根际土壤的4个样品进行PCoA分析,此时4个样品均发生了分离。其中,旱地轮作样品HD.J和HD.B位于横轴主坐标1(PCoA1)的正端,水旱轮作样品SH.J和SH.B位于横轴PCoA1的负端,PCoA1是造成4个样品的最大差异特征,贡献率为39.1%(图3-A);同时,健康马铃薯的根际土壤样品HD.J和SH.J位于纵轴主坐标2(PCoA2)的正端,发病马铃薯的根际土壤样品HD.B和SH.B位于纵轴PCoA2的负端,PCoA2是造成4个样品的第二大差异特征,贡献率为34.7%(图3-B)。PCoA1和PCoA2的累积贡献率达73.8%,能较全面地反映样本信息。分析结果表明,马铃薯种植模式(旱地轮作或水旱轮作)是影响土壤细菌群落变化的最主要因素,贡献率为39.1%,而马铃薯植株健康状况是影响土壤细菌群落变化的第二大因素,贡献率为34.7%。
对马铃薯根际土壤的4个样品进行细菌种类、丰富度和多样性分析,结果(表1)显示,各样品中按OTU数目排序为:HD.J>HD.B>SH.J>SH.B,按Chao1指数排序为:HD.J>HD.B>SH.J>SH.B,按Shannon指数排序为:SH.J>SH.B>HD.J>HD.B。说明虽然旱地轮作的土壤细菌群落种类较多,但水旱轮作的土壤细菌群落多样性更高。结果也显示,健株根际土壤细菌群落多样性均高于相应病株土壤的细菌群落。
4个马铃薯根际土壤样品的细菌归属于24门40纲83目129科181属。在门水平上,相对丰度排前10的细菌类群依次为细菌界的变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、Saccharibacteria和硝化螺旋菌门(Nitrospirae),以及古细菌界的奇古菌门(Thaumarchaeota)和广古菌门(Euryarchaeota)(图4-A)。其中,变形菌门是占绝对优势的细菌门,在各样品中的相对丰度分别为:27.98%(HD.B)、31.89%(HD.J)、45.46%(SH.B)和32.87%(SH.J);其次是酸杆菌门,在各样品中的相对丰度分别为:14.80%(HD.B)、19.12%(HD.J)、24.36%(SH.B)和30.83%(SH.J)。旱地轮作的2个样品的细菌群落结构较相似,水旱轮作的2个样品的细菌群落结构较相似。
在属水平上(图4-B),旱地轮作的2个样品与水旱轮作的健株土壤样品的细菌群落结构较相似,而水旱轮作的病株根际土壤样品呈现出特有的细菌群落结构特征。以相对丰度大于1.00%的属为优势属,分别取4个样品的优势属进行比较,HD.B与HD.J的优势属均有10个,SH.J的优势属有9个,3个土壤样品的优势属总相对丰度为23.00%~30.00%,而SH.B的优势属有19个,相对丰度之和为44.60%。在4个土壤样品中均出现的优势属是奇古菌门的Candidatus_Nitrosotalea、Candidatus_Koribacter和Candidatu_Solibacter,以及变形菌门的鞘氨醇单胞菌属(Sphingomonas)和罗河杆菌属(Rhodanobacter),5个优势属在各样品中所占的比例分别为15.92%(HD.B)、22.38%(HD.J)、15.67%(SH.B)和20.83%(SH.J),即5个优势属在病株土壤的相对丰度均低于健株土壤。在旱地轮作的病株根际土壤样品中特有的优势属为节杆菌属(Arthrobacter)、Mucilaginibacter、Dyella和纤线杆菌属(Ktedonobacter),总相对丰度为5.06%;在水旱轮作的病株根际土壤样品中特有的优势属为不动杆菌属(Acinetobacter)、肠杆菌属(Enterobacter)、果胶杆菌属(Pectobacterium)、雷尔氏菌属(Ralstonia)、水恒杆菌属(Mizugakiibacter)、土地杆菌属(Pedobacter)、泛菌属(Pantoea)、Granulicella和伯克氏菌属(Burkholderia),9个属的总相对丰度为19.56%,除土地杆菌属和Granulicella外,其余7个优势属均来自变形菌门,相对丰度总和为17.09%。在种水平上,在旱地轮作的病株根际土壤样品中无丰度大于1.00%的优势种,而水旱轮作的病株根际土壤样品中特有的优势种是软腐病果胶杆菌(P. carotovorum)、雷尔氏菌(R. solanacearum)和不动杆菌(A. rudis),相对丰度分别为2.03%、1.46%和1.22%,其中软腐病果胶杆菌和雷尔氏菌是马铃薯的主要病原细菌,可分别导致马铃薯黑胫病和青枯病发生。
2. 3 马铃薯病株块茎细菌群落组成分析结果
PCoA分析和NMDS分析结果(图1)均显示,水旱轮作病株块茎与旱地轮作病株块茎的细菌群落结构发生显著分离。对马铃薯的2个病株块茎样品进行细菌种类、丰富度及多样性分析结果(表1)显示,旱地轮作病株块茎的细菌群落丰富度和多样性均比水旱轮作的病株块茎低。旱地轮作的马铃薯病株块茎(P.HD.B)样品细菌归属于12门16纲31目33科23属;在门水平上,相对丰度排在前4的变形菌门(40.33%)、酸杆菌门(26.73%)、放线菌门(10.50%)和绿弯菌门(7.16%)的相对丰度总和达84.72%(图5-A);在属水平上有11个优势属,相对丰度总和为24.10%,其中相对丰度最高的前3個属为鞘氨醇单胞菌属(5.01%)、Candidatus_Nitrosotalea(3.58%)和嗜盐单胞菌属(Halomonas)(3.10%)(图5-B)。水旱轮作马铃薯病株块茎(P.SH.B)样品细菌归属于14门24纲43目51科47属;在门水平,相对丰度排在前4的变形菌门(36.25%)、厚壁菌门(21.89%)、放线菌门(12.23%)和酸杆菌门(10.21%)的相对丰度总和达80.58%(图5-A);在属水平有17个优势属,相对丰度总和为45.07%,其中相对丰度最高的前3个属为奈瑟菌属(Neisseria)(7.65%)、嗜血杆菌属(Haemophilus)(5.67%)和链球菌属(Streptococcus)(4.21%)(图5-B),这3个属在P.HD.B中均未检测到。P.SH.B中除了包含P.HD.B检测到的23个属,还有5个属是其所特有。P.SH.B特有的5个属中有3个优势属在SH.B中未检测到。
2. 4 细菌群落代谢功能预测结果
通过将16S rDNA基因测序数据与FAPROTAX数据库比对,对不同菌落结构可能执行的功能进行预测,结果显示化能异养型、有氧化能异养型和发酵3类功能在各样品中的相对丰度均很高,其中在马铃薯病株块茎中的相对丰度最高,分别为64.15%(P.HD.B)和71.89%(P.SH.B),在旱地轮作土壤样品中的相对丰度较低,分别为61.25%(HD.B)和57.56%(HD.J),在水旱轮作土壤样品中的相对丰度最低,分别为44.93%(SH.B)和51.07%(SH.J)(图6)。3类功能中,发酵在P.SH.B样品中的相对丰度高达21.36%,在其他样品中的相对丰度在1.84%~4.41%。这是由于与发酵相关的嗜血杆菌属及链球菌属是P.SH.B样品的优势属。以相对丰度大于1.00%为优势功能,则只在病株土壤样品中发现特有的优势功能。其中,旱地轮作的病株根际土壤样品特有的优势功能是产甲烷作用,相对丰度为1.18%,而该样品富含奇古菌门的甲烷微菌纲(Methanomicrobia)。在水旱轮作病株根际土壤样品中特有的优势功能种类较多,包括硝酸盐呼吸作用、氮呼吸作用、亚硝酸盐呼吸作用、亚硝酸盐氨化作用和硝酸盐氨化作用,均属于氮利用及代谢功能,相对丰度为1.48%~1.95%。
3 讨论
植物生长与其根际土壤微生物密切相关,植物通过根系分泌物可影响土壤的理化性质,进而影响土壤微生物群落组成和结构(Chen et al.,2019)。研究表明,不同种植模式对土壤微生物群落结构形成有明显的影响(张文锋等,2018;Hartman et al.,2018)。而本研究通过比较根际土壤样品间细菌群落差异也发现,不同种植模式对马铃薯根际土壤细菌群落的影响较大。虽然旱地轮作模式下根际土壤细菌群落种类更多,但其多样性不高,优势属的数量及总丰度均低于水旱轮作模式。早期研究报道,轮作模式可促进土壤中有机质的积累,从而提高土壤中的微生物多样性,而水旱轮作模式在积累土壤有机物质、改善土壤性质及提高土壤微生物活性方面成效特别显著。水旱轮作模式下,土壤环境为厌氧及好氧条件交替,土壤中的碳/氮循环加速,是水旱轮作模式土壤中的微生物多样性高于旱地轮作模式的主要原因(Kong et al.,2005;Liu et al.,2015)。本研究发现水旱轮作模式下的优势属伯克氏菌属和果胶杆菌属已有文献报道具有高效固氮作用,其氮利用及代谢功能更强,能有效利用高分子量有机物,起到更好的固氮作用,既促进作物生长,又促使作物更能适应水旱轮作模式(Gyaneshwar et al.,2011)。本研究对细菌功能进行预测的结果也显示,水旱轮作模式下的氮利用及代谢功能更强,是由于水旱轮作模式下富集了大量的可高效降解利用氮源等多种有机质的细菌,从而为马铃薯生长提供更多的营养物质。
植物健康与其土壤微生物群落多样性密切相关。本研究发现,马铃薯健康植株的根际土壤细菌群落多样性明显高于病株细菌群落多样性。但水旱轮作模式的病株土壤样品微生物多样性高,优势属多,且病原菌的相对丰度也高。可见,水旱轮作模式的土壤环境也促进病原菌的生长,病原菌相对丰度升高,增加了细菌性病害发生的风险。研究结果提示,水旱轮作模式会促进营养利用率高的细菌包括植物病原细菌增殖,因此在该种植模式下需要特别注意防治细菌性病害。
本研究还发现马铃薯病株块茎的细菌群落种类及多样性明显低于其根际土壤的细菌群落,但在根际土壤样品中能找到很多与马铃薯病株块茎样品中相似的细菌类群,这在一定程度上说明马铃薯病株块茎内定殖的细菌具有选择性,并且主要来源于根际土壤。相关研究也发现类似的定殖规律,但根系分泌的糖类、氨基酸和有机酸等物质与块茎内的主要营养物质存在明显差别,即使块茎内的微生物主要来源于根际,也会因其营养环境改变而定殖特定的微生物(Kobayashi et al.,2015;Zimudzi et al.,2018;Buchholz et al.,2019)。
4 结论
与旱地轮作模式相比较,水旱轮作模式下的马铃薯根际土壤细菌相对丰度和多样性更高,优势属的种类和相对丰度也更高。因此,通过水旱轮作的方式可改善土壤微生物的种群结构,丰富土壤中有益细菌,但在该种植模式下病原细菌也容易大量繁殖,因此使用该种植模式需特别注意防治马铃薯细菌性病害。
参考文献:
李忠奎,凌爱芬,李红丽,陈娟,朱显俊,王勇,陈玉蓝,王岩. 2019. 基于多样性测序对健康与易感病烟田根际土壤微生物群落分析[J]. 河南农业大学学报,53(6):918-925. [Li Z K,Ling A F,Li H L,Chen J,Zhu X J,Wang Y,Chen Y L,Wang Y. 2019. Analysis of rhizosphere soil microbial communities in healthy and susceptible tobacco fields based on diversity sequencing[J]. Journal of Henan Agricultural University,53(6):918-925.]
廖咏梅,黄元腾吉,韩宁宁,凌展,邹承武,史鼎鼎,蒋代华. 2019. 稻鸭共育模式下水稻根际土壤真菌和细菌种群多样性分析[J]. 南方农业学报,50(1): 65-73. [Liao Y M,Huang Y T J,Han N N,Ling Z,Zou C W,Shi D D,Jiang D H. 2019. Analysis of population diversity of fungi and bacteria in rice rhizosphere soil under rice-duck farming model[J]. Journal of Southern Agriculture,50(1): 65-73.]
苏婷,韩海亮,赵福成,王桂跃. 2016. 水田、旱地与水旱轮作种植方式土壤微生物群落的差异[J]. 浙江农业科学,57(2): 261-262. [Su T,Han H L,Zhao F C,Wang G Y. 2016. Differences of soil microbial communities in paddy field,dry land and rotation cropping[J]. Zhejiang Agricultural Science,57(2): 261-262.]
谭雪莲,郭天文,刘高远. 2016. 马铃薯连作土壤微生物特性与土传病原菌的相互关系[J]. 灌溉排水学报,35(8): 30-35. [Tan X L,Guo T W,Liu G Y. 2016. Interrelation between soil microbial characters and borne pathogen of potato continuous cropping[J]. Journal of irrigation and drainage,35(8): 30-35.]
王悦,杨贝贝,王浩,杨程,张菊,朱濛,杨如意. 2019. 不同种植模式下丹参根际土壤微生物群落结构变化[J]. 生态学报,39(13): 4832-4843. [Wang Y,Yang B B,Wang H,Yang C,Zhang J,Zhu M,Yang R Y. 2019. Variation in microbial community structure in the rhizosphere soil of Salvia miltiorrhiza Bunge under three cropping modes[J]. Acta Ecologica Sinica,39(13): 4832-4843.]
韋本辉,韦威泰,甘秀芹,唐荣华,覃维治,宁秀呈. 2005. 马铃薯新品种冬种品比及栽培密度研究[J]. 中国马铃薯,19(1): 30-32. [Wei B H,Wei W T,Gan X Q,Tang R H,Qin W Z,Ning X C. 2005. Study on variety comparison and planting density of new potato varieties in winter [J]. Chinese Potato Journal,19(1): 30-32.]
杨潇湘,张蕾,黄小琴,伍文宪,周西全,杜磊,黎怀忠,刘勇. 2019. 基于高通量测序分析大豆和油菜根际微生物群落结构的差异[J]. 应用生态学报,30(7): 2345-2351. [Yang X X,Zhang L,Huang X Q,Wu W X,Zhou X Q,Du L,Li H Z,Liu Y. 2019. Difference of the microbial community structure in the rhizosphere of soybean and oilseed rape based on high-throughput pyrosequencing analysis[J]. Chinese Journal of Applied Ecology,30(7): 2345-2351.]
姚华开,张传进,刘岳飞,吴人敏,杨尚东. 2018. 混栽对主栽作物茄子根际土壤微生物生态学特性的影响[J]. 热带作物学报,39(6): 1067-1074. [Yao H K,Zhang C J,Liu Y F,Wu R M,Yang S D. 2018. Effects of intercropping on soil characteristics of microbial ecology in rhizosphere of eggplant[J]. Chinese Journal of Tropical Crops,39(6): 1067-1074.]
张文锋,时红,才硕,武琳,胡秋萍,徐涛,张昆. 2018. 不同灌溉和栽培方式对红壤性水稻土微生物群落结构及多样性的影响[J]. 江西农业学报,30(3):11-16. [Zhang W F,Shi H,Cai S,Wu L,Hu Q P,Xu T,Zhang K. 2018. Effects of different irrigation and cultivation methods on microbial community structure and diversity in paddy red soil[J]. Acta Agriculturae Jiangxi,30(3):11-16.]
张笑宇,段宏群,王闷灵,李红丽,芦阿虔,王岩. 2018. 轮作与连作对烟田土壤微生物区系及多样性的影响[J]. 中国土壤与肥料,(6): 84-90. [Zhang X Y,Duan H Q,Wang M L,Li H L,Lu A Q,Wang Y. 2018. Effects of rotation and continuous cropping on soil microflora and diversity in tobacco field[J]. Soil and Fertilizer Sciences in China,(6): 84-90.]
Buchholz F,Antonielli L,Kostic T,Sessitsch A,Mitter B. 2019. The bacterial community in potato is recruited from soil and partly inherited across generations[J]. PLoS One,14(11): e0223691.
Chen S M,Waghmode T R,Sun R B,Kuramae E E,Hu C S,Liu B B. 2019. Root-associated microbiomes of wheat under the combined effect of plant development and nitrogen fertilization[J]. Microbiome,7(1): 136.
Gyaneshwar P,Hirsch A M,Moulin L,Chen W M,Elliott G N,Bontemps C,Santos P E,Gross E,Reis F B,Sprent J I,Young J P W,James E K. 2011. Legume-nodulating Betaproteobacteria: Diversity,host range,and future prospects[J]. Molecular Plant-Microbe Interactions,24(11):1276-1288.
Hartman K,van der Heijden M G A,Wittwer R A,Banerjee S,Walser J C,Schlaeppi K. 2018. Cropping practices manipulate abundance patterns of root and soil microbiome members paving the way to smart farming[J]. Microbio-me,6(1):14.
Kobayashi A,Kobayashi Y O,Someya N,Ikeda S. 2015. Community analysis of root-and tuber-associated bacteria in field-grown potato plants harboring different resistance levels against common scab[J]. Microbes and Environments,30(4):301-309.
Kong A Y Y,Six J,Bryant D C,Denison R F,Kessel C V. 2005. The relationship between carbon input,aggregation,and soil organic carbon stabilization in sustainable cropping systems[J]. Soil Science Society of America Journal,69(4):1078-1085.
Kumar U,Shahid M,Tripathi R,Mohantya S,Kumar A,Bhattacharyya P,Lal B,Gautam P,Raja R,Panda B B,Jambhulkar N N,Shukla A K,Nayak A K. 2017. Variation of functional diversity of soil microbial community in sub-humid tropical rice-rice cropping system under long-term organic and inorganic fertilization[J]. Ecological Indicators,73(2): 536-543.
Ling N,Deng K Y,Song Y,Wu Y C,Zhao J,Raza W,Huang Q W,Shen Q R. 2014. Variation of rhizosphere bacterial community in watermelon continuous mono-cropping soil by long-term application of a novel bioorganic fertilizer[J]. Microbiological Research,169(7-8): 570-578.
Liu D,Ishikawa H,Nishida M,Tsuchiya K,Takahashi T,Kimura M,Asakawa S. 2015. Effect of paddy-upland rotation on methanogenic archaeal community structure in paddy field soil[J]. Microbial Ecology,69(1): 160-168.
Louca S,Parfrey L W,Doebeli M. 2016. Decoupling function and taxonomy in the global ocean microbiome[J]. Science,353(6305): 1272-1277.
Zimudzi J,van der Walls J E,Coutinho T A,Cowan D A,Angel V. 2018. Temporal shifts of fungal communities in the rhizosphere and on tubers in potato fields[J]. Fungal Biology,122(9):928-934.
(責任编辑 麻小燕)

