融合蛋白HSA-HGF 的体内抗肝纤维化活性
蔡燕飞, 徐栋生, 陈 蕴, 金 坚
(江南大学 药学院,江苏无锡,214122)
目前我国感染乙型肝炎病毒的人口基数巨大,发展至肝纤维化的比例也在逐年升高。 早期肝纤维化可通过干预治疗缓解或治愈,然而早期肝纤维化往往没有临床症状,容易错失治疗的最佳机会,患者在不知情的情况下长期不改变生活状态, 从而造成肝纤维化的程度缓慢加重, 最终发展至代偿性肝硬化[1]。到目前为止,除了肝脏移植,终末期肝硬化几乎没有更有效的治疗方式[2]。 因此寻找缓解、治疗肝纤维化的药物,避免肝纤维化发展为肝硬化具有重要意义。
肝 细 胞 生 长 因 子 (hepatocyte growth factor,HGF)是一种主要由肝脏非实质细胞分泌的多功能细胞因子,HGF 在体内以单链前体被合成和分泌,其单链前体不具有任何生物学活性,需要通过丝氨酸蛋白水解酶水解,然后在二硫键作用下形成双链分子才具有生物学活性[3]。 成熟的HGF 可以刺激多种组织器官修复,在多种疾病的研究中均具有一定的治疗潜力,包括:肝纤维化、急性肾衰竭、慢性皮肤溃烂、肌萎缩侧索硬化症等。 已有研究显示,HGF能促进肝脏再生以及抗肝纤维化,是具有治疗作用的潜力药物分子[3-4]。 有报道显示,HGF 在血液循环中的稳定性较差,其药物半衰期只有3~5 min,因此提高HGF 在血液循环中的稳定性是研究其应用潜力的重要部分[5]。
作者所在研究室前期针对成熟HGF 的氨基酸分子结构特点,对其酶水解部位进行了重新设计和定位改造, 即采用融合PCR 的方法将人HGF的第494 位的精氨酸R 定点突变成谷氨酸E, 改造后的蛋白质不经过活化过程就能保持活性,并在此基础上利用融合蛋白技术将改造后的HGF 分子与人血清白蛋白(human serum albumin,HSA)基因融合,获得了长效重组基因HSA-HGF(R494E),通过CHO表达系统可获得纯度超过90%的HSA-HGF(R494E)蛋白及HSA 单体对照品[6-8]。 本研究中所用的HSA-HGF融合蛋白即研究室前期制备的HSAHGF(R494E)蛋白。通过对该融合蛋白的体内抗肝纤维化分析,以期找到更佳稳定的抗肝纤维化药物。
1 材料与方法
1.1 材料
1.1.1 实验动物SPF 级BALB/c 小鼠:雄性,体质量(25±2) g,购自扬州大学比较医学中心,许可证号为SCXK (苏)2012-0004;SPF 级C57BL/6 小鼠:体质量(20±2) g,购自扬州大学比较医学中心,许可证号为SCXK(苏)2012-0004。 动物伦理审查号为:JN.No20170106-20170315[19]
按照每笼5 只将小鼠分笼,在室温25 ℃、光照12 h/d、湿度55 %的条件下饲养,喂食普通饲料与白开水,小鼠自由摄取食物。 小鼠处死均在麻醉状态下操作。
1.1.2 主要试剂四氯化碳(CCl4)、玉米油:购自上海腾翌生物科技有限公司;谷丙转氨酶(ALT)测试盒、谷草转氨酶(AST)测试盒、苏木素-伊红(H-E)染液、Masson 染液: 均购自南京建成生物工程研究所; Eu3+标记时间分辨荧光检测试剂盒:购自PE 公司;人HGF 对照品:购自R&D 公司;HSA 抗体:购自abcam 公司;水飞蓟素:购自Sigma 公司。
1.2 方法
1.2.1 动物模型的建立以及给药根据大量的文献调研[9-10],选择合适的给药方式设定实验分组,具体分组及给药方式如下:
BALB/c 小鼠随机分为6 组,每组6 只。
1)正常组:按照2 μL/g 腹腔注射玉米油,每周给药2 次,共6 周;
2) 模型组: 按照2 μL/g 腹腔注射体积比为25% 的CCl4玉米油溶液,每周给药2 次,共6 周;
3) 阳性组: 按照2 μL/g 腹腔注射体积比为25% 的CCl4玉米油溶液构建肝纤维化模型,同时按照100 μg/g 灌胃给予保肝药水飞蓟素, 每天给药1次,共6 周。
4)HSA 组: 按照2 μL/g 腹腔注射体积比为25%的CCl4玉米油溶液6 周后,按照50 pmol/g 尾静脉注射CHO 表达的HSA,每三天给药1 次,共2 周;
5)HGF 组: 按照2 μL/g 腹腔注射体积比为25% 的CCl4玉米油溶液6 周后, 按照250 pmol/g尾静脉注射HGF 对照品,每天给药1 次,共2 周;
6)HSA-HGF 组: 按照2 μL/g 腹腔注射体积比为25% 的CCl4玉米油溶液6 周后, 按照250 pmol/g尾静脉注射CHO 表达的HSA-HGF, 每三天给药1次,共2 周。 HGF 与HSA-HGF 的浓度保持一致。
1.2.2 肝组织石蜡切片的制备肝组织用PFA 固定, 然后依次经体积比为75%、85%、95%、100%、100%的酒精梯度进行组织脱水,脱水后浸入二甲苯透明,随后浸蜡包埋,将包埋好的蜡块切片,于45 ℃烘箱中烘干备用。
1.2.3 肝组织切片的HE 染色苏木素-伊红(Hematoxylin-Eosin,HE)染色是组织学技术的常规染色方法,能很好地反映正常组织与病变组织的形态结构差异,其具体操作步骤参照说明书。
1.2.4 肝组织切片的Masson 染色Masson 染色是显示组织中纤维以及炎性因子的染色方法之一,胶原纤维呈蓝色,肌纤维呈红色,具体操作步骤参照说明书。
1.2.5 血清中肝功能指标的测定应用商业化试剂盒检测各组小鼠血清中的肝功能指标,包括谷丙转氨酶ALT 以及谷草转氨酶AST,具体操作步骤参照说明书。
1.2.6 肝组织中α-SMA 和COLⅠ基因转录水平测定将肝组织剪碎后加入液氮速冻并充分研磨,然后加入Trizol 裂解液裂解, 提取总RNA 后进行qRTPCR,所用引物序列见表1。

表1 qRT-PCR 引物Table 1 Primer sequences for real-time RT-PCR
1.3 融合蛋白HSA-HGF 的体内半衰期分析
1)融合蛋白HSA-HGF 标记Eu3+离子:将0.5 mg HSA-HGF 蛋白脱盐换液至50 mmol/L 后备用。 按照Eu3+标记盒说明书, 将上述制备的0.5 mg HSA-HGF蛋白溶液与0.1 mg Eu3+-N2-[p-异氰酸-苄基]-二乙烯三胺四乙酸(Eu3+-DTTA)溶液在30 ℃下搅拌反应20 h。 反应液经过SepharoseCL-6B 柱层析后收集, 紫外可见分光光度计在280 nm 条件下检测收集的蛋白质峰,稀释后分装备用。
2)Eu3+离子标记融合蛋白HSA-HGF 的稳定性检测:标记Eu3+后的融合蛋白质量浓度为200 mg/L,将蛋白质稀释10 倍后分成两组,分别置于37 ℃与4 ℃保持72 h,Western blot 检测样品中蛋白质的完整性,其中一抗为抗HSA 抗体(1:1000 稀释)。
3)标记蛋白质上Eu3+离子稳定性检测:标记Eu3+后的融合蛋白质量浓度为200 mg/L,将蛋白质稀释10 倍后分成两组, 分别置于37 ℃与4 ℃保持72 h。随后样品经10 000 的超滤浓缩管浓缩;滤出液再次经3 500 的超滤浓缩浓缩。 在滤出液中加入等体积的苯酚: 氯仿=1:1 混合液,4 000 r/min 离心10 min,取上清液,重复抽提两遍以去除蛋白质。 运用时间分辨荧光法检测去除蛋白质样品的吸收值,设置PBS 为阴性对照,设置20 mg/L 标记的融合蛋白为阳性对照。
4)融合蛋白HSA-HGF 的体内半衰期检测:将C57BL/6 小鼠分为三笼,每笼6 只,每笼小鼠分别按照200、100、20 ng/g 尾 静 脉 注 射Eu3+离 子 标 记HSA-HGF。 在0.5、1、2、4、8、12、24、36、48 h 用断尾的方式收集小鼠血液, 室温静置15 min,330 r/min离心20 min, 每只小鼠每个时间点可取10~20 μL血清,血清样品进行时间分辨荧光免疫检测。
2 结果与讨论
2.1 融合蛋白HSA-HGF 的体内抗肝纤维化分析
2.1.1 小鼠生长情况及肝脏观察
1)生长情况:正常组小鼠生长正常,无死亡现象;模型组小鼠前两周因CCl4毒性作用有约15%的死亡率,两周后不再继续死亡,但小鼠普遍精神不振,毛色暗淡,体质重下降,建模后期,小鼠整体状态有所回升。 HSA 组小鼠生长状况与模型组相似,阳性组、HGF 组和融合蛋白HSA-HGF 组小鼠在给药后生长状态有所好转,各项指标均有所回升。
2)肝脏表观观察:各组小鼠的肝脏表观见图1。正常组小鼠肝脏质地柔软,表面光滑,形态规整,呈健康的鲜红色;模型组小鼠肝脏肿胀,表面呈明显的颗粒状,质地变硬,无光泽;HSA 组小鼠肝脏与模型组类似,没有明显的表观差异;阳性组、HGF 组和融合蛋白HSA-HGF 组小鼠肝脏颜色恢复鲜红色,质地变软,表面变光滑,与模型组相比差异明显,表明和阳性药物水飞蓟素一样, HGF 和融合蛋白HSA-HGF 均具有一定的肝脏保护功效。

图1 各组小鼠肝脏外观Fig. 1 The liver appearance of each group
3)检测各组小鼠的肝脏质量和肝脏指数:结果见表2。与正常组相比,模型组小鼠肝脏质量显著增加,肝脏指数也显著升高,表明模型组小鼠肝脏处于代偿性增生阶段; 阳性组、HGF 组和HSA-HGF组经过药物干预作用后,小鼠肝脏质量及肝脏指数有着不同程度的下降, 与模型组相比有显著性差异,表明药物作用后,小鼠的肝脏出现了不同程度的恢复。 HSA 组与模型组相比,其肝质量和肝脏指数均没有显著性差异。
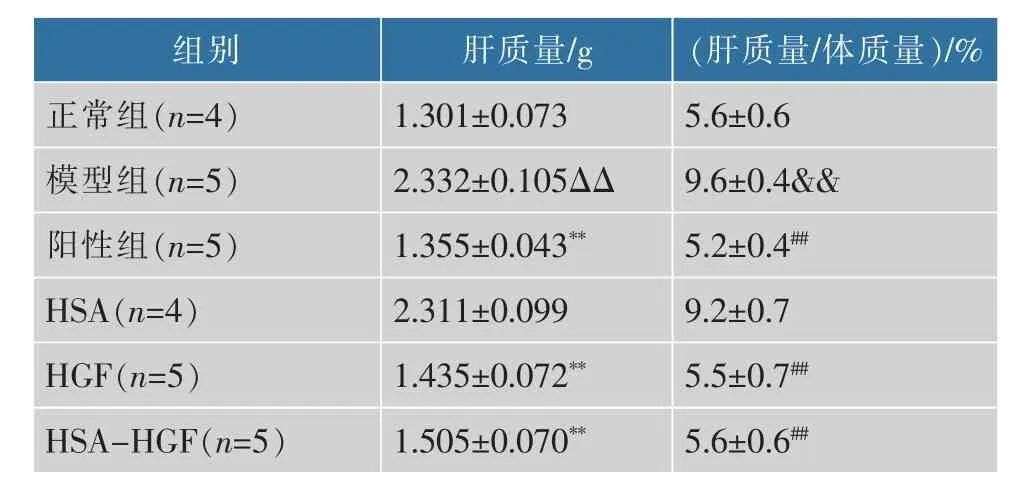
表2 各组小鼠肝脏质量和肝脏指数Table 2 Liver weight and liver index of mice in each group(b±s)
2.1.2 肝脏病理学观察各组小鼠肝脏石蜡切片经HE 染色后结果见图2。 正常组小鼠肝细胞形态正常、排列整齐、多个肝细胞有双核现象,表明有丝分裂旺盛, 肝脏再生能力强;CCl4模型组小鼠肝脏结构紊乱,肝细胞间隙变大,呈丝状,肝脏组织呈空泡样变,大量的中性粒细胞聚集在血管周围,表明炎症严重;HSA 组小鼠肝脏与模型组类似, 肝细胞数目明显减少,表明HSA 并没有改善肝纤维化的效果; 与阳性组小鼠肝脏相比,CCl4模型组有较大改善, 趋近于正常组小鼠肝脏; HGF 组与HSA-HGF组小鼠肝脏与阳性组类似,肝脏再生能力强。
综上表明,CCl4损伤肝脏一段时期后, 肝脏细胞被严重损坏,保肝药水飞蓟素可以明显改善肝脏状态。通过尾静脉注射HGF 或其融合蛋白HSA-HGF都可以明显促进CCl4损伤小鼠的肝脏恢复。本研究选用的每天注射250 pmol/g 人HGF 与每三天注射等摩尔的HSA-HGF 引起的治疗效果类似, 该结果从侧面证明了与单体药物HGF 相比, 融合蛋白HSA-HGF 在小鼠体内的稳定性有很大的提高。

图2 各组小鼠的HE 染色Fig. 2 Effect of HE staining on each group
Masson 染色结果见图3。 Masson 染色肝脏结构与HE 染色的类似,Masson 染色主要用于观察胶原沉积效果。 正常组的肝脏内部几乎没有胶原沉积,肝脏状态良好; 模型组小鼠肝脏细胞大量坏死,胶原堆积, 纤维化程度高, 与正常组相比差异明显;HSA 组小鼠肝脏与模型组相似, 表明HSA 组没有明显的抗肝纤维化效果;阳性组的小鼠肝脏结构恢复比较理想,坏死细胞减少,但是细胞间隙还存在较多胶原,表明水飞蓟素对肝脏纤维化有一定的缓解作用;单体HGF 与融合蛋白HSA-HGF 组都有一定的缓解肝纤维化效果,肝脏整体结构良好。
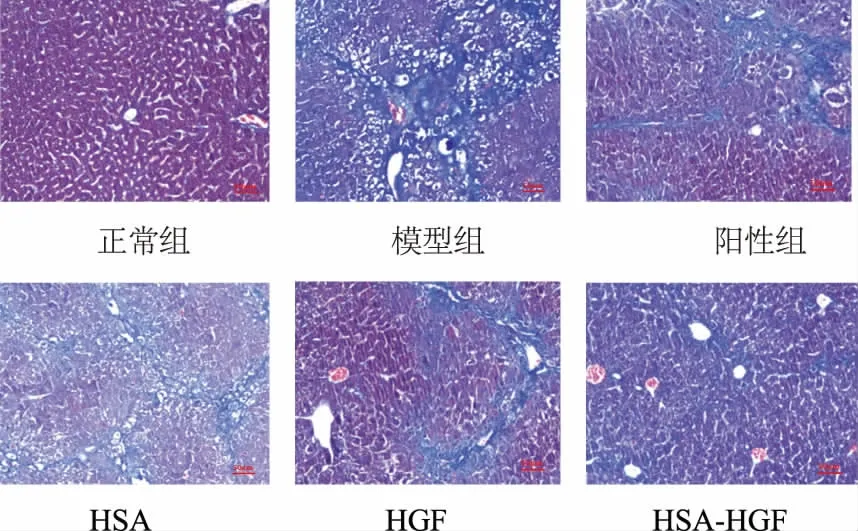
图3 各组小鼠的Masson 染色Fig. 3 Effect of Masson staining on each group
2.1.3 肝功能指标检测经过CCl4持续损伤后,小鼠肝细胞出现大量坏死, 血液中的AST 和ALT 含量开始急剧升高。 与正常组相比,CCl4模型组的AST 和ALT 活性明显提高。 而阳性组、HGF 组以及HSA-HGF 组肝功能指标比模型组下降, 具有显著性差异, 而HSA 组与模型组相比无显著性差异,表明融合蛋白HSA-HGF 具有良好的肝脏保护作用,见表3。

表3 血清肝功能检测Table 3 Detection of blood liver function indexes(x±s)
2.1.4 肝纤维化标志物α-SMA 和COLⅠ的转录水平变化肝纤维化在发展过程中,会引起其标志物α-SMA 和COLⅠ的表达水平逐渐上升, 结果见图4。两种标志物的mRNA 水平在模型组中明显升高,HSA 组与模型组表现相似, 而阳性组、HGF 组和HSA-HGF 组的结果表明三者均可以明显下调α-SMA 和COLⅠ的转录水平,提示有较好的抗肝纤维化能力。
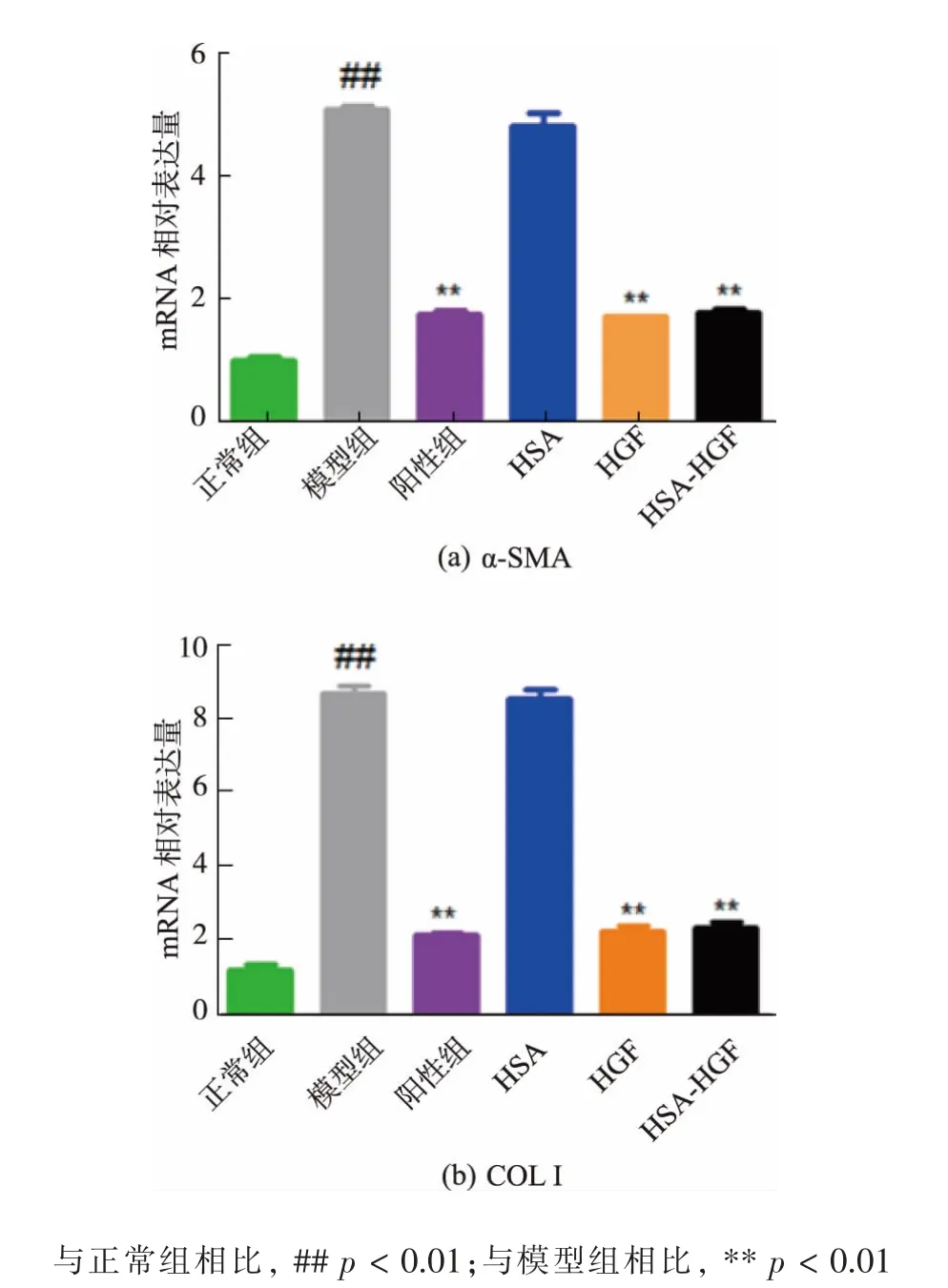
图4 α-SMA 和COLⅠ的mRNA 水平检测Fig. 4 mRNA level of α-SMA and COL
2.2 HSA-HGF 的体内半衰期检测
通过Eu3+离子鳌和标记蛋白HSA-HGF, 将标记后的融合蛋白以尾静脉注射小鼠体内后,通过检测血清中Eu3+离子的含量来确定其体内半衰期。 首先对该方法学的可靠性进行验证,将标记后的蛋白质稀释10 倍, 分成2 组后分别置于37 ℃与4 ℃保持72 h,通过Western blot 检测,结果显示没有任何降解片段,检测到的蛋白质相对分子质量约为130 000,与融合蛋白质实际相对分子质量相符,见图5。说明Eu3+离子标记后没有明显影响蛋白质稳定性。
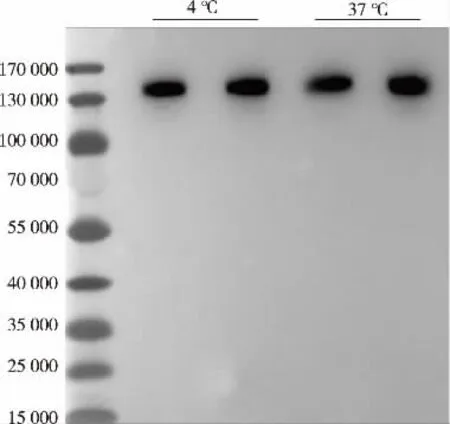
图5 Eu3+离子标记蛋白质稳定性的Western blot 检测Fig. 5 Stability detection of Eu3 + labeled protein by western blot
将标记后的蛋白质样品稀释10 倍, 然后分成两组, 分别置于37 ℃与4 ℃保持72 h, 经10 000与3 500 的超滤和蛋白质抽提,去除蛋白质,检测溶液里残留的Eu3+离子,见图6。 结果显示,待检测溶液中的Eu3+离子非常少, 表明用此方法标记的Eu3+离子一旦标记到蛋白质上就不容易产生脱离。
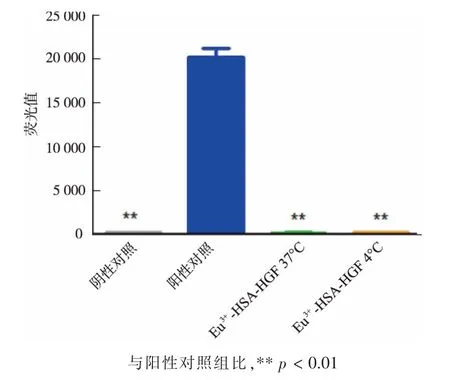
图6 标记蛋白质上Eu3+离子稳定性的检测Fig. 6 Stability detection of Eu3+on labeled protein.x±s,n=3.
实验设置了200、100、20 ng/g 三个浓度梯度,通过一次性尾静脉注射Eu3+离子标记的HSA-HGF蛋白, 分别在0.5、1、2、4、8、12、24、36、48 h 收集小鼠血液, 以血液中Eu3+标记的HSA-HGF 含量变化体现其体内半衰期,结果见图7。 HSA-HGF 融合蛋白的半衰期延长到3 h 左右。已有研究显示HGF 单体分子的半衰期仅仅在3 min 左右[8-9],相比较而言,融合蛋白HSA-HGF 的半衰期有显著提高, 体现了优越的稳定性。
3 结 语
本研究是在课题组前期研究基础上,通过对融合蛋白的体内抗肝纤维化及其体内半衰期进行分析, 进一步评价了新型融合蛋白HSA-HGF 的稳定性,挖掘其应用潜能。 小鼠体内实验结果显示,融合蛋白可以明显促进小鼠的肝脏恢复。 其中HGF 治疗组用药频率为每天用药, 而相应的融合蛋白HSA-HGF 治疗组为三天给一次药, 两者的抗肝纤维化效果相当,表明在低注射频率下融合蛋白具有明显提高肝功能以及抗肝纤维化的效果。 同时,小鼠体内半衰期实验进一步证明了融合蛋白的体内半衰期显著长于单体。 综上表明, 融合蛋白HSAHGF 具有成为抗肝纤维化药物的潜力。本研究也存在一些不足之处,如动物实验设置的组别可进一步完善, 最好设置所有组别的低频给药和高频给药组;由于HGF 单体蛋白质药物价格昂贵,本实验在检测药物半衰期时,未设置HGF 单体对照组,后期考虑通过CHO 表达系统制备HGF 单体蛋白质药物,从而进一步证明融合蛋白质的稳定优势;HSAHGF 想要真正成为抗肝纤维化药物依然任重道远,如该产品的肝特异性、无肝细胞毒性、安全性等均需要进一步的评估。

