共表达分子伴侣提高漆酶在毕赤酵母中的分泌
王晨蕾, 刘 松, 堵国成, 陈 坚*
(1. 江南大学 工业生物技术教育部重点实验室, 江苏 无锡214122;2. 江南大学 生物工程学院, 江苏 无锡214122)
漆酶是含多个铜原子的一种多酚氧化酶,广泛分布于真菌、高等植物、细菌和昆虫等生物中[1]。 漆酶可以高效地催化作用于各种酚类及非酚类化合物[2],伴随着将氧分子还原为水分子。 漆酶作为化合物合成或结构修饰的催化剂被广泛应用于环境的生物修复[3]、生物燃料生产[4]和生物制浆、纺织工业[5]等。 尤其在造纸工业中,采用传统的强酸强碱高温蒸煮制浆和化学法漂白,使废液中含有多种有毒有害的有机化合物[6]。 漆酶作为生物制浆和生物漂白的催化剂在造纸工业中得到应用[7],与其它木素分解酶相比,漆酶催化效能高、反应条件温和、对反应设备的要求低[8]。 随着漆酶用途的不断发现,对该酶的需求越来越大,因此提高漆酶的产量备受关注。
漆酶大多来源于丝状真菌,发酵周期长、操作复杂、产生多种漆酶同工酶,阻碍了后续纯化[9]。 异源表达不仅可以克服此障碍,且可采用蛋白质工程手段对酶分子改造,既可以提高产量,又能改善酶学性能[10],扩大其工业应用。目前漆酶在细菌、植物、酵母中均已实现异源表达。 细菌分泌漆酶能力普遍较低[11-12],且易形成聚合体难以纯化。 Paulo 等[12]在E. coliAH3517 中用5 L 体系发酵漆酶, 产量最高为5 600 U/L。在转基因植物中,漆酶产量更低,只有50~250 U/L[13-14]。 漆酶在酵母中主要以Pichia pastoris和Saccharomyces cerevisiae为宿主, 已有较多表达成功的例子,然而普遍产量也不高,表达水平不仅与酵母种类有关,还受漆酶同工酶种类的影响[15]。
巴斯德毕赤酵母(P. pastoris)作为一种相对简单的真核表达系统,可以对外源重组蛋白质进行正确的折叠加工、糖基化修饰等,使用AOX1 强启动子,以甲醇作为碳源,实现了多种外源产物的高效表达而得到广泛应用[16]。研究报道,不同的蛋白质在毕赤酵母中表达时可能有不同的未折叠蛋白质响应(UPR)效应,可以通过改善蛋白折叠加工、运输、胁迫应激等通路来提高UPR 因子效应,从而帮助外源蛋白质更好地分泌表达[17-19]。 Higashio 等[17]的研究结果表明, 在S. cerevisiae表达系统中过量表达T. reesei来源UPR 转录因子HAC1,使α 淀粉酶分泌量提高了2.4 倍。陈凤祥[18]等在P. pastoris中共表达PDI 使重组菌IFNβ-HAS 表达量提高了90%。
为提高漆酶的表达水平,作者拟通过表达蛋白质折叠(BIP、ERO1)、囊泡运输(SEC53、SEC1)、胁迫应激(HAC1、GCN4)等相关6 种分子伴侣,以期提高Cerrenasp. WR1 漆酶在重组P. pastoris中的表达水平。
1 材料与方法
1.1 材料
1.1.1 菌株及质粒Cerrenasp. WR1 来源的漆酶(GeneID:899203):由南京金斯瑞公司按照P. pastoris密 码 子 偏 好 性 合 成;E. coliJM109、pMD-19T Simple、pGAPZB 和 含 重 组 质 粒pPIC9K-laccase 的P. pastoris菌株PP-L:均为作者所在实验室保存。
1.1.2 主要试剂限制性内切酶PmlI、XhoI 和AvrII:均购自Thermo 公司;胶回收柱回收试剂盒、感受态制备试剂盒、Primer STAR HS DNA 聚合酶、DNA 连接酶: 均购自大连宝生物TaKaRa 公司;质粒提取试剂盒、G418: 购自上海生工生物工程股份有限公司;酵母基因组DNA 抽提试剂盒:购自天根;酵母粉与胰蛋白胨:购自Oxoid 公司;底物ABTS:购自Sigma 公司(美国);博莱霉素Zeocin(100 mg/mL):购自Invitrogen 公司;蛋白质Maker、考马斯亮蓝染色液: 均购自碧云天生物技术研究所;NuPAGE®Novex®Bis-Tris 预制凝胶: 购自Life Technologies 公司;其他常规试剂及药品:为国产或进口分装。
1.1.3 培养基LB 低盐培养基:0.5 g/dL 酵母提取物,1 g/dL 蛋白胨,0.5 g/dL NaCl,pH 7.0。
YPD 培养基:1 g/dL 酵母提取物,2 g/dL 蛋白胨,2 g/dL D-葡萄糖。
BMGY 培养基:1 g/dL 酵母提取物,2 g/dL 蛋白胨,2 g/dL 甘油,体积分数10%的100 mmol/L 的PB(pH 6.0), 体积分数10%的10×YNB 酵母基础氮源母液,4×10-5g/dL 生物素。
BMMY 培养基:1 g/dL 酵母提取物,2 g/dL 蛋白胨,2 g/dL 甲醇,体积分数10%的100 mmol/L 的PB(pH 6.0), 体积分数10%的10×YNB 酵母基础氮源母液,4×10-5g/dL 生物素。
1.2 方法
1.2.1 毕赤酵母分子伴侣共表达质粒的构建GS115 基因组DNA 依照天根的酵母基因组DNA 提取试剂盒说明书进行。配制0.8 g/dL 的琼脂糖对抽提的基因组DNA 进行凝胶电泳检测纯度, 使用Nanodrop 检测其浓度,作为扩增分子伴侣基因的模板。
结合参考文献, 作者分别选取蛋白折叠(BIP、ERO1)、 囊泡运输(SEC53、SEC1)、 胁迫应激反应(HAC1、GCN4)模块中的6 个基因,设计引物扩增P. pastorisGS115 分子伴侣基因,见表1。 取0.5 μL的GS115 基因组DNA 为扩增模板, 分别加入表1中的6 组分子伴侣基因扩增引物,用Primer Star HS高保真酶扩增。 扩增产物经琼脂糖凝胶电泳检测确认大小正确后,胶回收,用PmlI 和XhoI 酶切;质粒pGAPZB 同样用PmlI 和XhoI 酶切,柱回收;连接, 构建成功6 个分子伴侣的组成型表达质粒,并将对分泌表达量有提高的分子伴侣进行组合共表达,构建一系列质粒及菌株,见表2。

表1 扩增分子伴侣所用引物Table 1 Primers used for amplification of chaperones
表2 本研究使用的菌株和共表达质粒Table 2 Strains and plasmids used in this study
1.2.2 毕赤酵母转化与筛选漆酶表达质粒:将pPIC9K-Laccase 质粒用SalI 单酶切线性化, 柱回收后转化P. pastorisGS115 感受态,涂布MD 平板,长出单菌落后,用含G418 抗生素的YPD 平板进行拷贝数筛选。
分子伴侣表达质粒:将上述构建好的分子伴侣共表达质粒,分别进行单酶切(Avr II)线性化,柱回收后转化PP-L 感受态, 筛选平板选用含博莱霉素Zeocin 的YPD 平板,并进行菌落PCR 验证,获得单一目标分子伴侣DNA 条带的菌株即为阳性转化子;B 类菌株构建基于A 类菌株制作的感受态,同样电击转化相应线性化质粒后, 用含博莱霉素Zeocin 的YPD 平板筛选,菌落PCR 验证,同时获得两条目标分子伴侣DNA 条带的菌株即为阳性转化子。
1.2.3 重组菌发酵种子培养:取重组菌单菌落接种于YPD 培养基中,30 ℃、220 r/min 培养14 h 左右活化种子。
生长培养:上述活化的种子液以体积分数10%转接于BMGY生长培养基中,30 ℃、220 r/min 培养24 h。
发酵培养:将上述培养液以5 000 r/min、4 ℃离心5 min,菌体沉淀用无菌水洗涤1~2 次后,全部转接与BMMY 发酵培养基中,220 r/min、25 ℃摇瓶培养, 每24 小时补加2%甲醇诱导培养, 取样进行SDS-PAGE 鉴定。
1.2.4 重组菌发酵生物量的测定菌体从BMGY生长培养基转接到BMMY 发酵培养基后, 每24 小时取发酵液,稀释,测定OD600,计算菌体密度。
1.2.5 漆酶酶活测定漆酶酶活力检测:取一定的发酵液,8 000 r/min 离心10 min, 取上清液作为粗酶液。 漆酶反应体系为:0.1 mL 酶稀释液,1 mmol/L的ABTS 0.5 mL,100 mmol/L(pH 3.4)的柠檬酸-柠檬酸钠缓冲液2.4 mL,失活的酶液为空白对照。 漆酶反应条件为:30 ℃将ABTS 和柠檬酸-柠檬酸钠缓冲液分别保温5 min,加入酶液,于420 nm 处测定3 min 内吸光值的变化。
1.2.6 SDS-PAGE 凝胶电泳分析样品与4×Loading buffer 混匀后,72 ℃加热10 min, 蛋白质预制胶购自Life Technologies 公司,150 V 电泳30 min,具体操作方法参考说明书。
1.2.7 漆酶的纯化及酶学性质测定发酵液8 000 r/min,4 ℃低温离心10 min,得含漆酶的上清液。 将上清液放在冰中保持低温,在磁力搅拌器上边搅拌边加入硫酸铵粉末使其终质量浓度为75 g/dL,离心后将沉淀用A 液(10 mmol/L 的PB,pH 6.0)复溶后放入透析袋中,磁力搅拌器搅拌24 h,用0.25 μmol/L的微孔滤膜过滤, 所得样品用5 mL 阴离子柱Q 柱进行纯化。 柱纯化条件如下:用5~10 倍柱体积的A液对Q 柱进行平衡, 待电导稳定后, 流速设置为1 mL/min 从进样管道进样; 流速设置为3 mL/min,用5 倍柱体积的A 液淋洗柱子;以0、20%、40%、60%、80%、100%的B 液(10 mmol/L 的PB,pH 6.0,1 mol/L NaCl)进行梯度洗脱;取测到漆酶酶活的洗脱液在A液中过夜透析,4 ℃保存。
漆酶蛋白质质量浓度测定按照Bradford 蛋白质质量浓度测定试剂盒操作说明书进行;适当稀释纯化后的漆酶测定酶活力及蛋白质质量浓度后,计算比酶活;
按照1.2.5 方法在不同温度下(20~70 ℃,以5 ℃为间隔)测定酶活力,得到最适温度;在最适条件下,分别以不同浓度ABTS(柠檬酸-柠檬酸钠溶液)为底物, 测定不同ABTS 浓度下漆酶的酶活力,Km和Vmax用GraphPad Prism5 拟合得到; 分别测定酶液在50、60、70 ℃保温0~220 min 残留酶活,计算t1/2。
2 结果与讨论
2.1 共表达质粒的构建
按照图1 构建各共表达质粒, 以1.2.1 所述方法PCR 扩增这6 种分子伴侣基因片段,得到与理论值大小一致的条带, 见图2 (a)。 将各扩增基因的PCR 产物回收后,以表1 所列的相应酶切位点双酶切,pGAPZB 用相同酶切位点双酶切后连接、 转化,提取重组质粒进行双酶切鉴定,见图2(b)。 各重组表达质粒的命名见表2。 用于转化的各表达质粒均测序验证,测序结果与理论值一致。
2.2 共表达菌株产漆酶验证
将测序验证正确的各个共表达质粒分别用Avr II 单酶切线性化后,电击转化PP-L 菌株,使用含博莱霉素Zeocin 的YPD 平板筛选后, 挑取A 类菌株使用pGAPZB 通用引物进行菌落PCR 验证。 将A类菌株的阳性转化子进行发酵,测定漆酶产量。
为了考察组成型共表达各分子伴侣是否对亲本菌株生长产生不利影响,将构建的各共表达菌株在BMMY 培养基上的生长曲线进行测定,结果见图3。 各共表达菌株的生长与对照菌株(PP-L)没有显著差异,说明共表达质粒的整合没有影响菌株生长。

图1 共表达质粒构建流程图Fig.1 Construction of co-expression plasmid of chaperones
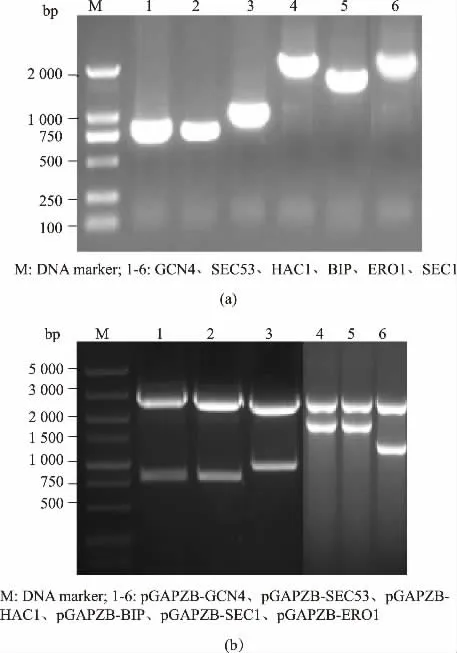
图2 GS115 来源的分子伴侣编码基因的克隆和重组共表达质粒的双酶切鉴定Fig. 2 Cloning of chaperones coding genes from GS115 and identification of recombinant plasmids for chaperones

图3 含分子伴侣菌株的生长曲线Fig. 3 Growth curves of strains with additional cassette of chaperones
筛选表达量提高最明显的各共表达菌株转化子作进一步的表达分析。 以表达菌株PP-L 作为对照,在相同的培养条件下培养各共表达菌株,发酵7 d 后离心取上清液,进行SDS-PAGE 分析,见图4。结果表明,各共表达菌株均成功表达漆酶,与对照菌株相比,表达量有不同程度的提高。取发酵7 d 的发酵液离心取上清液作为粗酶液,测定各菌株的漆酶酶活力,见图5。各共表达菌株的酶活力有不同程度的提高,PP-L-ERO1 除外。 尤其是PP-L-BIP 的酶活力为对照菌株的4.59 倍。

图4 各共表达菌株发酵上清液SDS-PAGE 电泳分析Fig. 4 SDS-PAGE analysis of additional overexperssion cassette of chaperones
为了考察不同模块的分子伴侣对外源蛋白质表达的影响,选取上述各模块中效果好的A 类菌株进行不同模块间的组合共表达,即对表2 中的6 种B 类菌株进行发酵。

图5 摇瓶发酵各共表达菌株的相对酶活Fig. 5 Effects of co-expression of chaperones on the laccase in shake flasks
如图6 所示,组合共表达菌株的产量基本都有不同程度的提高(6%~53%),部分组合共表达菌株较单个共表达菌株胞外酶活下降, 如P4、P2 下降26%。

图6 不同共表达基因组合优化对异源表达漆酶的影响Fig. 6 Optimization of different co-expression chaperones on heterologous protein production of laccase in P.pastoris
2.3 漆酶的纯化及酶学性质测定
按照1.2.7 所述方法对漆酶进行纯化, 在20%梯度洗脱时漆酶被洗脱出来。 SDS-PAGE 纯化条带单一,见图7。 用Bradford 测定蛋白质质量浓度,然后计算比酶活并测定最适温度、Km、kcat、温度稳定性(50、60、70 ℃),见表3。

图7 纯化的漆酶的SDS-PAGE 蛋白质电泳分析Fig. 7 SDS-PAGE of purified laccase
2.4 共表达分子伴侣影响漆酶蛋白活力机制解析
外源蛋白质的分泌表达需要多个环节调控,在内质网(ER)中蛋白质折叠成天然构象后被初步修饰, 转运到高尔基体中作进一步糖基化等修饰,经囊泡运输等环节最终分泌到胞外,错误折叠或未折叠的蛋白质则被降解。 传统提高酶活的方法大都集中在发酵条件的优化、启动子、信号肽、密码子优化等方法上。 作者首次通过过表达不同功能模块的分子伴侣来提高漆酶的产量,最终得到一株较出发菌株漆酶酶活力提高602%的菌株。 这是因为初生肽链结合在ER 中的BIP 分子伴侣后稳定性增强,折叠效率提高[20];大量未折叠或错误折叠蛋白质会使细胞产生未折叠蛋白质响应 (UPR),HAC1 通过过表达其控制的ERO1、SEC1 等分子伴侣以缓解代谢压力,调控UPR 信号[21],促进蛋白质折叠效率。 上述结果说明漆酶在P. pastoris中的折叠能力和未折叠蛋白质引起的胁迫压力是限制漆酶高效表达的关键因素。

表3 漆酶的动力学特征Table 3 Kinetic proerties of laccase
3 结 语
关于漆酶的异源表达已有大量研究报道,然而从细胞层面对菌株改造鲜有报道。 本研究第一次通过共表达分子伴侣提高漆酶在P. pastoris中的分泌表达。 结果显示, 过表达酵母中蛋白质折叠(BIP、ERO1)、 运输 (SEC53、SEC1)、 胁迫应激(HAC1、GCN4)通路中的相关分子伴侣,与PP-L(胞外活力为555 U/L) 相比, 胞外漆酶活力提高18%-359%(ERO1 除外),其中共表达BIP 酶活力提高了359%,250 mL 摇瓶发酵使得胞外酶活达2 547 U/L; 接着组合共表达不同模块中效果较好的共表达元件,漆酶产量进一步提高6%-53%,重组菌P1(同时共表达BIP 与HAC1) 较PP-L 胞外漆酶酶活力提高602%,250 mL 摇瓶发酵胞外酶活力最高达3 896 U/L。本研究首次通过过表达不同功能模块的分子伴侣来提高漆酶的产量,研究结果表明,这一措施有显著效果,这一举措对促进漆酶的产业化进程提供了新的思路。

