土壤氮素异质性分布和马先蒿寄生对长芒棒头草生长发育及根系分布的影响
田玉清 隋晓琳 张婷 李艳梅 李爱荣


摘 要:無论在农田还是自然生态系统中,土壤养分异质性普遍存在。植物具有感知土壤养分异质性的能力,并通过调节根系生物量分配及空间分布以获取更多资源。了解寄生胁迫在不同养分条件下对寄主生长发育及根系空间分布的影响,对解析寄主应对寄生胁迫和养分胁迫的适应策略,进而指导寄生性杂草防控具有重要的指导意义。该文采用分根试验,通过对寄主分根,并控制根室两侧氮供应水平及寄生胁迫程度,考察了氮胁迫及两种寄主依赖程度不同的马先蒿的寄生对寄主长芒棒头草生长发育及根系空间分布的影响。结果表明:(1)土壤氮水平与马先蒿寄生均可显著影响长芒棒头草生物量及根冠比,并且两者之间存在显著交互作用,其中土壤氮水平为主要影响因子。(2)两种马先蒿对长芒棒头草的危害程度不同。在NPK和2NPK 处理时,三色马先蒿的寄生显著降低长芒棒头草生物量(茎叶:37.1%、51.5%;根系:35.6%、63.6%);在NPK处理时,大王马先蒿的寄生显著增加长芒棒头草生物量(茎叶:29.9%,根系:61.2%)。(3)长芒棒头草的根系生长和空间分布受氮营养的异质分布和寄生的影响,具有明显的感知养分空间分布及调节根系生长能力。
关键词:土壤氮水平, 马先蒿, 根部半寄生植物, 根系空间分布, 分根盆栽试验
中图分类号:Q945
文献标识码:A
文章编号:1000-3142(2020)12-1838-11
Abstract:Soil nutrient heterogeneity is ubiquitous in both farmlands and natural ecosystems.Plants have the ability to perceive soil nutrient heterogeneity and adjust biomass allocation to optimize root spatial distribution so as to obtain more resources.As an important nutrient stress, the effects of a root hemiparasite on spatial distribution of its host roots remain untested.Understanding parasitism effects on host growth and root distribution under different nutrient conditions is of great significance for a better knowledge of host adaptation strategies, which will contribute to parasitic weed management.A split-root pot cultivation experiment was conducted to investigate the effects of nitrogen supply levels and parasitism by two root hemiparasitic Pedicularis species on host (Polypogon monspeliensis) growth and biomass allocation to each side of the split roots.The results were as follows:(1) Nitrogen levels and parasitism by Pedicularis species had significant effects on host biomass and root allocation patterns.Significant interaction effects were detected between nitrogen levels and parasitism, with nitrogen levels contributing more to the observed variances.(2) P.tricolor and P.rex showed different effects on host biomass.P.tricolor reduced host shoot biomass by 37.1% and 51.5%, and root biomass by 35.6% and 63.6%, respectively, when supplied with NPK and 2NPK solutions.However, P.rex significantly increased host shoot biomass by 29.9% and root biomass by 61.2% in NPK treatment and had little effect in 2NPK treatments.(3) Polypogon monspeliensis roots had obvious perception of nitrogen heterogeneity and parasitism by the root hemiparasites, as shown by foraging behavior for nitrogen and a tendency to avoid Pedicularis roots in treatments with equally low N levels.
Key words:soil nitrogen levels, Pedicularis, root hemiparasitic plants, root spatial distribution, split-root pot cultivation
无论在农田还是自然生态系统中,由于受多种生物和非生物过程的影响,养分和水分等在土壤中常呈不均衡分布,导致土壤环境具有明显的异质性(Jackson & Caldwell, 1993)。植物具有感知土壤环境异质性,并相应调节植株养分和生物量分配以获取更多资源的能力 (Benning & Seastedt, 1997; Zhang & Forde 1998; Li et al., 2012b)。如植物可以将更多的根系分布到養分富集区域,以提高养分吸收效率(Wijesinghe et al., 2001; Day et al., 2003; 李洪波,2014)。此外,植物之间的种内竞争、种间竞争以及食草动物的取食等均会影响植物根系空间分布与生长状态( 王炜等,2000;邵玉琴等,2006; Schiffers et al., 2011)。了解植株生物量分配和根系空间分布变化对生物和非生物胁迫的响应,对认识植物应对不同胁迫因子的响应策略,进而探讨物种间的相互作用和生物多样性的维持机制至关重要。
根部半寄生植物(root hemiparasitic plants)是寄生植物中的一大类群,它们具有一定的光合能力,但通常根系发育不健全,从土壤中获取养分的能力较差,需要通过吸器(haustorium)从寄主根部获取养分和水分等供自身生长与繁殖(Press, 1989; Stewart & Press, 1990; Shamoun, 2009)。根部半寄生植物大量掠夺寄主养分和水分,常显著降低寄主生物量和品质(Press, 1989; Parker & Riches, 1993)。因此,很多根部半寄生植物已成为农田或草地生态系统中的恶性杂草,给农业和畜牧业生产造成严重损失(Press, 1989; Parker & Riches, 1993)。如独脚金属(Striga Lour.)植物可以寄生于高粱、玉米等农作物,导致寄主产量下降6%~21%(Frost et al., 1997),甚至绝收(Hearne, 2009 ; Smaling et al., 1991),给非洲农业生产造成巨大损失。在我国,马先蒿属(Pedicularis L.)根部半寄生植物在亚高山草甸广泛分布,对禾草类寄主生长的抑制作用尤为明显,大面积蔓延的种类会严重危害当地畜牧业发展(王文香等,2009;隋晓琳,2013)。
由于根部半寄生植物分布广泛且寄主范围较广,是多数生态系统中常见的一种生物胁迫因素(Press 1989; Parker & Riches, 1993)。之前对根部半寄生植物与寄主植物互作的研究多关注地上部分的寄生危害,对寄主植物如何调节根系空间分布来应对根部半寄生植物的寄生胁迫研究较少。有报道表明,在遭遇根部半寄生植物的寄生胁迫时,寄主对根系的投资比例有明显变化(Li et al., 2012a),但因先前研究中寄主根系被侵染和未被侵染的区域对马先蒿的反应还未知,寄主被寄生后对根系投资比例的变化是一种主动适应过程还是被动胁迫结果仍是未解之谜。
对于大部分草地生态系统来说,氮素是限制其生产力的重要营养元素之一,同时也是调节草地生态系统结构和功能的一种关键性元素(Liu et al., 2017)。土壤氮素水平可显著影响根部半寄生植物与禾草类寄主间的互作关系。如Aflakpui et al.(2002)发现独脚金(Striga hermonthica)在土壤氮素水平较低时对玉米的危害更严重。Gibson & Watkinson(1991)发现在土壤氮素水平较低时,小佛甲草(Rhinanthus minor)对寄主的危害更大;而在土壤氮素水平较高时,其对寄主生物量的抑制程度相对降低。近期的研究显示,提高草地生态系统氮素水平,不仅可以促进禾本科植物的生长,而且可以抑制根部半寄生植物甘肃马先蒿的生长(Liu et al., 2017)。然而,氮素水平的变化如何通过影响根部半寄生植物和寄主植物地下部分的互作而使寄生杂草的危害得以缓解还尚未可知。
鉴于寄生植物对寄主植物养分资源的掠夺性以及植物根系对养分的趋向性,我们推测,寄主植物在遭遇寄生危害时,会主动调节根系生长,增加对未被寄生部分的根系投资,以提高根系整体的养分吸收效率。在养分水平较高的条件下,增加的根系投资可获取更多养分,这在一定程度上补偿了寄生造成的养分损失;而在养分贫瘠条件下,这种补偿效应不明显。由于土壤养分的异质性分布特征,在有根部半寄生植物存在时,寄主根系常同时遭遇局部养分胁迫和寄生胁迫的双重压力。明确寄主植物根系在寄生胁迫下且养分异质分布的土壤环境中如何调节根系空间分布以及土壤养分变化对该行为的影响,对于了解寄主响应养分空间异质分布和寄生胁迫的适应策略,进而解析施肥对根部半寄生植物寄生危害的缓解效应十分必要。
本研究选择滇西北亚高山草甸中两种对禾草类寄主危害程度不同的马先蒿,及其生境中常见、受马先蒿寄生危害明显的一种禾草类寄主,采用分室分根盆栽试验,将寄主植物被寄生部分的根系与未被寄生部分的根系区分开来,一半寄主根系在养分匮乏的基质(不添加营养液)中生长,另一半根系在有养分供应(添加营养液)的基质中生长,探讨土壤养分不均衡分配对其根系空间分配的影响。同时,在有养分供应的一侧种植根部半寄生植物,探讨两种对寄主胁迫程度不同的根部半寄生植物分别寄生于寄主时,在不同土壤养分水平下对寄主根冠比和根系空间分布的影响。在马先蒿广泛分布的亚高山草甸中放牧活动比较频繁,畜牧扰动和排放粪便导致土壤养分空间异质分布更为明显。因此,本研究探讨养分异质分布环境下马先蒿寄生对寄主生长发育及根系空间分布的影响,将有助于从寄主根系空间分布变化了解养分对马先蒿与禾草类寄主互作过程的调控作用,进而为有针对性地利用养分调节防控马先蒿属根部半寄生杂草提供理论指导。
1 材料与方法
1.1 材料
选用两种根部半寄生植物,大王马先蒿(Pedicularis rex)和三色马先蒿(P.tricolor)开展试验。其中,大王马先蒿对寄主依赖程度较低,对寄主生长的抑制程度较轻,而三色马先蒿对寄主依赖程度较高,对寄主生长的危害较重(Li et al., 2012a)。此外,两种马先蒿对养分需求也有所不同,前者对氮需求较高,后者对磷需求较高(Li et al., 2013b)。寄主植物则选择两种马先蒿生境中的常見伴生植物长芒棒头草(Polypogon monspeliensis)。
两种马先蒿的种子于2016年9月6日采自云南省迪庆州香格里拉高山植物园(99°38′E, 27°54′ N , 海拔3 370 m);寄主长芒棒头草种子于2008年4月17日采自昆明植物园(102°44′ E, 25°08′ N, 海拔1 990 m);所有种子自然晾干后包于纸质信封中于4 ℃冰箱保存。
栽培基质使用沙土混合物,河沙和红土体积比按9∶1充分混匀装袋,于高压灭菌锅(温度:121 ℃)中灭菌处理4 h,灭菌处理第二天再高温(121 ℃)干燥处理4 h,自然冷却后待用。栽培基质同Sui et al.(2019),有效氮、磷、钾分别为14.3、2.7和62.4 mg·kg-1 干土重。
1.2 试验设计
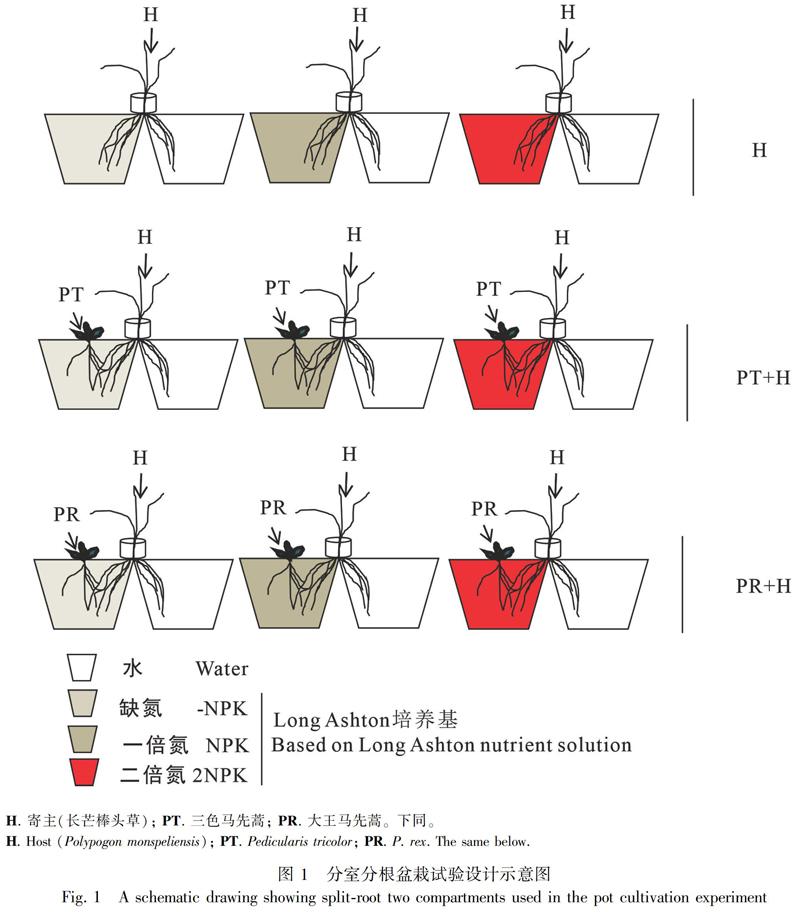
分室分根装置参考Li et al.(2013a)的设计,有所改进。用透明胶带将两个方形塑料盆(上底宽10 cm, 下底宽7 cm, 高8.5 cm)粘在一起,然后将分根管套置于两盆之间;在分根管内种植寄主植物(长芒棒头草),在套盆一侧不种马先蒿的作为对照组处理(H),或者分别种植大王马先蒿(PR+H)和三色马先蒿(PT+H),共计三种组合。为设置异质的土壤养分环境,只在套盆一侧添加营养液。寄生处理中,马先蒿被种在添加营养液的一侧,以考察土壤养分变化下长芒棒头草对马先蒿寄生胁迫的响应(图1)。
基于前期研究结果,氮素供应水平对长芒棒头草生长发育影响明显,因此本试验在添加营养液的一侧设置3个氮素施用水平,即未施加外源氮(缺氮,-NPK)和分别浇施一倍氮(NPK)或两倍氮(2NPK)的Long Ashton营养液,以考察氮供应变化对长芒棒头草根系空间分布调节的影响。养分配比参考Li et al.(2013a),“NPK” 为Long Ashton标准营养液[2 mmol·L-1 K2SO4, 1.5 mmol·L-1 MgSO4·7H2O, 4 mmol·L-1 CaCl2, 0.1 mmol·L-1 FeEDTA, 4 mmol·L-1 (NH4)2SO4, 8 mmol·L-1 NaNO3, 1.33 mmol·L-1 Na2HPO4, 1.81 mg·L-1 MnCl2·4H2O, 0.5 mg·L-1 ZnSO4·7H2O, 0.08 mg·L-1 CuSO4·5H2O, 0.025 mg·L-1 NaMoO4·2H2O, 2.86 mg·L-1 H3BO3],“-NPK”表示去氮处理,“2NPK”表示氮加倍处理。共设9个处理,每处理5个重复。
1.3 马先蒿和寄主种子萌发
先将两种马先蒿种子在75%的酒精中浸泡并摇床震荡处理(120 r·min-1, 25 ℃)5 min,RO(Reverse Osmosis)水反复冲洗至无味,再用5%次氯酸钠溶液消毒并摇床震荡处理(120 r·min-1, 25 ℃)10 min,最后用RO水反复冲洗至无味后平铺于三层湿润滤纸上并置于4 ℃冰箱冷层积1周后放入恒温培养箱(18 ℃/25 ℃, 高温时12 h光照)进行萌发。长芒棒头草种子经相同消毒处理后直接放入恒温培养箱(18 ℃/25 ℃, 高温时12 h光照)进行萌发。
1.4 寄主分根幼苗培育
待长芒棒头草胚根长约2 cm时移栽至以石英砂为基质的一次性育苗盆中,每盆20株幼苗。寄主幼苗育苗期每周添加20 mL Long Ashton标准营养液(NPK)以满足幼苗生长所需。每日浇水3次保证基质水分充足。每隔两天调换育苗盆位置,排除位置效应对幼苗长势的影响。在室温条件下培养30 d后进行分根移栽。
1.5 幼苗移栽及栽培条件
待寄主幼苗根系长出8~10条侧根时(育苗时间约30 d),小心取出并移栽到分根装置中(侧根被随机均匀分至两侧),在套盆一侧距分根管约2 cm处移栽3株马先蒿。马先蒿移栽时胚根长约2 cm,移栽后进行为期1周的遮荫处理以提高存活率;1周后间苗,每盆保留一棵长势一致的马先蒿。每周在套盆种有马先蒿的一侧添加两次营养液(-NPK、NPK、2NPK),每次15 mL,同时在套盆的另一侧添加等量的自来水,分根管中添加2.5 mL自来水。试验期间栽培基质水分保持在基质干重的10%左右。避免在添加营养液的当天浇水,以防止养分快速流失。每次添加营养液后随机打乱套盆位置,排除位置效应。栽培试验于2017年10月27日至2018年2月1日在昆明植物研究所玻璃精控温室进行。试验期间最低温为8.9 ℃,最高温为38.3 ℃,空气相对湿度在21.3%~99.3%之间。
1.6 材料处理与数据分析
栽培过程中两种马先蒿前期长势较好,后期长势差且逐渐死亡。其中,三色马先蒿在移栽第4周左右与寄主建立寄生关系,至第7周全部枯死(寄生时间约3周,死亡时生物量<0.001 8 g);大王马先蒿在移栽第4周左右与寄主建立寄生关系,第10周全部枯死(寄生时间约6周,死亡时生物量<0.002 3 g)。移栽14周后收获寄主植物。收获时将地上部分和根系分开,其中套盆两侧寄主根系分别收获并做记录。将地上和地下部分于85 ℃干燥48 h烘干称重。总根重为套盆两侧根系生物量之和。
使用SPSS 20.0对数据进行处理分析,用单因素方差分析法(One-way ANOVA)考察养分梯度对各部分生物量及根冠比的影响,用双因素方差分析法(Two-way ANOVA)考察养分梯度与马先蒿寄生对寄主生物量及根冠比的影响,利用t检验分析各栽培处理中分室两侧根系生物量的差异显著性(P<0.05)。在进行单因素方差分析时对寄主两侧根系生物量分别进行了对数或平方根转化,以满足数据方差齐性和服从正态分布的检验假设。利用SPSS 20.0 和画图软件(Adobe Illustrator)绘制和调整图像。
2 结果与分析
2.1 土壤氮水平及马先蒿寄生对长芒棒头草生物量和根冠比的影响
双因素方差分析结果显示,养分梯度与马先蒿寄生对长芒棒头草生物量和根冠比均存在显著的交互影响,且养分梯度变化对长芒棒头草地上部生物量、地下部生物量和根冠比的离差平方和(S养分梯度)分别为7.278、2.919和1.455,寄生对其所导致的离差平方和(S寄生)分别为1.030、0.826和0.195,均表现为S养分梯度>S寄生(表1)。
2.1.1 寄主(长芒棒头草)生物量 养分添加对未被寄生的长芒棒头草地上和地下生物量显著影响,且随着基质中氮素水平的增加,长芒棒头草地上和地下部分生物量均显著增加(图2:A)。在不同养分条件下,两种马先蒿寄生对长芒棒头草的影响表现出明显的种间差异。未施加外源氮(缺氮,-NPK)处理下,三色马先蒿寄生对长芒棒头草地上部分生物量影响不明显,但有增加趋势,达22.7%;而大王马先蒿寄生时,长芒棒头草地上生物量只有0.046 g,较未被寄生时显著降低了25.2%;两种马先蒿寄生均显著降低长芒棒头草地下生物量(PT:65.5%和PR:57.1%)。在NPK处理中,三色马先蒿寄生时,长芒棒头草地上和地下生物量分别为0.657 g和0.494 g,较未被寄生时显著降低了37.1%和35.6%;而大王马先蒿寄生却使其地上和地下生物量分别达1.358 g和1.237 g,较未被寄生时显著增加了29.9%和61.2%。2NPK处理下,被三色马先蒿寄生的长芒棒头草地上和地下生物量分别为0.784 g和0.325 g,较未被寄生时显著降低了51.5%和63.5%;被大王马先蒿寄生的长芒棒头草地上、地下生物量分别为1.391 g和0.81 g,较未被寄生时降低13.9%和9%,但未达到显著水平。
2.1.2 寄主(长芒棒头草)根冠比 随着土壤氮素水平的增加,未被寄生的长芒棒头草根冠比显著降低(图2:B)。马先蒿寄生对长芒棒头草根冠比的影响因寄生植物种类和养分变化的不同而异。在未施加外源氮(缺氮,-NPK)处理下,三色马先蒿寄生时长芒棒头草根冠比为0.784,较未被寄生时显著降低了42%;而大王马先蒿寄生时长芒棒头草根冠比为1.12,较未被寄生时仅降低了17.2%,未达统计学显著水平。NPK处理下,三色马先蒿和大王马先蒿分别寄生使长芒棒头草根冠比达0.761和0.873,较未被寄生时增加了3%和 18.5%,均未达统计学显著水平。2NPK处理下,被三色马先蒿寄生的长芒棒头草根冠比为0.49,较未被寄生时仅降低了6.7%;而大王马先蒿寄生时根冠比为0.534,较未被寄生时仅增加了1.6%,均未达统计学显著水平(图2:B)。
2.2 分室两侧寄主根系生物量分配对养分供应及马先蒿寄生的响应
双因素方差分析结果表明,马先蒿寄生与养分供应状况对套盆两侧长芒棒头草根系生物量存在显著交互影响(表2)。套盆未添加养分一侧养分梯度贡献的离差平方和(S养分梯度)为 0.336,寄生贡献的离差平方和(S寄生)为0.125,在套盆添加养分一侧S养分梯度为1.516,S寄生为0.261,套盆两侧均显示出S养分梯度>S寄生。说明影响分室两侧根系生物量的主要因素为养分梯度。
T-test结果显示,在未施加外源氮(缺氮,-NPK)处理下,三色马先蒿寄生时,套盆两侧长芒棒头草的根系生物量在未添加养分一侧和添加养分一侧分别为0.027 g和0.048 g,较未被寄生时分别增加了33%和2.2%;大王马先蒿寄生时套盆两侧的长芒棒头草根系生物量在未添加养分一侧为0.021 g,较未被寄生时仅增加了3%,在添加养分一侧为0.030 g,较未被寄生时却降低了30%,但均未达统计学显著水平。在NPK处理下,三色馬先蒿寄生时套盆两侧长芒棒头草根系生物量在未添加养分一侧和添加养分一侧分别达0.146 g和0.348 g,较未被寄生时显著降低45%和31%;大王马先蒿寄生时套盆两侧根系生物量在未添加养分一侧和添加养分一侧分别达0.431 g和0.845 g,较未被寄生时显著增加了63%和70%。在2NPK处理下,三色马先蒿寄生时套盆两侧长芒棒头草根系生物量在添加养分一侧和添加养分一侧分别为0.104 g和0.325 g,较未被寄生时显著降低了60%和53%;大王马先蒿寄生时套盆两侧根系生物量在未添加养分一侧为0.324 g,较未被寄生时增加了24%,在添加养分一侧为0.538 g,较未被寄生时降低了23%,但均未达到统计学显著水平(图3,表3)。不同养分梯度处理下各栽培组合(H、PT+H和PR+H)中长芒棒头草根系在添加养分一侧的生物量高于未添加养分一侧的生物量(图3)。未施加外源氮(缺氮,-NPK)处理下,H、PT+H和PR+H组合中在套盆中添加养分一侧的长芒棒头草根系生物量分别达0.046、0.048和0.030 g,较未添加养分的一侧分别增加了132%、78.6%和46.4%。
NPK处理下,H、PT+H和PR+H组合中在套盆中添加养分一侧的根系生物量分别达0.503、0.348和0.845 g,较未添加养分的一侧分别增加了90.7%、139%和96.1%。2NPK处理下,H、PT+H和PR+H组合中在套盆中添加养分一侧的根系生物量分别达0.695、0.325和0.538 g,较未添加养分的一侧分别增加了165%、211%和66.2%(图3)。
3 讨论
本研究利用分室分根盆栽试验,探讨了寄主植物长芒棒头草根系空间分布对土壤养分不均衡分布及马先蒿寄生胁迫的响应,并分析了养分供应变化对这一响应的调节作用和对寄主生长的影响。寄主植物根系的生长和空间分布同时受养分空间分布和根部半寄生植物胁迫程度的影响,是寄主整合养分胁迫和寄生胁迫信息后主动调节根系生长和分配的结果。
三种养分梯度下添加养分一侧长芒棒头草根系生物量比未添加养分一侧大,说明其根系趋向于养分较丰富区域生长。这与前人的研究结果一致,即根系更趋向于养分富集区域分布,以此来增加养分吸收面积进而吸取更多养分供其生长(Farley & Fitter 1999; Li et al., 2012b)。在未被马先蒿寄生时,氮素水平增加使得添加营养液一侧长芒棒头草根系生物量显著增加,并明显增加养分贫瘠一侧的根系生物量;进一步提升氮素水平虽然仍能明显提高添加营养液一侧的长芒棒头草根系生物量,但养分贫瘠一侧的根系生物量并未得到显著提高。这说明长芒棒头草根系具有主动的养分水平识别和根系生长调控能力,以减少低效率投资、避免资源浪费。
两种马先蒿对寄主植物生长的影响存在显著差异。本研究中虽然三色马先蒿寄生时间较短(仅3周),但其在NPK和2NPK处理下对长芒棒头草生物量的抑制程度均大于寄生时间较长(约6周)的大王马先蒿,这与Li et al.(2012a)研究结果一致,即前者较后者对寄主的依赖程度更强、造成的危害更大。未施加外源氮(缺氮,-NPK)处理下,三色马先蒿和大王马先蒿寄生导致长芒棒头草向有马先蒿一侧的根系分配比例降低,提示当两侧根室均缺乏氮素时,长芒棒头草根系有躲避马先蒿寄生胁迫的倾向。然而,随着氮素供应水平的提高,即便添加营养液一侧存在马先蒿寄生胁迫,长芒棒头草也将更多的根系分配给了这一侧。这可能是因为相对于养分贫瘠土壤的胁迫而言,在养分较为丰富的土壤环境下,寄生胁迫所造成的压力相对较小。尽管没有在保持两侧根室土壤养分完全均等的条件下探讨长芒棒头草根系分布对马先蒿寄生胁迫的躲避行为,但根据其在缺氮处理中的表现及其他养分条件下被不同马先蒿寄生时的根系生长反应差异来看,长芒棒头草根系生长对寄生胁迫会表现出主动响应行为。
在未施加外源氮(缺氮,-NPK)处理下,大王马先蒿寄生显著抑制长芒棒头草地上部分和根系的生物量,但在NPK处理时,却显著增加了地上及根系生物量。大王马先蒿的氮素需求较高且较发达的根系可与寄主竞争养分(Li et al., 2013b),对同样氮素需求较高的长芒棒头草而言,在缺氮和寄生双重胁迫条件下其生长受到了明显的抑制。研究结果显示,在土壤养分匮乏时,植物会通过加大对根系的投资来获取更多的养分资源(Fransen et al., 1999; Craine 2006; Schenk, 2006)。在适当氮素供应条件下,大王马先蒿对氮素的竞争导致栽培基质中氮素含量降低,从而促进了长芒棒头草根系生长,再加上后期马先蒿的死亡又在一定程度上缓解了其所受的寄生压力,这可能是NPK处理下被大王马先蒿寄生的长芒棒头草生物量超过了未被寄生植株的重要原因。Cechin & Press(1993, 1994)认为合适的氮素供应可以降低寄生植物的寄生对寄主生物量的抑制甚至可以消除寄生效应。一般情况下,适量供应氮素可促进根系形态和质量的增加(Forde & Lorenzo, 2001),但过量的氮素供应会抑制根系生长(董桂春等,2001)。这也解释了在NPK基础上增加氮素供应反而降低了根系生物量的现象。
本研究中虽然两种马先蒿寄生的时间较短(三色马先蒿寄生3周,大王马先蒿寄生6周),但对长芒棒头草生物量和根系发育的影响仍十分显著。说明即便是短暂的寄生胁迫,也可对寄主植物生长造成严重危害。前人的研究显示,根部半寄生植物可以通过吸器大量掠夺寄主植物资源、影响寄主植物光合能力、抑制寄主植物生长,对农业和畜牧业造成严重危害(Parker & Riches 1993; Shamoun, 2009; 隋晓琳,2013)。Suetsugu et al.(2012)与Bao et al.(2015)通过剔除根部半寄生植物证明了根部半寄生植物对禾草类和豆类优良寄主生长的抑制性。然而,这些试验都未曾关注寄生植物幼苗对寄主植物生长的影响。由于一些根部半寄生植物种类种子产量大且存在一定程度的生理休眠和种子库效應(柳妍妍等,2011;隋晓琳等,2013),因此,在野外生境中的整个植物生长季节内均有大量幼苗存在。由于幼苗个体不大、不易于观察,其对生态系统的影响往往容易被忽视。本研究中,虽然大王马先蒿和三色马先蒿的寄生时间短且尚处于幼苗阶段,但其对长芒棒头草生长的影响依然存在。因此,在针对根部半寄生杂草防治过程中也要注意寄生植物幼苗的危害。
4 结论
(1)土壤氮水平与马先蒿寄生均可显著影响长芒棒头草生物量及根冠比,且两者存在显著交互作用,其中土壤氮水平为主要影响因子。无论是否被马先蒿寄生,提高土壤氮水平都会增加长芒棒头草生物量,并有降低根冠比的趋势。
(2)两种马先蒿短期寄生即可对长芒棒头草造成明显危害,但危害程度不同,且受土壤氮素水平调节的规律存在明显种间差异。三色马先蒿寄生在NPK和2NPK处理时显著降低其生物量(茎叶:37.1%,51.5%;根系:35.6%,63.6%);而大王马先蒿寄生在NPK处理时显著增加其生物量(茎叶:29.9%,根系:61.2%)。
(3)长芒棒头草可感应土壤氮素胁迫及马先蒿寄生胁迫并相应调节根系空间分布。无论是否存在马先蒿寄生胁迫,长芒棒头草根系总是倾向于土壤氮水平较高的一侧分布。在根室两侧均受氮素胁迫条件下,长芒棒头草遭遇大王马先蒿或三色马先蒿寄生危害时,有向未被寄生根室增加根系生物量投资比例的倾向;但当被寄生一侧的根室土壤氮水平较高时,长芒棒头草根系躲避马先蒿寄生的行为不明显。长芒棒头草根系空间分布变化对其适应土壤养分异质环境及马先蒿寄生胁迫具有重要意义。
参考文献:
AFLAKPUI GKS, GREGORY PJ, FROUD WILLIAMS RJ, 2002.Growth and biomass partitioning of maize during vegetative growth in response to Striga hermonthica infection and nitrogen supply[J].Exp Agric, 38:265-276.
BAO GS, SUETSUGU K, WANG XY, et al., 2015.Effects of the hemiparasitic plant Pedicularis kansuensis on plant community structure in a degraded grassland[J].Ecol Res, 30:507-515.
BENNING TL, SEASTEDT TR, 1997.Effects of fire, mowing and nitrogen addition on root characteristics in tall-grass prairie[J].J Veg Sci, 8:541-546.
CECHIN I, PRESS MC, 1993.Nitrogen relations of the sorghum Striga hermonthica host parasite association germination, attachment and early growth[J].New Phytol, 124:681-687.
CECHIN I, PRESS MC, 1994.Influence of nitrogen on growth and photosynthesis of a C-3 cereal,Oryza sativa, infected with the root hemiparasite Striga hermonthica[J].J Exp Bot, 45:925-930.
CRAINE JM, 2006.Competition for nutrients and optimal root allocation[J].Plant Soil, 285:171-185.
DAY KJ, JOHN EA, HUTCHINGS MJ, 2003.The effects of spatially heterogeneous nutrient supply on yield, intensity of competition and root placement patterns in Briza media and Festuca ovina[J].Funct Ecol, 17:454-463.
DONG GC,WANG YL, WU H, et al., 2001.Effect of nitrogen supplying levels on the development of roots in rice(Oryza satival)[J].Jiangsu Agric Res, (4):9-13.[董桂春,王余龍,吴华,等,2001.供N浓度对水稻根系生长的影响[J].江苏农业研究,(4):9-13.]
FARLEY RA, FITTER AH, 1999.Temporal and spatial variation in soil resources in a deciduous woodland[J].J Ecol, 87:688-696.
FORDE B, LORENZO H, 2001.The nutritional control of root development[J].Plant Soil, 232:51-68.
FRANSEN B, BLIJJENBERG J, DEKROON H, 1999.Root morphological and physiological mplasticity of perennial grass species and the exploitation of spatial and temporal heterogeneous nutrient patches[J].Plant Soil, 211:179-189.
FROST DL, GURNEY AL, PRESS MC, et al., 1997.Striga hermonthica reduces photosynthesis in sorghum:The importance of stomatal limitations and a potential role for ABA?[J].Plant Cell Environ, 20:483-492.
GIBSON CC, WATKINSON AR, 1991.Host selectivity and the mediation of competition by the root hemiparasite Rhinanthus minor[J].Oecologia, 86:81-87.
HEARNE SJ, 2009.Control the Striga conundrum[J].Pest Manag Sci, 65:603-614.
JACKSON RB, CALDWELL MM, 1993.The scale of nutrient heterogeneity around individual plants and its quantification with geostatistics[J].Ecology, 74:612-614.
LI AR, GUAN KY, STONOR R, et al., 2013a.Direct and indirect influences of arbuscular mycorrhizal fungi on phosphorus uptake by two root hemiparasitic Pedicularis species:Do the fungal partners matter at low colonization levels?[J].Ann Bot, 112:1089-1098.
LI AR, LI YJ, SMITH SE, et al., 2013b.Nutrient requirements differ in two Pedicularis species in the absence of a host plant:Implication for driving forces in the evolution of host preference of root hemiparasitic plants[J].Ann Bot, 112:1099-1106.
LI AR, SMITH FA, SMITH SE, et al., 2012a.Two sympatric root hemiparasitic Pedicularis species differ in host dependency and selectivity under phosphorus limitation[J].Funct Plant Biol, 39:784-794.
LI HB, ZHANG FS, SHEN JB, 2012b.Contribution of root proliferation in nutrient-rich soil patches to nutrient uptake and growth of maize[J].Pedosphere, 22:776-784.
LI HB, 2014.The dynamic process of plant responses to heterogeneous nutrient environments and the strategies of root management[D].Beijing:China Agricultural University.[李洪波, 2014.植物響应养分空间异质性分布的动态过程及调控根系获取养分的策略研究[D].北京:中国农业大学.]
LIU YY, HU YK, WANG X, et al., 2011.Studies on characteristics of soil seed bank of Pedicularis verticilata community[J].J Nat Res, 26(1):48-57.[柳妍妍,胡玉昆,王鑫,等,2011.轮叶马先蒿群落土壤种子库特征研究[J].自然资源学报,26(1):48-57.]
LIU YY, TAXIPULATI T, GONG YM, et al., 2017.N-P fertilization inhibits growth of root hemiparasite Pedicularis kansuensis in natural grassland[J].Front Plant Sci, 8:2088.
PARKER C, RICHES CR, 1993.Parasitic weeds of the world:Biology and control[M].Wallingford:CAB International:1-332.
PRESS MC, 1989.Autotrophy and heterotrophy in root hemiparasites[J].Trends Ecol Evol, 4:258-263.
PRESS MC, PHOENIX GK, 2005.Impacts of parasitic plants on natural communities[J].New Phytol, 166:737-751.
SCHENK HJ, 2006.Root competition:Beyond resource depletion[J].J Ecol, 94:725-739.
SCHIFFERS K, TIELBORGER K, TIETJEN B, et al., 2011.Root plasticity buffers competition among plants:Theory meets experimental data[J].Ecology, 92:610-620.
SHAMOUN SF, 2009.Introduction to stem and shoot fungal pathogens and parasitic plants:the values of biological diversity introduction[J].Botany, 87:5-6.
SHAO YQ, ZHAO J, LIU ZL, et al., 2006.Effects of mowing frequency on soil microbial quantity and plant underground biomass in Leymus chinensis steppe[J].Chin J Ecol, (10):1191-1195.[邵玉琴,赵吉,刘钟龄,等,2006.割草频率对土壤微生物数量和植物地下生物量的影响[J].生态学杂志,(10):1191-1195.]
SMALING EMA, STEIN A, SLOOT PHM, 1991.A statistical analysis of the influence of Striga hermonthica on maize yields in fertilizer trials in southwestern Kenya[J].Plant Soil, 138:1-8.
STEWART GR, PRESS MC, 1990.The physiology and biochemistry of parasitic angiosperms[J].Ann Rev Plant Physiol Plant Mol Biol, 41:127-151.
SUETSUGU K, TAKEUCHI Y, FUTAI K, et al., 2012.Host selectivity, haustorial anatomy and impact of the invasive parasite Parentucellia viscosa on Floodplain vegetative communities in Japan[J].Bot J Linn Soc, 170:69-78.
SUI XL, 2013.Eco-physiological mechanism for the spatial expansion of Pedicularis kansuensis in Bayanbulak grassland of Xinjiang[D].Beijing:University of Chinese Academy Science.[隋晓琳, 2013.甘肃马先蒿在新疆巴音布鲁克草原蔓延的生理生态学机理[D].北京:中国科学院大学.]
SUI XL, LI AR, GUAN KY, 2013.Impacts of climatic changes as well as seed germination characteristics on the population expansion of Pedicularis verticillata [J].Ecol Environ Sci, 22(7):1099-1104.[隋晓琳,李爱荣,管开云,2013.气候变化和种子萌发特性对轮叶马先蒿种群扩张的影响[J].生态环境学报,22(7):1099-1104.]
SUI XL, ZHANG T, TIAN YQ, et al., 2019.A neglected alliance in battles against parasitic plants:Arbuscular mycorrhizal and rhizobial symbioses alleviate damage to a legume host by root hemiparasitic Pedicularis species[J].New Phytol, 221:470-481.
WANG W, LIANG CZ, LIU ZL, et al., 2000.Analysis of the plant individual behavior during the degradation and restoring succession in steppe community[J].Chin J Plant Ecol, 24(3):268-274.[王煒,梁存柱,刘钟龄,等,2000.草原群落退化与恢复演替中的植物个体行为分析[J].植物生态学报,24(3):268-274.]
WANG WX, SANG GJ, LI L, 2009.Study on the control techniques of poisons grass Pedicularis in Xinjiang Bayanbulak prairie[J].Grass-Feeding Livestock, (2):49-50.[王文香,桑格吉,李莉,2009.新疆巴音布鲁克草原毒害草马先蒿防治技术研究[J].草食家畜,(2):49-50.]
WIJESINGHE DK, JOHN EA, BEURSKENS S,et al., 2001.Root system size and precision in nutrient foraging:Responses to spatial pattern of nutrient supply in six herbaceous species[J].J Ecol, 89:972-983.
ZHANG HM, FORDE BG, 1998.An arabidopsis MADS box gene that controls nutrient induced changes in root architecture[J].Science, 279:407-409.
(责任编辑 何永艳)

