广西地区人群STAT4 rs10181656基因多态性与原发性抗中性粒细胞胞浆抗体相关性血管炎的关系
曹越琦 薛超 黎伟 黄莉 何佩耕
广西医科大学第二附属医院肾内科(南宁530007)
原发性抗中性粒细胞胞浆抗体相关性血管炎(anti-neutrophi cytoplasmic antibodies associated vasculitis,AAV)是以小血管壁炎症及纤维素样坏死为病理特点,寡免疫复合物沉积为特征的自身免疫性疾病[1]。目前我国尚缺乏对AAV 的大型流行病学研究,其临床表现多样,后期治疗花费大,及早诊断格外重要。AAV 发病机制复杂,研究表明可能与感染、遗传、环境等[2]多重因素相关,其中遗传因素可能是AAV 发病的关键因素。信号转导和转录激活因子-4(signal transducer and activator of transcription 4,STAT4)基因位于人类染色体2q32.35 上,其编码的转录因子负责传递多种细胞内信号[3],参与先天性和适应性免疫等复杂调控过程,介导炎症反应和组织细胞坏死[4]。已有研究报导,STAT4 基因多态性与RA、SSc、SLE 等[5-7]诸多自身免疫性疾病遗传易感性存在关系,但STAT4 基因多态性在AAV 中的遗传学意义不甚明确。基于上述,本研究初步探讨STAT4 rs10181656位点基因多态性与广西汉族人群AAV 及临床症状的关联性。
1 资料与方法
1.1 一般资料 本研究已获得广西医科大学伦理委员会的批准及全体纳入对象及家属的知情同意。纳入标准:经临床确诊为原发性AAV 的患者,并未累及全身大中动脉;诊断符合2012年第二届Chapel Hill 国际血管炎命名会议[8]的标准;相互间无血缘关系的汉族人群。排除标准:继发于药物等因素的小血管炎;合并其他自身免疫性疾病的患者;严重感染或合并脏器功能衰竭患者;合并肿瘤、糖尿病或精神疾病的患者;哺乳期及妊娠患者。参照上述标准,确定的病例组为122 例汉族原发性AAV 患者,均于2005年1月至2018年12月期间在广西医科大学第二附属医院确诊。对照组为性别、年龄相仿的同期体检中心的155 例健康体检人群。病例组和对照组的年龄、性别间差异无统计学意义(P>0.05)。
1.2 外周血DNA提取 每个纳入对象均抽取2 mL乙二胺四乙酸抗凝静脉全血,提取基因组DNA 采用快速DNA 提取试剂盒(北京天根生化公司)。
1.3 基因分型 上游引物:5′-TGGAATAGGGGC AGCTGTTT-3′,下游引物:5′- GCTGCCATGTCGAGAGTAAC-3′(上海生工生物技术有限公司)。PCR 扩增反应体系:上下游引物分别0.5 μL,全血DNA 模板1 μL,Dream TaqTMGreen PCR Master Mix(2×)(美国Fermentas 公司)10 μL,dd H2O 补足至13 μL。PCR 反应(美国ABI 公司):94 ℃5 min,94 ℃30 s,61 ℃45 s,72 ℃30 s,35 个循环后,72 ℃5 min,4 ℃结束。酶切体系20 μL 包括限制性内切酶Dde I 0.5 μL(美国NEB 公司),buffer R 2 μL,dd H2O 7.5 μL,扩增产物10 μL,混和摇匀后于37 ℃水浴。反应完成后电泳跑胶,利用凝胶成像仪(美国Bio-RAD 公司)行基因分型。选取不同基因型标本送上海生工生物技术公司测序验证。
1.4 统计学方法 采用SPSS 22.0 软件进行数据分析,Hardy-Wein berg 遗传平衡以P>0.05 表示群体具有代表性。计数资料比较采用χ2检验,Logistic 回归分析计算优势比(OR)及95%置信区间(95%CI)评估基因多态性与AAV 易感性及临床症状发生风险之间的关联,结果均以P<0.05 为差异有统计学意义。
2 结果
2.1 基因型测定 STAT4 rs10181656 位点PCR 产物长333 bP,限制性内切酶消化后,基因型CC 长度仍为333 bP,GG 被切分为长105 bP 和228 bP 的2 种片段,CG 被切分为长333、228、105 bP 的3 种片段。酶切结果见图1,测序结果见图2。
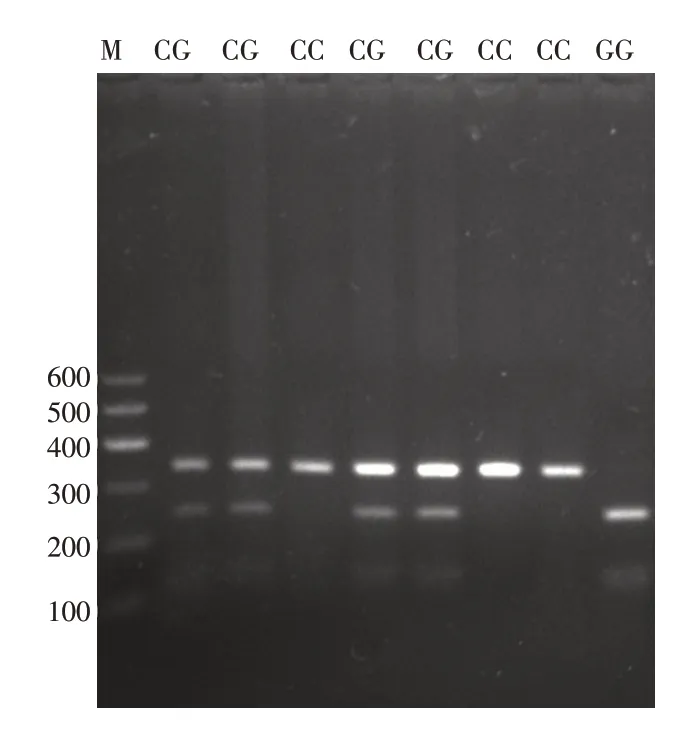
图1 STAT4 rs10181656 基因测定分型图Fig.1 Genotyping figure of rs10181656
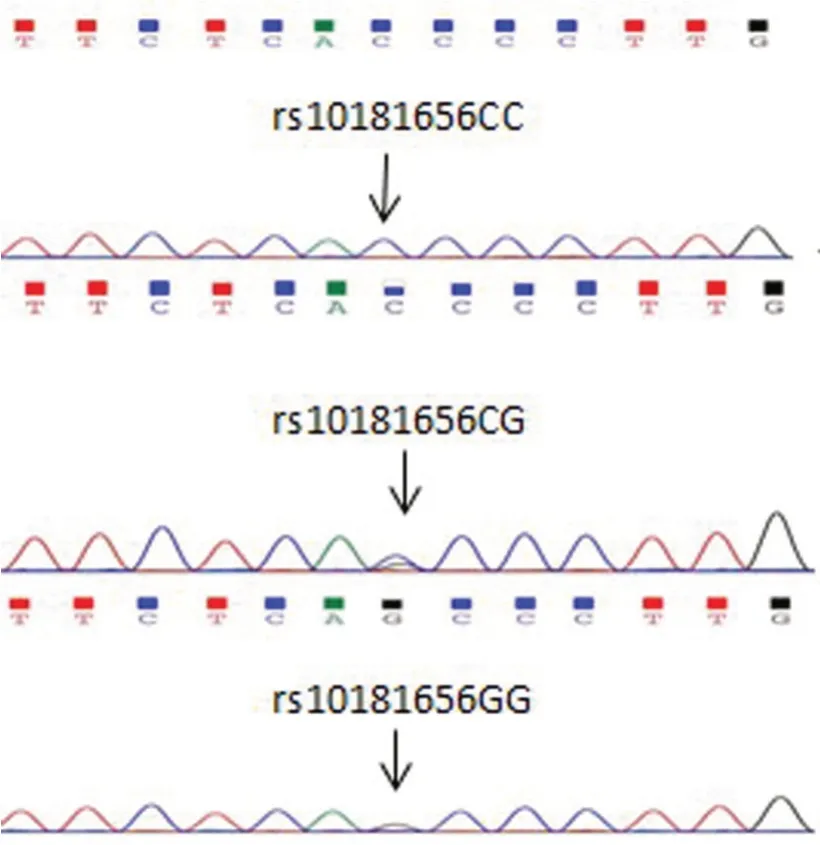
图2 rs10181656 测序图Fig.2 Sequencing figure of rs10181656
2.2 基因型及等位基因频率分析 STAT4 rs10181656的病例组(χ2=3.673,P=0.055)与对照组(χ2=1.943,P=0.163)均符合Hardy-Weinberg 平衡,比较病例组与对照组的基因型(χ2= 6.189,P=0.045)和等位基因频率(χ2=5.323,P=0.021),差异均具统计学意义。见表1。
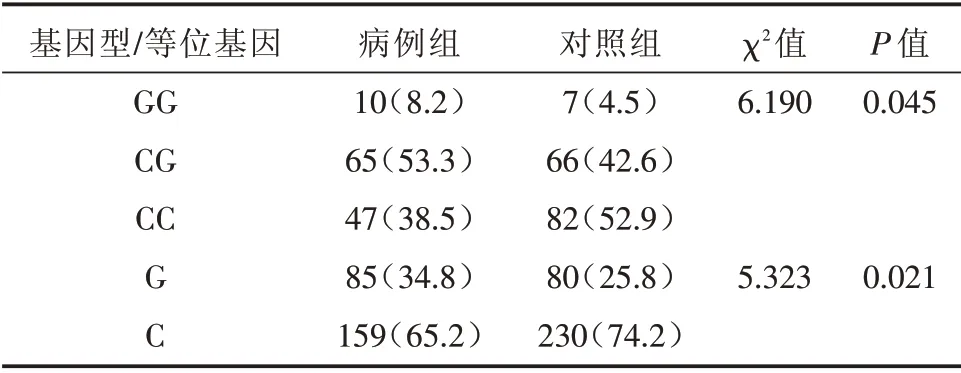
表1 病例组与对照组的基因型及等位基因频率对比Tab.1 Comparison of genotype and allele frequency of site in cases and controls 例(%)
2.3 基因多态性与AAV 易感性的Logistic 回归分析 以rs10181656 位点基因型为自变量,AAV 是否发病为因变量做Logistic 回归分析,以野生纯合型CC 为参照(OR= 1),发现GG 基因型发病风险的相对危险度为2.827(OR= 2.827,95%CI:1.207~6.621,P=0.017),较CC 者具有较高的AAV 发病风险;以等位基因C 为参照(OR= 1),G 等位基因携带者发病风险的相对危险度为1.537(OR=1.537,95%CI:1.066 ~2.217,P=0.021)。见表2。
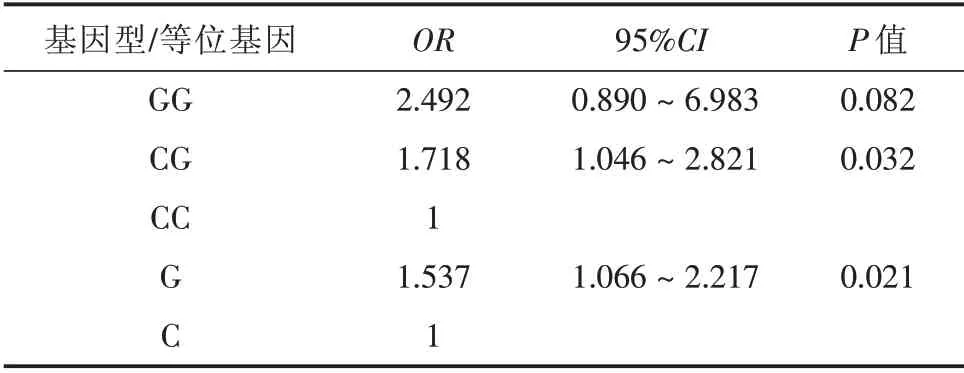
表2 基因多态性与AAV 易感性的Logistic 回归分析Tab.2 Logistic regression analysis of gene polymorphism and AAV susceptibility
2.4 基因型多态性与临床症状的关系 根据AAV患者是否伴血尿、蛋白尿、咯血、水肿等临床症状分亚组,发现rs10181656位点基因型及等位基因频率在AAV 患者伴血尿和不伴血尿亚组中的分布差异均有统计学意义(基因型:χ2= 6.192,P= 0.045;等位基因:χ2=5.337,P=0.021)。见表3。
2.5 基因型多态性与临床症状的Logistic 回归分析 分析rs10181656 位点的基因型频率差异与患者是否伴血尿有关,进一步行Logistic 回归分析,以野生纯合型CC为参照(OR=1),发现GG+CG基因型具有较高的血尿发生风险(OR= 2.603,95%CI:1.017 ~2.664,P =0.046)。同样,以等位基因C 为参照(OR= 1),等位基因G 携带者具有较高的血尿发生风险(OR= 2.393,95%CI:1.127 ~5.081,P=0.023)。
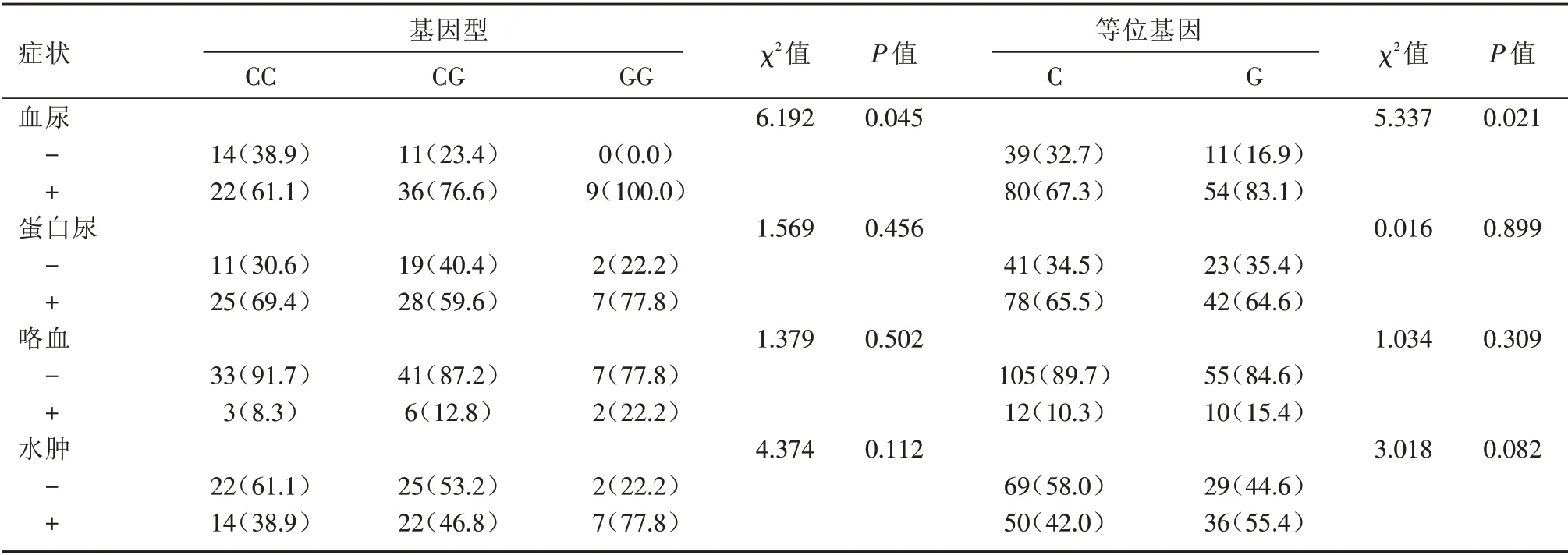
表3 rs10181656 基因型及等位基因在AAV 临床症状亚组中的分布Tab.3 The distribution of rs10181656 genotype and allele in AAV with clinical symptoms 例(%)
3 讨论
STAT4 是STAT 家族中较为特殊的一员,其表达谱有限,主要分布在富含免疫细胞的组织,如淋巴和髓系组织中[9]。STAT4 通过编码转录因子激活一系列炎症因子,加速Th1 和Th17 细胞的分化,导致体内Thl/Th2 细胞失衡[10],影响IL-12 和IL-23通路,并且激活干扰素(IFN)信号[11],打破正常人体的免疫耐受。已有研究证实诸多炎性和自身免疫性疾病中均存在上述细胞因子失衡[12],KLING等[13]发现AAV 患者中普遍存在以Th-17 为主的Th细胞的异常分化,增强效应细胞的细胞毒性,从而引起相应靶器官的损害。
本研究发现,STAT4 rs10181656 位点中,等位基因和基因型在病例组与对照组中分布差异显著,基因型为GG 及等位基因G 携带者的AAV 发病风险远大于野生纯合型CC 及C 等位基因携带者,提示STAT4 rs10181656 可能与中国广西汉族人群AAV 易感性相关。YAN 等[14]证实在中国汉族人群中,rs10181656 的G 等位基因与自身免疫性甲状腺疾病存在相关;相反,在韩国人群中,rs10181656中G 等位基因与自身免疫性甲状腺疾病易感性无关[15]。另一方面,在瑞典人群中,rs10181656 中次要等位基因G 可增加类风湿关节炎发病风险[16],但在希腊人群中并未发现其与类风湿关节炎发病风险有关[17]。笔者推测rs10181656 基因多态性在不同地区、不同疾病间的作用机制不甚相同。考虑到人群及样本量的限制,仍需后续更多学者行大样本、多人群的深层次研究。
另外,GG 基因型频率在AAV 伴血尿患者中较高,提示STAT4 rs10181656 基因多态性可能与肾脏累及有关。TEBBUTT等[18]发现,活化的T细胞对肾脏和肺脏具有较强的亲和力,可引起大量中性粒细胞和巨噬细胞聚集在肾及肺脏[19],使相应的组织严重受累,出现不同临床症状。既往研究显示STAT3基因多态性与咯血症状相关[20],而肾脏及肺脏受累同样被证实是血管炎预后不良的主要危险因素[21]。因此笔者推测不同基因家族介导的炎症通路可能受位点突变影响,导致炎症细胞活化程度不同,从而引发不同基因型间患者脏器受累的差异。考虑患者病情进展程度不同,故结果须辩证看待。
综上所述,STAT4 rs10181656 基因多态性与中国广西汉族人群AAV易感性相关,与患者血尿发生相关。但由于目前实验标本规模较小,纳入对象及人群较局限,且随访时间较短,未能除个人群分层及实验方法等误差可能。后续仍需更多学者开展不同地区的STAT4基因通路的研究,将有助于寻找AAV发病的易感基因,研究开发针对STAT4或其下游介质的靶向药物,为AAV临床治疗提供新方法。

