氮、磷添加对青藏高原高寒草甸丛枝菌根真菌群落的影响
林 昕,董 强,王 平,姜丽丽,胡嘉丽,汪诗平,3,纪宝明
(1 北京林业大学 草业与草原学院,北京 100083; 2 中国科学院 青藏高原研究所/中国科学院 高寒生态院重点实验室,北京 100101; 3 中国科学院 青藏高原地球科学卓越创新中心,北京 100101)
丛枝菌根真菌 (Arbuscular mycorrhizal fungi,AMF)是属于球囊霉门Glomeromycota的专性共生微生物,可以与陆地80%以上的植物根系共生。AMF自身生长所需的碳源完全依赖宿主植物,作为回馈,它们可以帮助宿主吸收矿质营养,提高宿主植物对生物及非生物胁迫的抗性[1]。研究发现AMF对植物种群、群落甚至是草地生态系统都有重要的调控作用[2-4]。
高寒草甸是青藏高原东南部主要的草地类型[5],其主要建群植物为莎草科嵩草属的小嵩草Kobresia pygmaea、矮嵩草K. humilis、线叶嵩草K.capillifolia和藏嵩草K. tibetica等[6-7],因此也称作高寒嵩草草甸。莎草科植物一直被认为是非丛枝菌根植物,但有研究发现在青藏高原AMF可以与嵩草属植物共生[8-9],并对土壤团聚体的形成起重要作用[10]。基于AMF在草地生态系统中的重要性以及高寒嵩草草甸在青藏高原草地中所占的比例,研究高寒嵩草草甸生态系统中AMF的群落构建及动态对深入理解青藏高原草地土壤−植被相互作用具有重要意义。
近几十年来,受全球气候变暖和人类活动加剧的影响,青藏高原约1/3的草地发生了不同程度的退化[11]。施肥是退化草地恢复的有效方式之一,目前关于养分添加(主要是氮和磷)能否及如何影响高寒草甸AMF群落的研究相对稀少,并且仅限于海拔不超过 3 500 m 的区域[12-14],不能代表海拔为 3 200~5 200 m的青藏高原高寒嵩草草甸[7]。目前基于传统形态鉴别[15]和分子测序[16]的研究表明,随海拔提升,AMF侵染率、孢子数量和物种丰度下降,AMF群落组成也随之变化。不同海拔高度AMF群落对施肥的响应可能不同,为了更全面地认识高寒草甸,有必要选择海拔更高的区域进行研究。
本试验选取海拔约4 500 m的高寒嵩草草甸施肥样地,研究不同氮、磷添加对青藏高原高寒嵩草草甸AMF群落的影响及潜在驱动因子。本研究的核心科学问题为探究高寒嵩草草甸根系AMF群落对氮、磷添加的响应机制,及在添加氮、磷条件下主导AMF群落变化的因素。
1 研究区概况和方法
1.1 研究区概况
研究样地位于中国科学院青藏高原研究所那曲生态环境观测站 (E91°12′~93°02′,N30°31′~31°55′),属于西藏那曲东南部,海拔 4 480 m,年平均气温−2.1 ℃,年平均降水 406.2 mm,高原山地气候,土壤类型为始成土,主要植物种类有小嵩草、矮嵩草和藏薹草Carex thibetica等。
1.2 样地设计及取样
2013 年设置了 48 个 5 m × 5 m 的小区,完全随机设计,3个施氮梯度,4个施磷梯度,4次重复。施用的氮肥为尿素,各处理每年施用量分别为0、7.5、15.0 g·m−2,分别记为 N0、N1 和 N2。施用的磷肥为过磷酸钙,有效成分为P2O5,各处理每年P2O5施用量分别为 0、7.5、15.0、30.0 g·m−2,分别记为 P0、P1、P2和P3。每年7月末施肥1次。
2016年8月18日,在每个小区随机挑选1个植被覆盖度相似的点作为样点。用土钻从每个样点均取深20 cm、直径8 cm的土块。将土块过2 mm筛,去除土和石块,将保留的根系装入自封袋作为1份样品,−20 ℃保存。另取部分过筛的土装入自封袋,4 ℃保存。共计取得48份根系样品和48份土壤样品,冷藏运送至北京林业大学草地资源与生态实验室。在进行后续试验分析前,将所有根系样品室温解冻,然后用清水洗净。
1.3 土壤化学成分分析
取适量土壤样品进行土壤化学成分分析。土壤有机碳用重铬酸钾滴定法[17]测定;土壤全氮用凯氏定氮法[18]测定;土壤铵态氮和硝态氮均用 1 mol·L−1的氯化钾溶液浸提,然后用紫外分光光度法[19]测定;土壤全磷和有效磷分别用高氯酸−硫酸和碳酸氢钠浸提,并用钼−锑比色法[20-21]测定;pH在水土质量比为2.5∶1的条件下测量。
1.4 丛枝菌根真菌侵染率测定
根据Brundrett等[22-23]的方法,先从每份根系样品中剪取若干长1.5 cm的幼嫩根段,用台盼蓝染色。染色后在每份样品中挑出30个根段,切成1 cm根段,然后将每10个根段平行地放置在载玻片上,滴加乳酸甘油制片,每份样品制作3个玻片。在200×显微镜下根据McGonigle等[24]的方法测定AMF侵染率。
1.5 丛枝菌根真菌DNA提取、扩增及测序
在每份根系样品中,剪取40根长1 cm的幼嫩根段,用CTAB法[25]提取其中的DNA。提取出的DNA用无菌去离子水稀释20倍作为DNA原液,然后进行巢式PCR扩增。2轮PCR的反应体系均为 25 μL:2 × Pfu PCR MasterMix (KP201) 12.5 μL,无菌去离子水 8.5 μL,DNA 模板 2 μL 以及 2个引物各1 μL。第1轮PCR使用的引物为NS31(5′-TTGGAGGGCAAGTCTGGTGCC-3′)和 AML2(5′-GAACCCAAACACTTTGGTTTCC-3′),反应条件:94 ℃ 预热 3 min;94 ℃ 变性 45 s,53 ℃ 退火 45 s,72 ℃ 延伸 45 s,35 个循环;72 ℃ 延伸 10 min。第1轮PCR的产物稀释至1/10作为第2轮PCR的模板。第2轮PCR使用的引物为AMV4.5NF(5′-AAGC TCGTAGTTGAATTTCG-3′)和 AMDGR(5′-CCCAACTATCCCTATTAATCAT-3′)[26],其中AMDGR的5′端带有由12个碱基组成的barcode。第2轮PCR反应条件与第1轮PCR相同,所得的产物用 10 g·L−12 × TAE 的琼脂糖凝胶进行电泳(电压 120 V,时间 30 min)检测。若样品有目标DNA 条带 (约 280 bp)检出,取 4 μL 第 2 轮 PCR模板用2倍的反应体系进行第2轮PCR。若样品无目标条带检出,用该样品的DNA原液重复巢式PCR,若2次重复均无目标条带,则去除该样品。根据此方法N1P1处理中的1个样品无条带,去除后剩余47个样品。切取含目标条带的凝胶,使用DNA胶纯化试剂盒(Axygen,美国)进行DNA纯化。纯化后的DNA使用Nanodrop 8000超微量分光光度计测定浓度,根据测定的浓度用移液枪从每个样品中吸取含100 ng DNA的溶液混合至1个离心管,送至中国科学院成都生物研究所在Illumina Miseq平台进行高通量测序。
1.6 生物信息学分析
测序得到的原始数据使用QIIME[27]进行分析。首先对数据进行质量控制,最大错误期望=0.5,最短序列长度=200,然后依次去除重复、chimeras和singletons。使用UPARSE-OTU算法和Silva数据库,依据97%的相似度阈值划分代表OTU并制作OTU表。在Excel中除去不属于球囊霉门、出现的样本数少于3以及序列数小于总序列量0.01%的OTU,并删除序列数小于总序列1%的样品以降低误差。对所有样品根据最小的样本序列量进行重新抽样,以减小样本量不同造成的差异。此外,将代表OTU序列上传至NCBI,与GenBank的已有序列进行比对,获得相近的参考序列。使用代表序列和参考序列在MEGA 7中使用p-distance模型,在bootstrap值为1 000下构建邻接树,直观查看代表OTU的系统发生情况。本研究获得的代表OTU序列均上传至欧洲核苷酸档案库,序列号为LR535994~LR536029。
1.7 统计分析
统计OTU数量作为OTU丰度,并计算AMF各科在各样品和各处理中的相对丰度。在R(3.2.2)中使用Vegan包中diversity功能计算每个样品的Shannon多样性指数。
进行方差分析前,将数据进行转换以符合数据分布的正态性和方差同质性。其中,对土壤化学成分、OTU丰度和Shannon多样性指数数据进行对数转换,侵染率和AMF科相对丰度数据作反正弦平方根转换。转换后的数据在JMP 11中进行双因素方差分析,分析氮、磷添加是否显著影响以上数据,具有显著差异(P<0.05)的结果使用Tukey's HSD检验进行多重比较。
在群落分析前,先应用R对OTU−样品矩阵进行Hellinger转换以减少稀有OTU的影响,然后用vegdist功能将矩阵转化为Bray-Curtis矩阵。在R中使用Vegan包中的adonis功能进行PerMANOVA分析,研究施氮、磷和其交互作用对AMF群落组成的影响。将土壤化学成分数据作为环境变量导入R并转化为Euclidean矩阵,与之前的群落矩阵一起进行Mantel分析,以研究土壤化学成分与AMF群落组成的关系。
最后,进行排序分析以研究不同处理AMF的群落分布情况。首先用原始的OTU−样品矩阵进行去趋势对应分析,根据排序轴长结果进一步使用典范对应分析,并用envfit功能进行Monte Carlo检验找出与AMF群落分布有显著相关的环境因子。最终使用ggplot包进行画图,直观显示各处理下AMF群落分布及其和环境因子的关系。
2 结果与分析
2.1 土壤化学成分
方差分析得出,不同施氮处理铵态氮和硝态氮含量差异均极显著(P<0.001);不同施磷处理全磷和有效磷含量也有极显著(P<0.001)差异;氮、磷添加的交互作用对硝态氮和有效磷含量有显著(P=0.021,P=0.040)影响 (表1)。其中,N2处理铵态氮和硝态氮含量高于N0和N1处理;P3处理全磷和有效磷量高于其余施磷处理,P2处理有效磷含量高于P0处理(表2)。氮、磷添加及其交互作用未对土壤有机碳、全氮和pH产生显著影响(表1)。

表1 不同施肥处理土壤化学成分含量差异显著性分析Table 1 Significance analyzes of soil chemical component content differences in different fertilization treatments
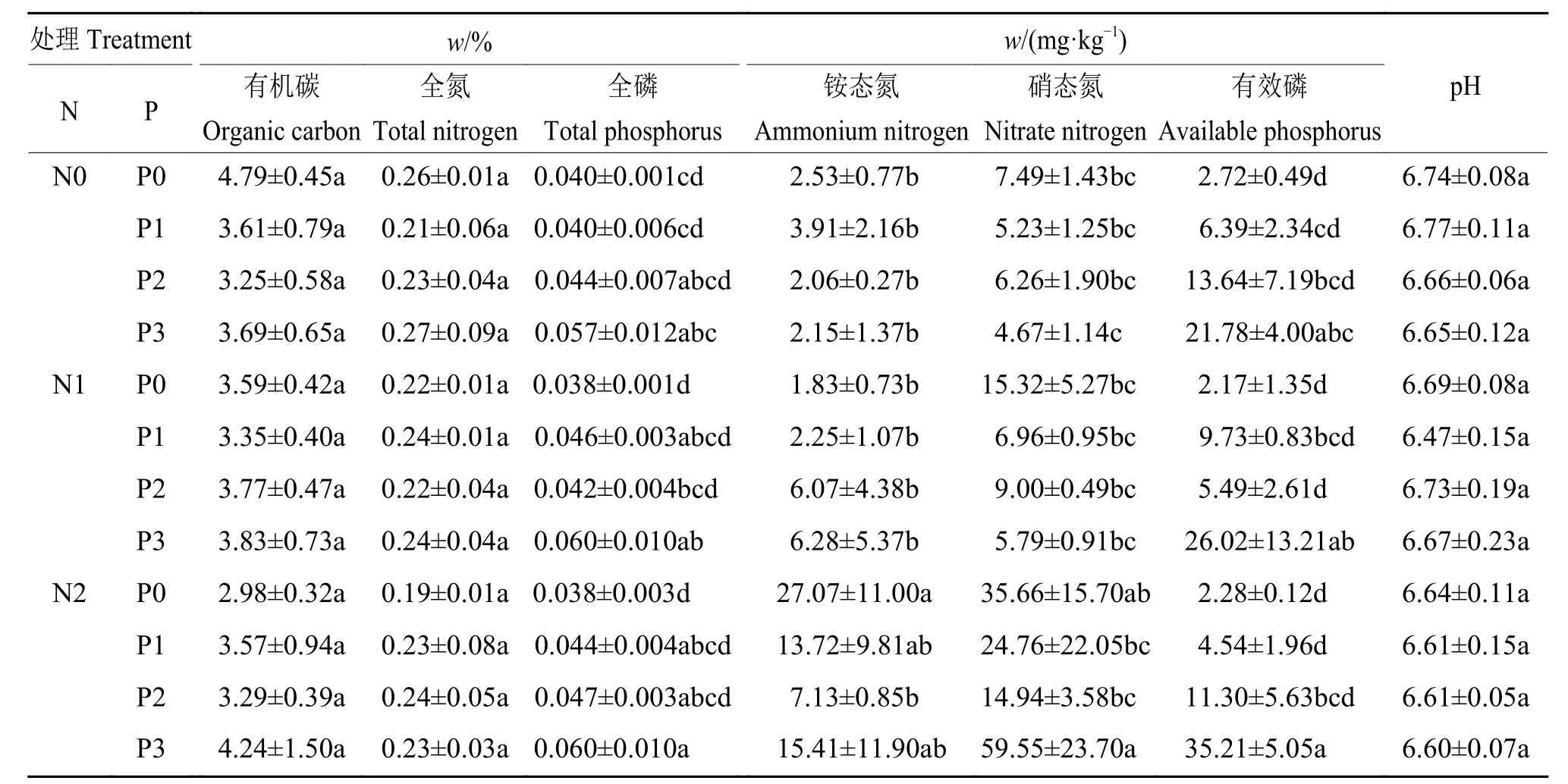
表2 不同施肥处理试验样地的土壤化学成分含量1)Table 2 Soil chemical component contents of the experiment field in different fertilization treatments
2.2 丛枝菌根真菌侵染率
如图1所示,根系样品AMF侵染率平均值为73.1%。方差分析结果表明,氮、磷的施加及其交互作用对 AMF 侵染率无显著 (P= 0.350,P= 0.119,P=0.562)影响。
2.3 测序总体结果
测序数据除杂后,剩余43个样品,共获得234 041条AMF序列。每个样品序列数从297至15 397不等。将所有样品重新抽样至样本量为297后,获得36个OTU,每个样品的OTU数量从1至12个不等,平均值为5.6个。根据稀释曲线(图2)可以看出,重新抽样后 N0P2、N1P0、N1P3、N2P2和N2P1对应的曲线末端趋于平滑,说明测序深度较为饱和。经比对,所有AMF的OTU分属7个科,其中球囊霉科有27个OTU,10 285条序列,占总序列的80.5%;多孢囊霉科Diversisporaceae有3个OTU,666条序列,占总序列的5.2%;碎球囊霉科Claroideoglomeraceae有2个OTU,146条序列,占总序列的1.1%;无梗囊霉科Acaulosporaceae、原囊霉科Archaeosporaceae、巨孢囊霉科Gigasporaceae和和平囊霉科Pacisporaceae各有1个OTU,序列数分别为441、532、351和350条,共占总序列的13.1%(图3)。根据OTU代表序列和参考序列构建的邻接树如图4所示。

图1 不同施肥处理下丛枝菌根真菌侵染率Fig. 1 Arbuscular mycorrhizal fungal colonization rates in different fertilization treatments

图2 不同施肥处理下分子测序的稀释曲线Fig. 2 Rarefaction curve of sequencing samples in different fertilization treatments

图3 不同施肥处理下丛枝菌根真菌各科的相对丰度Fig. 3 Relative abundance of different arbuscular mycorrhizal fungal families in different fertilization treatments

图4 36个丛枝菌根真菌OTU代表序列及其参考序列构建的邻接树Fig. 4 Neighbor-joining tree constructed based on representative sequences of 36 arbuscular mycorrhizal fungal OTUs and their reference sequences
2.4 氮、磷添加对丛枝菌根真菌群落的影响
方差分析结果显示,氮、磷添加及其交互作用对OTU丰度和Shannon多样性指数无显著影响(图5A、5B)。但施氮对球囊霉科的相对丰度有显著影响(P<0.001),N2处理球囊霉科的相对丰度显著低于N1(图5C)。
PerMANOVA结果表明氮、磷添加处理及其交互作用对AMF群落组成无显著影响(P = 0.680,P=0.473,P= 0.589)。Mantel分析结果显示 AMF 群落组成与有机碳含量和硝态氮含量有显著正相关(r=0.176,P=0.110;r=0.142,P=0.041)关系。此外,Monte Carlo结果表明有机碳、硝态氮、全磷和有效磷含量均对AMF群落结构有显著影响(r=0.04,P=0.001;r=0.327,P=0.013;r=0.185,P=0.025;r=0.188,P=0.020)。这4个环境因子在典范对应分析中对排序结果的解释量为11.70%,第1轴和第2轴的解释量分别为6.13%和2.61%。(图6)。

图5 不同施肥处理丛枝菌根真菌OTU丰度、Shannon多样性指数及球囊霉科相对丰度Fig. 5 OTU richness, Shannon diversity index of arbuscular mycorrhizal fungi and relative abundance of Glomeraceae in different fertilization treatments

图6 不同施肥处理丛枝菌根真菌群落以及显著环境变量的典范对应分析图Fig. 6 Canonical correspondence analysis plot of arbuscular mycorrhizal fungal community distribution and significant environmental variables among different fertilization treatments
3 讨论与结论
在农田和天然草地生态系统中,施加氮和磷会降低AMF侵染率、OTU丰度和多样性,改变根系和根际土壤中AMF的群落结构[28-29]。研究认为出现这种现象的原因是土壤养分的增加使植物更多依靠自身根系去吸收营养,降低对帮助其吸收养分的微生物的依赖[30]。本研究发现,施氮显著提高了土壤中铵态氮和硝态氮的含量,施磷显著增加了土壤中全磷和有效磷的含量,但氮、磷的施加对AMF侵染率、OTU丰度、多样性以及群落组成均无显著影响。因此,本研究的结果与此前在其他生态系统下的研究结果存在差异[28-29],该差异可能是由以下原因造成的。
首先,差异可能是海拔不同造成的。目前相关研究[12-14]的海拔不超过3 500 m,低于本试验样地的海拔4 480 m。海拔会显著影响AMF的群落和功能,Gai等[15]和Shi等[31]通过形态学方法发现不同海拔条件下AMF侵染率、孢子密度以及菌丝密度都会有显著变化;Liu等[16]和Li等[32]通过分子测序手段发现不同海拔条件下AMF群落组成有显著差异。本研究与此前研究的海拔不同,气候、植被及土壤条件都会有不同,进而导致AMF对氮、磷添加的差异性响应。
第二,在高寒地区AMF不仅能帮助植物进行养分吸收,同时也可帮助植物应对环境胁迫。因此即使在施肥条件下植物不需要AMF来帮助其获取养分,还是要与AMF保持共生关系应对胁迫。Xiang等[13]在海拔3 220 m的青藏高原高寒草地施肥3年,发现同时添加氮和磷时AMF的OTU丰度和多样性均显著高于对照,也高于氮、磷单独添加时的水平。Chen等[33]研究认为,虽然在养分充足的条件下,植物在营养吸收上降低了对AMF的依赖,然而,植物依然需要AMF来帮助其对抗环境胁迫,尤其是球囊霉科可以提高宿主抗寒性。在本研究的高寒草甸生态系统中,一方面氮、磷的添加使得植物群落降低了对AMF吸收养分的依赖,另一方面植物群落却增加了依靠AMF来对抗胁迫的需要。因此,2个效应综合使得在氮、磷添加的情况下AMF的OTU丰度、多样性和群落组成未受显著影响。
另一个可能引起差异的原因是样品内及样品间的差异较大,影响了氮、磷添加的效应。从稀释曲线可以看出,个别样品的曲线在终点处仍在上升,说明其测序深度未达到饱和,此时增加取样量可能会有更多的OTU出现。同时,通过典范对应分析图可以直观地发现,N2P3处理3次重复的AMF群落分布距离较大,该处理3次重复的AMF群落的差异是所有处理的重复间差异最大的。基于样本内的误差,本试验结果存在一定限制性。
本研究中,PerMANOVA分析发现,施加氮、磷不影响AMF群落组成,但通过Mantel分析发现AMF群落的组成与有机碳和硝态氮含量有显著的正相关关系。典范对应分析的结果表明有机碳、硝态氮、全磷和有效磷含量与AMF群落的分布有显著的正相关关系,其中有机碳与AMF群落分布的相关性最大。有机碳主要对低磷条件(P0和P1处理)AMF群落有影响,硝态氮、全磷和有机碳主要对高磷条件(P3处理)AMF群落有影响。相关研究也表明,土壤有机质、硝态氮和有效磷均是对高寒草甸AMF群落有显著影响的土壤成分[34-35]。
Zheng等[34]发现施氮能改变AMF群落,但不是通过直接作用,而是间接地通过改变土壤其他成分(如有机碳)和植物群落来影响AMF群落。土壤成分也可以直接或间接地影响微生物群落[36-37]。因此可以解释本研究中施肥未对AMF群落产生影响,但特定的土壤因子与AMF群落分布有显著相关性。
综上所述,基于青藏高原4 500 m海拔高寒草甸的研究发现,氮、磷添加对AMF的侵染率、OTU丰度和多样性无显著影响。该发现回答了本研究要明确的第1个核心科学问题,即青藏高原高寒嵩草草甸根系中的AMF群落不受氮、磷添加的影响,与海拔较低的AMF群落对氮、磷的响应不同;对第2个核心科学问题,影响青藏高原高寒嵩草草甸根系AMF群落的因子主要是有机碳和硝态氮含量,全磷和有效磷含量是次要因子。未来研究还需要系统选取不同海拔的样地,以获取青藏高原不同海拔高寒草甸AMF群落对施肥的响应。另外,在全面剖析AMF群落变化规律及驱动机制的基础上,亟需研究AMF群落变化如何反馈影响地上植被的个体生长与群落动态,探索高寒草地退化及恢复演替中的地下生态过程及机理。

