青龙衣有效组分对COX-2及PGE-2在人胃癌裸鼠原位移植瘤中的表达研究
黄 丹,杨滨梦,段玉敏
(1.沈阳师范大学 粮食学院,辽宁 沈阳 110034;2.沈阳师范大学学前与初等教育学院,辽宁 沈阳 110034)
胃癌是最常见的消化系统恶性肿瘤,全球范围内胃癌发病率仅次于肺癌,位居第2位。而我国是胃癌的高发区,其发病率和死亡率均居第2位,高于世界平均水平,高复发率和高转移率是其主要死因[1 ]。中医药防治恶性肿瘤方面,近年来显示出一定优势,并越来越受到关注。青龙衣具有多种抗癌活性,作为一种抗癌中药,对于肝癌、胃癌、肺癌、结肠癌、白血病、乳腺癌、宫颈癌等多种癌症具有抗癌作用,在改善病人生存质量,增加病人生存期方面效果显著[2]。本实验通过观察青龙衣有效组分对人胃腺癌细胞BGC-823裸鼠原位移植瘤生长抑制作用及对环氧合酶-2(COX-2)和前列腺素-2(PGE-2)表达的影响,探究其可能的作用机制。
1 实验材料与方法
1.1 动物
SPF级BALC/c雄性裸鼠20只,鼠龄6~8周,体重18~20 g,均为雄性,中国医学科学院实验动物研究所,合格证号SCXK(京)2017-0013。每组5只,小鼠分笼饲养,自由饮食和饮水,定时清理鼠笼。
1.2 药物和细胞株
青龙衣有效组分由沈阳师范大学实验室自制。消癌平,南京中科药业有限公司,批号Z20070017。人胃腺癌细胞株BGC-823,购自中国科学院上海细胞研究所。
1.3 主要试剂与仪器
1640培养基,赛默飞世尔生物制品有限公司;胰酶,赛默飞世尔生物制品有限公司;兔抗鼠COX-2单克隆抗体,Cell Signaling Technology公司;免疫组化试剂盒PV9000、DAB显色剂,中杉金桥生物技术有限公司;PGE-2 ELisa试剂盒,上海源叶有限公司;脱水机,Hestion有限公司;Image Scanner,美国 Bio-Rad公司。
1.4 小鼠胃癌模型制备
1.4.1 小鼠胃癌原位移植瘤(供瘤体) 人胃癌细胞株BGC-823,细胞均成功培养及细胞传代,达到实验用量,经胰酶消化后,台盼蓝染色,镜下活细胞计数,用生理盐水调整为5.4×107个/mL细胞密度的单细胞悬液。用75%的乙醇棉球将小鼠的下腹部消毒,用1 mL的注射器对小鼠的下腹部腹腔注射0.3 mL的细胞悬液。观察小鼠的腹水情况,当小鼠腹部隆起后,抽取腹腔内淡黄色细胞悬液。用75%的乙醇棉球将细胞悬液接种于小鼠腋部皮下形成皮丘,当皮下移植瘤长至大约1 cm时剥取移植瘤,为实验模型的瘤源。
1.4.2 小鼠胃癌原位移植瘤模型 在无菌的环境下,从小鼠腋下取瘤组织,磨成匀浆备用。实验小鼠用7%的水合氯醛0.075 mL/10 g麻醉,常规手术,在胃大弯窦处用1 mL注射器将瘤组织匀浆0.3 mL缓慢注射入胃壁浆膜层,缝合腹膜及皮肤,关腹。20只小鼠均按照此方法造模,成功并存活。
1.5 实验分组及给药方案
将原位胃癌移植裸鼠随机分为模型组、消癌平组和青龙衣高、低剂量组,每组5只。消癌平阳性对照组,灌胃给予消癌平和生理盐水的混合液体,给药剂量为0.234 g/kg,青龙衣有效组分低、高剂量给药组,接种一周后给药,灌胃给予青龙衣有效部分浑浊液(蒸馏水混合),给药量为0.75、0.375 g/kg灌胃,模型组用等量生理盐水灌胃,给药体积均为0.2 mL/10 g,1次/d,连续 15 d。停药当日,摘取眼球血,保留血清,处死裸鼠,取瘤体用于各项指标的测定。
1.6 标本收集
2周后,将所有组的鼠禁食不禁水24 h,取眼球血,脱颈处死裸鼠,分别取每只小鼠的胃部瘤组织,10%的福尔马林固定过夜,酒精梯度脱水,二甲苯透明,石蜡包埋,切片。
1.7裸鼠病理观察
将“1.”6中的石蜡切片进行HE染色,镜下观察。
1.8免疫组化检测cox-2的表达
将石蜡切片置于60 ℃的烘箱烘干过夜,脱蜡水化,微波修复抗原,PBS冲洗3次×2 min,分别加入3%过氧化物酶16 min,PBS冲洗3次×2 min,胎牛血清工作液20 min孵育,滴加COX-2一抗(1∶800湿盒)4 ℃过夜,PBS冲洗3次× 5 min,分别加入生物素标记兔抗鼠及辣根酶标记链酶工作液后,再次PBS冲洗3次×5 min,滴加 DAB显色试剂,镜下观察 3~5 min,以胞质出现黄色、棕黄色或褐色颗粒为表达阳性,苏木精复染 1 min,0.1%盐酸酒精分化30 s,自来水冲洗至返回蓝色,梯度乙醇脱水干燥,中性树胶封固,镜下观察,拍照记录,对照组用 PBS代替一抗阳性判定。
组织图像使用Image-Pro PLUS 6.9软件学分析。每个分组取两张组织切片进行检测,选择阳性显色点,统计40倍视野下切片的平均显色点面积(area)、平均光密度(density)和累计光密度值(integreted optical density,IOD)。
1.9 ELISA法检测PGE-2细胞因子水平
取“1.4”项下各组裸鼠的血液样品,3 000 r·min-1,4 ℃,离心15 min,取上清液得到血清样品,参照PGE-2的酶联免疫ELISA试剂盒说明书的操作步骤进行具体操作,采用酶标仪检测每组裸鼠血清中的PGE-2细胞因子水平。
1.10 统计学方法
2 结果
2.1 裸鼠病理情况
由图1可知,模型组癌细胞间可见大量的毛细血管,血液供应丰富,癌细胞生长旺盛,增值速度快。各给药组癌细胞明显减少,增值速度缓慢,毛细血管数量明显少于模型组。
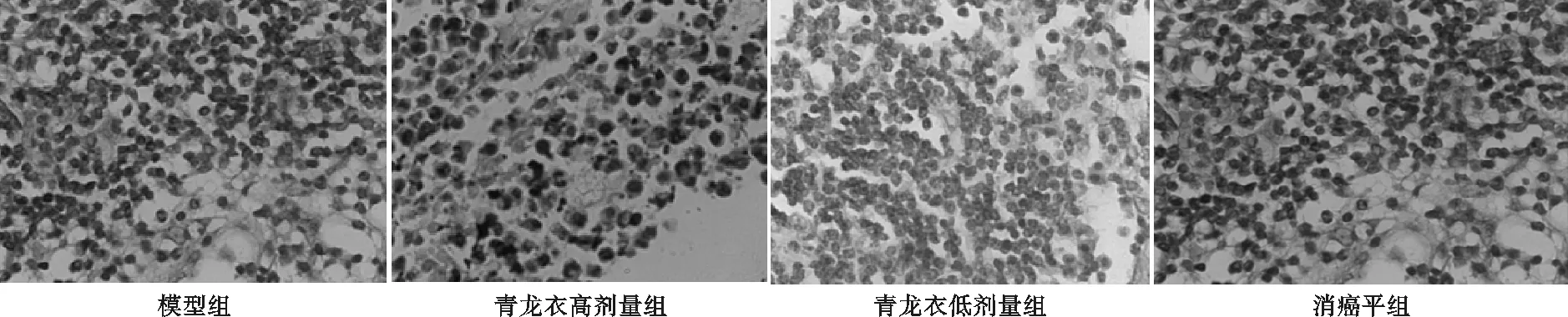
图1各组模型小鼠肿瘤组织病理形态(HE染色×40)
2.2 青龙衣有效组分对裸鼠胃癌细胞COX-2蛋白表达的影响
免疫组化结果显示,与模型组比较,青龙衣高、低剂量组和消癌平组COX-2表达水平明显降低,且青龙衣高剂量组优于青龙衣低剂量组。P<0.05表示差异具有统计学意义。结果见图2、图3。
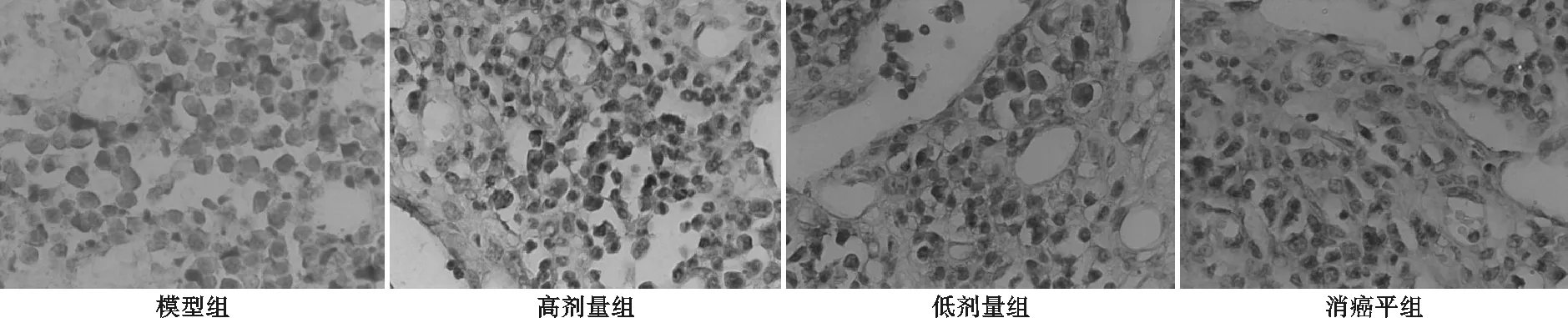
图2青龙衣有效组分对人胃腺癌BGC-823裸鼠瘤组织中COX-2蛋白含量影响
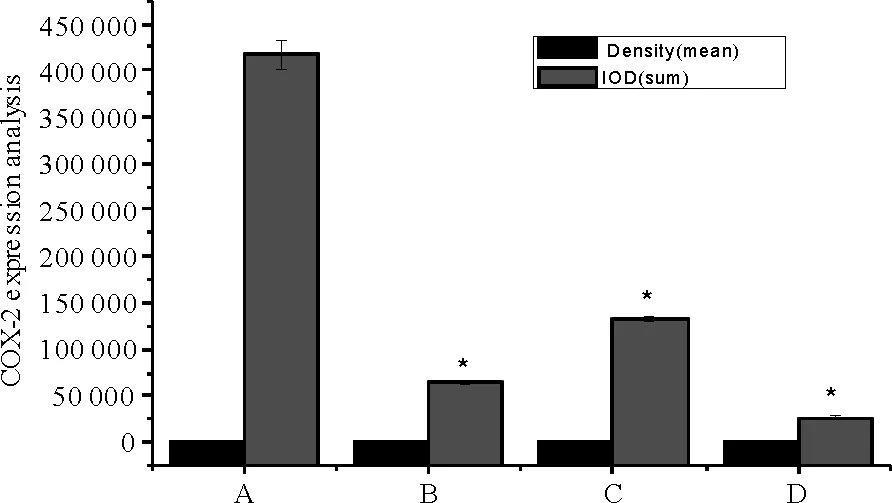
注:A:模型组;B:青龙衣高剂量组;C:青龙衣低剂量组;D:消癌平组。密度(均值)用于检测平均灰度等级;IOD(总和)用于检测累积的光学密度切片。*P<0.05
图3COX-2表达分析结果
2.3 对瘤裸鼠血清中PGE-2的影响
由表1可知,与模型组相比,青龙衣有效组分给药组荷瘤裸鼠血清中PGE-2含量明显降低(P<0.5),且随着药物浓度的增加,呈剂量依赖关系。PGE-2作为COX-2的催化产物,与COX-2表达水平及活性密切相关,通过G蛋白偶联受体作用,与COX-2共同作用参与细胞恶性转化、促进肿瘤血管生成、抑制抗肿瘤免疫等机制调控多种肿瘤发生、血管生成、侵袭转移等。
表1 对胃癌裸鼠血清中PGE-2含量影响

组别PGE-2模型组290.69±22.94青高剂组257.56±20.94*青低剂组246.5925±9.8*消癌平组267.84±20.11
注:与模型组比较,*P<0.05。
3 讨论
胃癌的发生发展是一个复杂病理过程,是多因素、多步骤、多基因共同决定的。传统的治疗方法(手术及放化疗)在胃癌的早期,治疗会取得比较满意的疗效,但对于胃癌晚期并伴有局部转移者,治疗结果往往难以取得满意。侵袭和转移是恶性肿瘤最重要的生物学特性,也是肿瘤患者死亡的主要原因,胃癌也是如此。对于晚期胃癌患者寻找可以抗转移的药物是一个新趋势[3]。近年来,诸多研究者致力于深层次探讨中药抗肿瘤侵袭转移机制,从中寻找新型抗肿瘤药物[4]。本实验选择的青龙衣为胡桃科植物核桃楸(JugandmandshuricaMaxim.)和胡桃(JuglansregiaL.)的未成熟果实的外果皮,秋季采收,及时晒干而得。在《开宝本草》及《本草纲目》中均有记载,其味辛、苦,性涩、平,中医多以其清热解毒、祛风疗癣、止痛止痢功效入药,为我国十分重要的药源植物,具有重要药用价值[5]。在国内,由于民间将青龙衣用于治疗消化系统癌症的验方而受到广大学者的广泛关注,因此,对青龙衣更多开展的是抗肿瘤活性的物质基础、体内外抗肿瘤作用及作用机理的深入研究[6]。本实验采用细胞悬液植入法成功建立人胃癌BGC-823裸鼠原位移植肿瘤模型,分组给予药物,从实验结果可以看出青龙衣组的COX-2和PGE-2含量均得到抑制,与模型组相比具有统计学意义(P<0.05),提示对胃癌组织的侵袭转移有抑制作用。近年来,国内外大量研究表明,COX-2的显著表达与胃肠道的肿瘤发生发展有着密切关系。COX-2作为炎性调节因子,是炎症组织中催化花生四烯酸合成前列腺素(Prostaglandin,PG)的限速酶之一,在正常组织中一般不表达,在各种因素如癌蛋白、炎性刺激、细胞因子等的作用下,COX-2的表达显著上调。前列腺素 E2(Prostaglandin E2)是 COX-2的下游产物,介导人体中炎症、发热及疼痛等病理过程,能够通过促进血管形成、细胞增殖,抑制细胞的免疫功能和凋亡,参与肿瘤的发生及发展[7]。本实验通过免疫组化测定各组瘤体中的COX-2的表达和ELISA法测定血清中PGE-2的含量,发现青龙衣组瘤体中COX-2的表达和血清中PGE-2的含量均下降。由此,笔者认为青龙衣有效组分可以抑制荷瘤裸鼠原位移植瘤的侵袭转移。探究其作用机制,可能为通过下调移植瘤瘤灶中COX-2和PGE-2的表达而抑制瘤体的转移侵袭。

