测定菜籽油中酚类化合物样品前处理方法的比较
宋军鸽,曹 晨,李进伟,徐勇将,刘元法
(江南大学 食品学院,江苏 无锡 214122)
酚类化合物在植物体内广泛存在,其在油菜籽中的含量较高,主要包括酚酸和单宁[1]。油菜籽在制油过程中,会有部分酚类化合物转移至油中,从而改善菜籽油的抗氧化性能和营养品质。刘阳等[2]对7种食用植物油中的微量活性成分进行了比较,发现菜籽油的总酚含量最高,约为139.83 mg/kg。研究表明,酚类化合物具有抗氧化、抗菌、抗癌、降血脂、防治心血管疾病等生理功能,对人体健康有益[3-5]。
传统的植物油中酚类化合物的提取方法主要为液液萃取(LLE)[6]和固相萃取(SPE)。Yang等[7]采用LLE对经微波预处理的油菜籽制备的菜籽油中的酚类化合物进行提取,采用80%的甲醇作为提取溶剂,反复提取3次,并结合超高效液相色谱(UPLC)考察了不同微波预处理时间对菜籽油中酚类化合物的影响。但LLE需要剧烈振荡,常会出现乳化现象,同时通常需要重复提取以尽可能提取目标物,消耗大量有机溶剂,造成环境污染。SPE利用选择性吸附与选择性洗脱的液相色谱法分离原理,实现对目标物的分离纯化[8]。Rekas等[9]使用SPE提取菜籽油中的酚类化合物,将菜籽油样品通过二醇基(Diol)萃取柱,然后分别使用正己烷和正己烷- 乙酸乙酯(体积比90∶10)进行淋洗,最后用甲醇进行洗脱,研究微波预处理油菜籽制备的菜籽油在储存过程中其所含酚类化合物的变化规律。虽然相比于LLE,SPE更具有选择性,且可同时实现对目标物的富集与纯化,但是SPE小柱价格昂贵,成本较高。
QuEChERS前处理方法是近年来发展起来的一种快速样品前处理技术,通常包括萃取和净化两部分。萃取一般采用溶剂萃取的方法,乙腈是最常用的有机溶剂。净化采用分散固相萃取的方法,即向上述所得含目标物的萃取液中加入特定的吸附剂除去杂质,以降低后续分析时杂质对目标物的干扰[10]。QuEChERS前处理方法最初被应用于高水分含量的水果和蔬菜中农药残留的分析,因其具有简便、高效、有机溶剂消耗少、基质共提物含量低等优势,应用范围日益广泛,被逐渐用于兽药、真菌毒素、多环芳烃、色素等多种化合物分析[11-12]。本文采用LLE、SPE、QuEChERS 3种不同前处理方法提取菜籽油中的酚类化合物,并采用LC-MS/MS技术分析比较了3种不同前处理方法对菜籽油酚类化合物提取效果的影响。其中,利用QuEChERS前处理方法提取菜籽油中的酚类化合物尚属国内外首次。本研究可为菜籽油中酚类化合物的组成和含量分析提供技术支撑,从而为菜籽油氧化稳定性与营养品质的研究提供依据。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
甘蓝型油菜籽,购于中国农业科学院油料作物研究所。无水硫酸镁、氯化钠、乙酸、正己烷、乙酸乙酯,均为分析纯;甲醇、乙腈为色谱纯,德国Merck公司;芥子碱标准品,大连美仑生物技术有限公司;咖啡酸、丁香酸、阿魏酸标准品,国药化学试剂集团;对香豆酸标准品,美国Fisher公司;芥子酸、白藜芦醇标准品,上海源叶生物技术有限公司;Canolol标准品,乌克兰Enamine公司;十八烷基硅烷键合硅胶(C18,50 μm),天津博纳艾杰尔科技有限公司。
1.1.2 仪器与设备
Waters ACQUITY高效液相色谱仪、Waters Xevo三重四级杆串联质谱仪,美国Waters公司;5804R型高速离心机,德国Eppendorf公司;Sorvall LYNX 4000高速落地离心机,美国Thermo公司;红外干燥箱;二醇基固相萃取(Diol-SPE)小柱(200 mg,3 mL),上海安谱实验科技股份公司。
1.2 实验方法
1.2.1 菜籽油的制备
取适量油菜籽平整铺于托盘(料层厚度约5 mm),将其置于红外干燥箱中同一位置,在120℃条件下加热30 min后取出,冷却至室温。取预处理后的油菜籽1.2 kg,置于液压榨油机中进行压榨,压榨时间30 min,压榨温度25℃,榨机压力60 MPa。收集油样,在5 000 r/min条件下离心10 min,去除杂质得菜籽油样品,置于4℃冰箱冷藏备用。
1.2.2 标准曲线的绘制
准确称取7种酚类化合物标准品各25.0 mg,分别溶解于25 mL甲醇,配制成质量浓度为1 mg/mL的标准储备液,并用锡纸包裹置于-20℃冰箱中保存备用。取一定体积的标准储备液,用甲醇逐级稀释,配制不同质量浓度的混合标准溶液,现配现用。以目标化合物的质量浓度为横坐标,目标化合物与内标物(白藜芦醇)的峰面积比值为纵坐标绘制标准曲线。
1.2.3 样品前处理
LLE:准确称取2.50 g菜籽油样品溶于3 mL正己烷中,分别用甲醇溶液提取3次,每次振摇一段时间,样品在4 000 r/min条件下离心5 min,合并3次甲醇提取液。将提取液用氮吹仪吹干,加入2.5 mL甲醇回溶,经0.22 μm滤膜过滤后置于样品瓶中用于LC-MS/MS分析。
SPE:将Diol-SPE小柱置于固相萃取装置中,分别用5 mL甲醇和5 mL正己烷活化。准确称取1.50 g菜籽油样品溶于5 mL正己烷,振摇1 min后装柱,然后分别用5 mL正己烷和5 mL正己烷-乙酸乙酯(体积比90∶10)洗柱,最后洗脱,收集洗脱液,用氮吹仪吹干,加入1.5 mL甲醇回溶,经0.22 μm滤膜过滤后置于样品瓶中用于LC-MS/MS分析。
QuEChERS:参考Song等[13]的方法。准确称取6.00 g菜籽油样品加入到50 mL离心管中,分别加入3 mL水和18 mL乙腈,振摇5 min。随后,加入7.20 g无水硫酸镁和1.80 g氯化钠,振摇2 min。样品在4 000 r/min条件下离心5 min,将上清液转移至玻璃试管中,置于-20℃冰箱中冷冻2 h后取出。移取9 mL上清液于另一15 mL离心管中,加入270 mg C18和1.80 g无水硫酸镁,振摇2 min后在4 000 r/min条件下离心5 min。移取4.5 mL上清液用氮吹仪吹干,加入1.5 mL甲醇回溶,经0.22 μm滤膜过滤后置于样品瓶中用于LC-MS/MS分析。
1.2.4 基质共提物含量测定
将3种不同前处理方法所得的提取液转移至已知质量(m0)的离心管中,用氮吹仪吹干,测定总质量(m1),按下式计算基质共提物含量。
基质共提物含量=(m1-m0)/样品质量
1.2.5 LC-MS/MS分析
色谱条件:Hypersil GOLD C18色谱柱(100 mm×2.1 mm,1.9 μm,美国Thermo公司);流动相A为水,流动相B为乙腈,二者均添加0.1%乙酸;梯度洗脱条件为0~0.5 min 10% B,0.5~15 min 10%~55% B,15~15.5 min,55%~100% B,15.5~17 min 100% B,17~17.5 min 100%~10% B,17.5~20 min 10% B;进样量2 μL;流速0.3 mL/min;柱温35℃。
质谱条件:电喷雾离子源(ESI),多反应监测模式(MRM),其中芥子碱和Canolol为正离子扫描模式,其他酚类化合物为负离子扫描模式;毛细管电压3 kV,离子源温度110℃,脱溶剂温度400℃,脱溶剂气和锥孔气均为N2,脱溶剂气流速600 L/h,锥孔气流速50 L/h。
1.2.6 数据处理
使用MassLynx软件(版本4.1)对LC-MS/MS数据进行分析。采用Origin 8.5作图。
2 结果与讨论
2.1 标准曲线
按照1.2.5所述LC-MS/MS方法对不同质量浓度的酚类化合物标准溶液进行测定,每个质量浓度平行测定3次,酚类化合物标准曲线回归方程、R2和线性范围见表1。
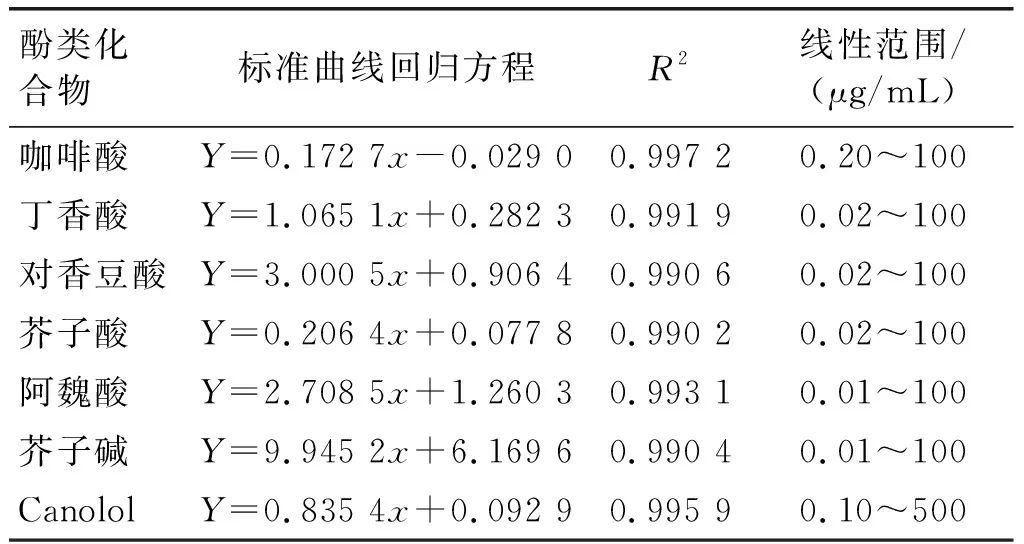
表1 酚类化合物标准曲线回归方程、R2和线性范围
2.2 LLE条件的优化
为了得到较好的提取效果,采用加标量为10 μg/g的菜籽油样品对实验中的几个重要实验参数进行优化。每种处理均测定3个平行样品,结果以“平均回收率±相对标准偏差”表示。
2.2.1 提取溶剂的体积分数
酚类化合物大多具有较强的极性,且具有一定的水溶性,因此一般采用有机溶剂与水的混合溶剂对其进行提取,而甲醇为最常用的酚类化合物提取的有机溶剂,因此本研究分别选取体积分数为60%、70%、80%、90%、100%的甲醇作为提取溶剂进行比较研究,结果见图1。

图1 甲醇体积分数对回收率的影响
由图1可知:当甲醇体积分数在60%~80%时,随着甲醇体积分数的增加,酚类化合物回收率明显增加;当甲醇体积分数大于80%时,酚类化合物回收率逐渐下降。因此,本实验选择体积分数为80%的甲醇作为提取溶剂。
2.2.2 提取溶剂的用量
分别选择每次用2、3、4、5 mL体积分数为80%的甲醇溶液提取菜籽油中的酚类化合物,结果见图2。
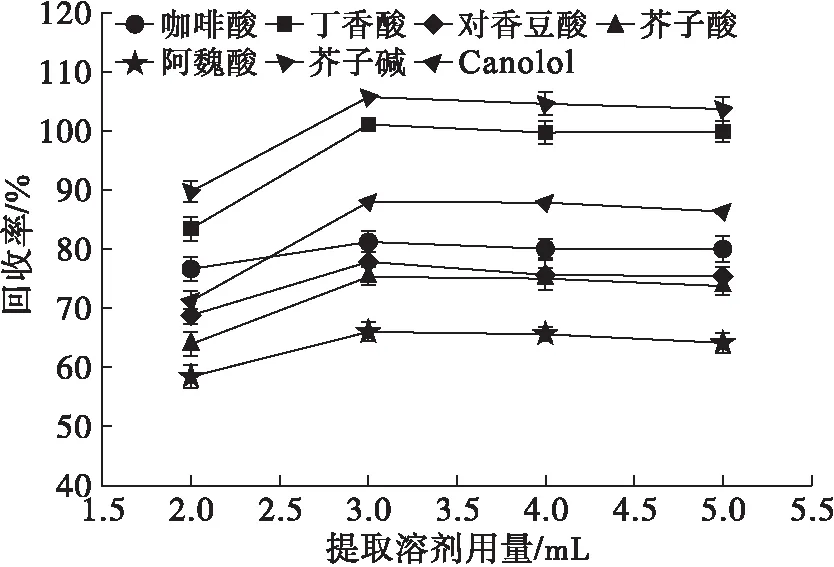
图2 提取溶剂用量对回收率的影响
由图2可知:当提取溶剂用量为2 mL时,酚类化合物的回收率较低,说明2 mL溶剂不足以使酚类化合物提取完全;提取溶剂用量增加至3 mL时,酚类化合物的回收率迅速增加;继续增加提取溶剂用量,回收率基本保持不变。说明3 mL溶剂足以将菜籽油中的酚类化合物提取完全,继续增加溶剂用量反而会造成溶剂的浪费。因此,在后续的实验中每次提取溶剂用量均设定为3 mL。
2.2.3 振摇时间
考察了振摇时间对菜籽油中酚类化合物提取效果的影响,结果见图3。

图3 振摇时间对回收率的影响
由图3可知:当振摇时间在3~5 min时,随着振摇时间的延长,酚类化合物回收率迅速上升;当振摇时间超过5 min时,回收率无明显变化。为了节省实验时间,提高操作效率,综合考虑,选择振摇时间为5 min。
2.3 SPE条件优化
采用加标量为10 μg/g的菜籽油样品对实验中的几个重要实验参数进行了优化。每种处理均测定3个平行样品,结果以“平均回收率±相对标准偏差”表示。
2.3.1 洗脱剂的种类
酚类化合物一般为极性化合物,因此本研究分析比较了极性较强的乙腈和甲醇作为洗脱剂对目标物的洗脱效果,结果见图4。
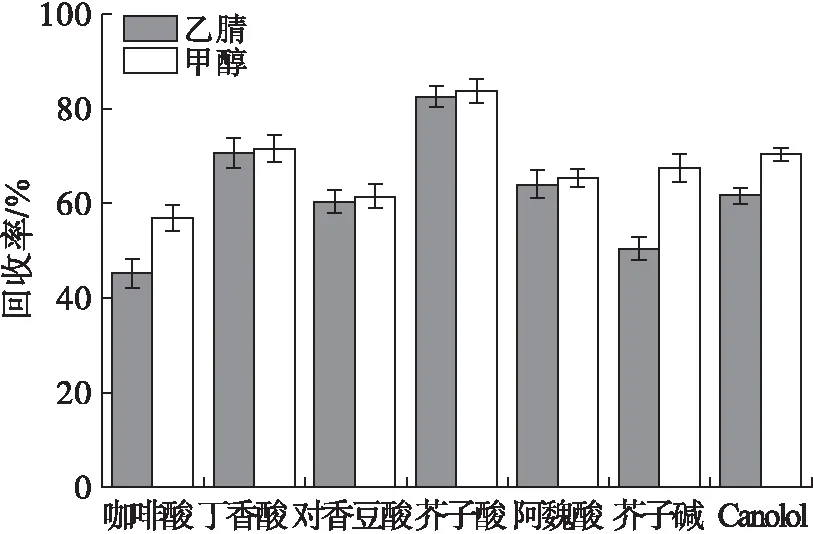
图4 洗脱剂种类对回收率的影响
由图4可知,对于咖啡酸、芥子碱和Canolol,甲醇的洗脱效果优于乙腈,对于其他酚类化合物,两种溶剂洗脱能力相差不大。综合考虑,选择甲醇作为洗脱剂。
2.3.2 洗脱剂用量
本研究分别选择3、4、5、6、7 mL的甲醇对目标物进行洗脱,结果见图5。
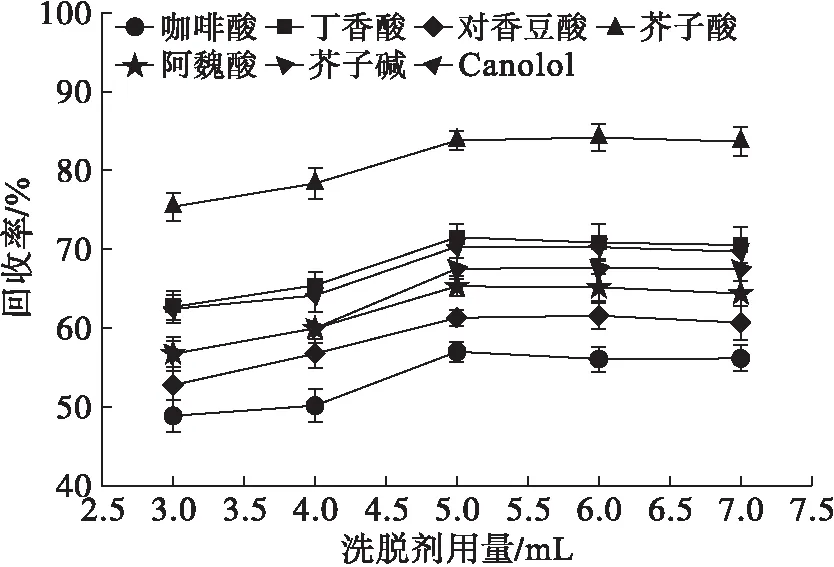
图5 洗脱剂用量对回收率的影响
由图5可知,当洗脱剂用量从3 mL增加至5 mL时,酚类化合物的回收率逐渐增加,当洗脱剂用量超过5 mL时,回收率并没有明显增加,说明继续增加洗脱剂用量并不会提高酚类化合物的回收率,反而会增大有机溶剂的排放量。因此,本研究选择洗脱剂用量为5 mL。
2.4 3种不同前处理方法的比较
2.4.1 回收率
向空白菜籽油样品中加入7种酚类化合物标准品,加标量为10 μg/g,分别用1.2.3中所述3种不同前处理方法处理空白样品和加标样品,按照1.2.5中所述LC-MS/MS方法对样品进行分析。每种处理均测定3个平行样品,结果以“平均回收率±相对标准偏差”表示,结果见表2。

表2 不同前处理方法对菜籽油中酚类化合物的回收率 %
由表2可见,QuEChERS方法对7种酚类化合物的回收率为85.16%~101.78%,相对标准偏差为1.21%~6.04%,明显优于LLE和SPE。SPE的回收率为56.98%~83.79%,相对标准偏差为4.81%~9.23%,对于咖啡酸的回收率仅为56.98%,低于QuEChERS和LLE,提取效果最不理想。这可能是SPE需要采用合适的溶剂对样品进行淋洗,在洗去杂质的同时也洗去了部分酚类化合物;另一方面,在用甲醇洗脱目标物的过程中,由于流速较快,酚类化合物与甲醇作用时间较短,因而没有被完全收集,使得回收率较低。而LLE和QuEChERS由于提取溶剂可以与目标物充分接触,因而回收率较高。
2.4.2 基质共提物含量
植物油是一种复杂的基质,在对酚类化合物进行提取的过程中会同时伴随着脂肪等基质共提物,从而对后续目标物的分析产生干扰,同时也会对色谱柱造成污染,缩短色谱柱的使用寿命。本研究比较了LLE、SPE和QuEChERS 3种不同前处理方法对菜籽油酚类化合物进行提取时基质共提物的含量,结果见表3。

表3 不同前处理方法对基质共提物含量的影响mg/g
由表3可知,QuEChERS方法的基质共提物含量最低,为2.04 mg/g,LLE的基质共提物含量最高,为6.80 mg/g。这可能是因为QuEChERS方法在传统LLE的基础上,通过低温冷冻使脂肪等杂质凝固析出[14],同时C18吸附剂除去了脂肪等非极性干扰物[15],大大降低了基质共提物的含量。
3 结 论
通过LC-MS/MS分析比较了LLE、SPE、QuEChERS 3种不同前处理方法对菜籽油中酚类化合物的提取效果。结果表明:相比于LLE和SPE,QuEChERS前处理方法的提取效果最好,对菜籽油中7种酚类化合物的回收率可达85.16%~101.78%,基质共提物含量最低,为2.04 mg/g;LLE的回收率为66.04%~101.11%,基质共提物含量最高,为6.80 mg/g;SPE的回收率最低,仅为56.98%~83.79%,基质共提物含量为2.30 mg/g。本研究证明QuEChERS方法是一种操作简便、安全可靠、准确度高的样品前处理技术,适合于菜籽油中酚类化合物的提取。

