沙棘果油纳米乳液的性质与抗氧化活性研究
蒋忠荣,张 涛,王 涛,常 明,刘睿杰,金青哲,王兴国
(江南大学 食品学院,江苏省食品安全与质量控制协同创新中心,国家功能食品工程技术研究中心,江苏 无锡 214122)
沙棘作为一种药食同源的植物,从1977年就被卫生部列入《中国药典》,而沙棘果油作为沙棘果实的精华,是沙棘中最有价值的成分之一。沙棘果油主要有两种来源,由沙棘鲜果或果浆通过水酶法或离心分离的方法获得沙棘果油[1],或由沙棘干果通过超临界、亚临界或溶剂提取等方式制得沙棘果油,也称沙棘全果油[2]。沙棘果油作为一种功能性油脂,具有独特的脂肪酸组成,不仅富含油酸和亚油酸,其棕榈油酸含量明显高于一般植物油。此外,沙棘果油中还含有丰富的生育酚、植物甾醇、类胡萝卜素、黄酮等脂质伴随物,具有优异的抗氧化效果,具有开发为营养功能丰富的脂肪乳饮料的潜在价值。但沙棘果油及其中的多种有益伴随物均为脂溶性物质,限制了其在饮料等水相中的应用。
近年来,食品级纳米乳液作为一种简单有效的包埋运输体系,已被广泛应用于功能性油脂和各种油溶性营养素的包埋与传递,能够防止功能营养成分被氧化,并提高其水溶性和生物利用率[3]。纳米乳液与普通乳液最大的区别还在于其在储存过程中可以抵抗絮凝、聚结以及重力分离,是一种“近热力学稳定”体系[4]。另外,利用乳液包埋技术可以在一定程度上降低沙棘果油的固有风味,使其更容易被消费者所接受。纳米乳液的制备方法包括高能法和低能法[3],高压均质乳化技术作为常用的高能法制备纳米乳液技术,具有乳液粒径小、分布均匀、乳液体系稳定、表面活性剂的需求量小等优势[5]。目前,利用高压均质乳化技术制备纳米乳液,已有关于红麻籽油纳米乳液[6]、姜油纳米乳液[7]、鱼油纳米乳液[8]、肉桂精油纳米乳液[9]、β-胡萝卜素纳米乳液[10]等的研究,但是还未见对沙棘果油纳米乳液的研究。
本文以酪蛋白酸钠作为乳化剂,采用高压均质的方法制备沙棘果油纳米乳液。分析5种沙棘果油样品的脂肪酸和主要脂质伴随物组成,并对制得的沙棘果油纳米乳液特性及稳定性、细胞毒性、细胞抗氧化活性进行研究,以期为沙棘果油脂肪乳产品及相关保健品开发应用提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
5种沙棘果油样品来源于5家合作企业的工厂(1、2、3号产地分别为黑龙江、甘肃、新疆,4、5号产地为青海),生产过程未添加抗氧化剂,-20℃冰箱避光保存。酪蛋白酸钠,购于上海麦克林生化科技有限公司;2′,7′-二氯荧光二乙酸盐(DCFH-DA)、2,2′-偶氮二异丁基脒二盐酸盐(ABAP),均购于美国Sigma-Aldrich公司;正己烷、异丙醇、甲醇和二氯甲烷为色谱纯,其他试剂为分析纯。
1.1.2 仪器与设备
Ultra-Turrax T25高速分散机、HPH2000/4-SH5超高压均质机,德国Ika仪器设备有限公司;Nano Brook Omni多角度粒度与高灵敏度Zeta电位分析仪,美国Brookhaven仪器公司;MS-S标准型磁力搅拌器;Fluoroskan Ascent FL荧光酶标仪、Trace GC MLtra气相色谱仪、ISQ质谱检测仪,美国Thermo公司;7820气相色谱仪,美国Agilent公司;Waters1525高效液相色谱仪,美国Waters公司。
1.2 实验方法
1.2.1 沙棘果油脂肪酸组成分析
称取0.05 g油样溶于2 mL正己烷,加入500 μL 2 mol/L的氢氧化钾-甲醇溶液,旋涡振荡混匀,离心,取上层有机相,加入适量无水硫酸钠,过膜后进行气相色谱检测。气相色谱条件参考文献[11]。
1.2.2 生育酚含量测定
称取1.0 g油样,在10 mL棕色容量瓶中用正己烷溶解定容后过膜,按参考文献[12]测定生育酚含量。
1.2.3 植物甾醇含量测定
采用气相色谱质谱联用法(GC-MS)测定沙棘果油中植物甾醇含量[13]。
1.2.4β-胡萝卜素含量测定
采用反相高效液相色谱法测定β-胡萝卜素含量,样品前处理方式参照刘慧敏[11]的方法。反相高效液相色谱条件:检测波长450 nm,流动相为甲醇-二氯甲烷(体积比7∶3),流速1.0 mL/min,进样量20 μL。
1.2.5 沙棘果油纳米乳液的制备
沙棘果油纳米乳液的制备方法在易江[14]方法的基础上稍加修改。以酪蛋白酸钠为乳化剂,配制质量分数为2%的水溶液,磁力搅拌器室温下搅拌过夜,使其充分水化。将蛋白质水溶液和5种不同来源的沙棘果油按照质量比9∶1混合,用高速分散机在20 000 r/min下剪切4 min,剪切30 s停30 s,制成粗乳液。然后用超高压均质机在均质压力100 MPa、循环次数4次的条件下制备沙棘果油纳米乳液,采用冰水浴降温。在制备过程中,所有容器均使用锡箔纸包裹,以保证沙棘果油中脂质伴随物在制备过程中尽可能少的损失。
1.2.6 沙棘果油纳米乳液特性表征
用Nano Brook Omni多角度粒度与高灵敏度Zeta电位分析仪测定沙棘果油纳米乳液的平均粒径、多分散系数(PDI)以及Zeta电位,测量角度选取90°,粒径范围选取50~250 nm,沙棘果油油滴的折射率设置为1.45,水相折射率为1.33。为降低多重光散射效应,测定前用超纯水将沙棘果油纳米乳液稀释100倍。
1.2.7 沙棘果油纳米乳液离心稳定性的测定
在Xu等[5]方法的基础上稍加修改测定沙棘果油纳米乳液离心稳定性。取100 μL沙棘果油纳米乳液样品用超纯水稀释100倍,在2 000g下离心20 min,小心吸取等量离心前后相同位置下层样品旋涡振荡后,在500 nm下测定吸光度。按照下式计算表征离心稳定性的Ke值。
1.2.8 沙棘果油纳米乳液细胞毒性的测定
参照Wolfe[15]、王立峰[16]等的方法研究沙棘果油纳米乳液的细胞毒性作用。接种量调整为2×104个/孔,去离子水清洗次数6次及以上,至无浮色。以不加沙棘果油纳米乳液样品的培养基作为对照,沙棘果油纳米乳液的半数抑制浓度(IC50)通过质量浓度-细胞存活率曲线拟合计算得到。
1.2.9 沙棘果油纳米乳液的细胞抗氧化活性评价
参照Wolfe等[15]建立的细胞抗氧化活性评价模型和张志艳[17]的细胞抗氧化活性测定方法。接种量调整为3×104个/孔,对照组无沙棘果油纳米乳液样品处理,空白组无沙棘果油纳米乳液样品处理并在弃去磷酸盐缓冲液(PBS)后添加不含ABAP的Hank平衡盐溶液(HBSS)。对每个样品绘制时间-荧光值曲线并进行积分,表征细胞抗氧化活性的CAA值通过下式进行计算。
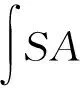
1.2.10 数据分析
每次实验均至少重复两次,求平均值,利用Origin 2018数据处理软件作图并计算平均值和标准差。
2 结果与讨论
2.1 沙棘果油的主要组成
2.1.1 脂肪酸组成
5种沙棘果油样品脂肪酸组成及相对含量如表1所示。
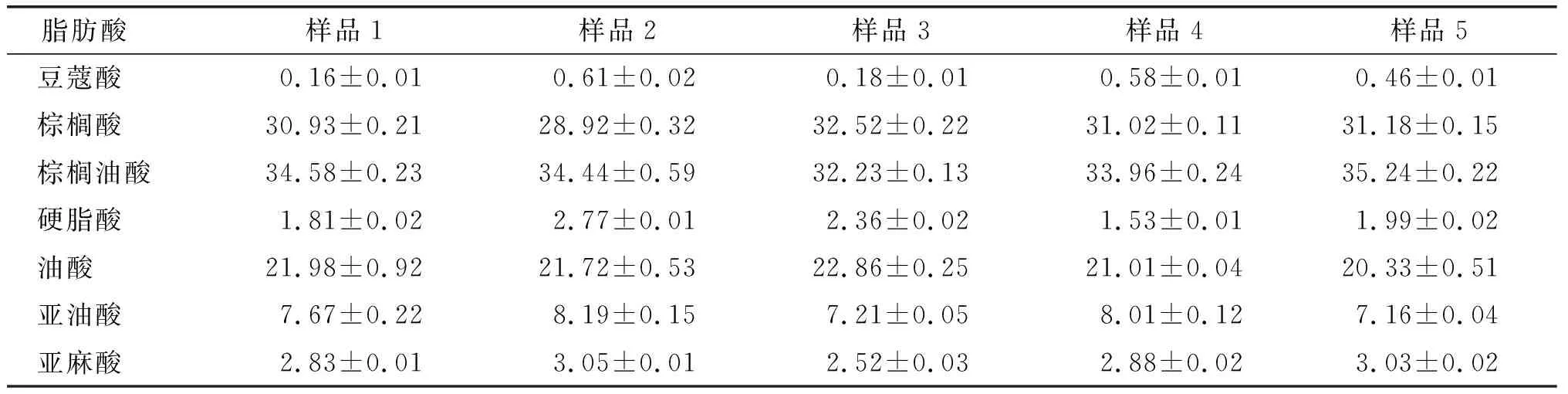
表1 沙棘果油的脂肪酸组成及相对含量 %
由表1可知,5种沙棘果油样品的主要脂肪酸包括不饱和脂肪酸如棕榈油酸(32.23%~35.24%)、油酸(20.33%~22.86%)、亚油酸(7.16%~8.19%)和亚麻酸(2.52%~3.05%),以及饱和脂肪酸如棕榈酸(28.92%~32.52%)和硬脂酸(1.53%~2.77%),总体脂肪酸含量差异不大。单不饱和脂肪酸占54.97%~56.56%,其中棕榈油酸含量高达32.23%~35.24%,这是沙棘果油脂肪酸组成区别于一般植物油的特点。棕榈油酸是一种n-7单不饱和脂肪酸,主要存在于鱼油或海洋浮游生物中,在一般油料作物中含量较少,目前由于其具有改善胰岛素抵抗、调节糖脂代谢的生理功能备受关注。
2.1.2 脂质伴随物
沙棘果油含有丰富的有益脂质伴随物,5种沙棘果油样品生育酚、植物甾醇、β-胡萝卜素组成及含量如表2所示。
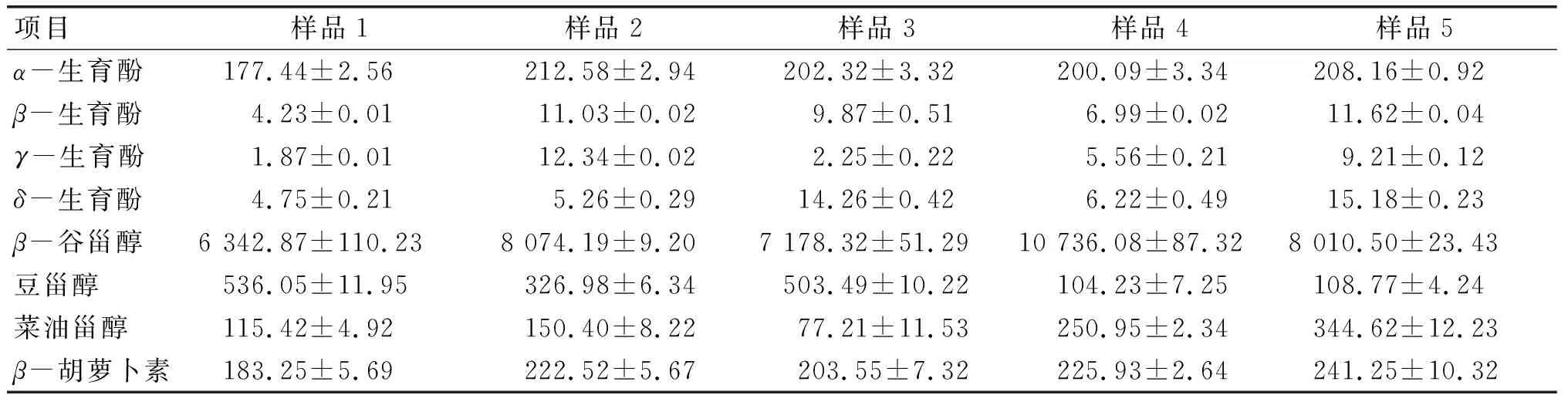
表2 沙棘果油脂质伴随物组成和含量 mg/kg
由表2可知,5种沙棘果油样品的生育酚总量在188.28~244.18 mg/kg的范围内波动,其中85%以上为α-生育酚,而β-生育酚、γ-生育酚和δ-生育酚含量很少。植物甾醇中β-谷甾醇、豆甾醇和菜油甾醇总量在6 994.34~11 091.26 mg/kg之间,4号沙棘果油3种甾醇总量(11 091.26 mg/kg)和β-谷甾醇含量(10 736.08 mg/kg)明显优于另外4种样品。5种沙棘果油样品中β-胡萝卜素含量(183.25~241.25 mg/kg)均较高,这是沙棘果油呈现黄色或橙红色的主要原因。
2.2 沙棘果油纳米乳液的特性表征(见表3)
从表3可以看出,经过高压均质后,5种沙棘果油纳米乳液平均粒径范围在156.3~173.4 nm之间,相比经过剪切预乳化的粗乳液粒径(大于1 200 nm)有明显的减小,均达到纳米级别(小于200 nm)。5种沙棘果油纳米乳液的PDI小于0.3,说明沙棘果油纳米乳液均匀程度良好[18]。在相同的乳化剂比例和均质条件下,不同来源的沙棘果油制得的乳液平均粒径和PDI等乳液性质存在一定的差异,可能是由于油相中脂肪酸以及脂质伴随物组成不同,导致乳化剂与油相的分布出现差异,进而使乳液特性产生差异。Zeta电位分析的数据表明沙棘果油乳滴颗粒带负电且绝对值较大,这是由于酪蛋白酸钠在该水相体系中带负电,形成水包油型纳米乳液颗粒的过程中酪蛋白酸钠会包裹覆盖于油滴表面形成球状,使乳液颗粒带负电,电荷绝对值越大说明体系越稳定[19]。5种沙棘果油纳米乳液Ke小于15%,具有较强的离心稳定性。
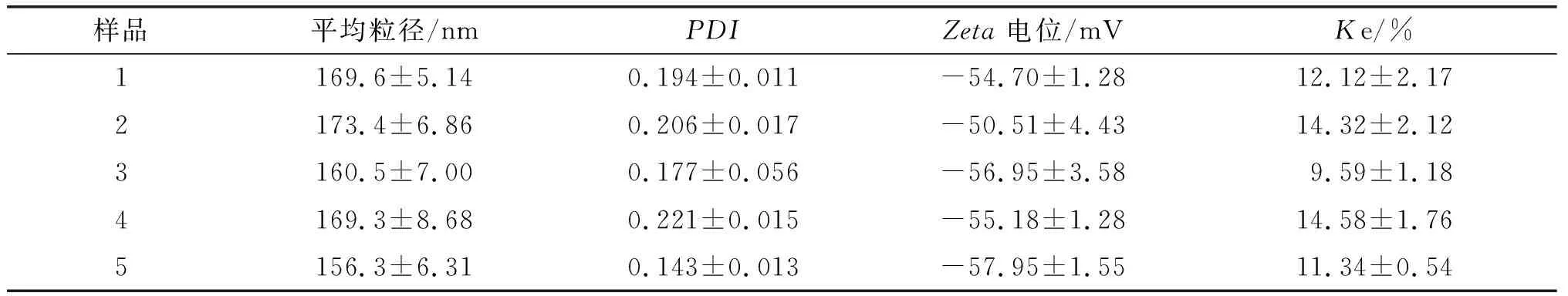
表3 5种沙棘果油纳米乳液的特性表征
2.3 沙棘果油纳米乳液的细胞毒性
图1为采用1号沙棘果油纳米乳液样品,以质量浓度分别为10、40、80、160、320、960、1 280、1 920、2 560、3 200 μg/mL的沙棘果油纳米乳液作用HepG2细胞24 h,然后检测细胞存活数量,以细胞存活率为纵坐标,沙棘果油纳米乳液质量浓度为横坐标制作的曲线。由图1可以看出,样品1作用HepG2细胞24 h后,随着沙棘果油纳米乳液质量浓度的升高,HepG2细胞存活率下降,通过拟合计算得到沙棘果油纳米乳液对HepG2细胞的IC50为1 443 μg/mL。
图2为100 μg/mL的5种沙棘果油纳米乳液的细胞存活率。由图2可知,在5种沙棘果油纳米乳液的质量浓度均为100 μg/mL时,处理HepG2细胞24 h后细胞存活率能够达到90%以上,细胞毒性小于等于10%,可视为无细胞毒性。
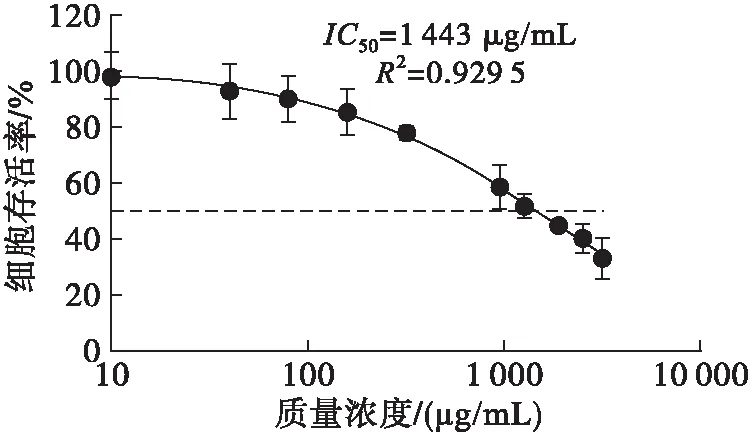
图1 样品1的质量浓度-细胞存活率曲线
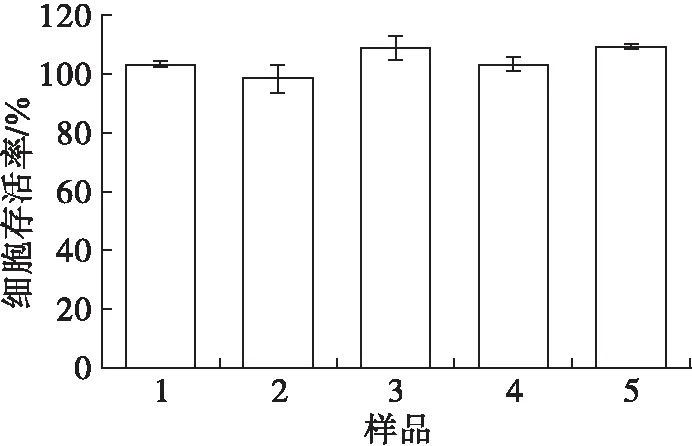
图2 5种沙棘果油纳米乳液(100 μg/mL)的细胞存活率
2.4 细胞抗氧化活性标准曲线(见图3、图4)
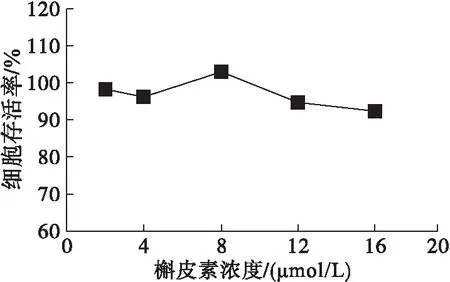
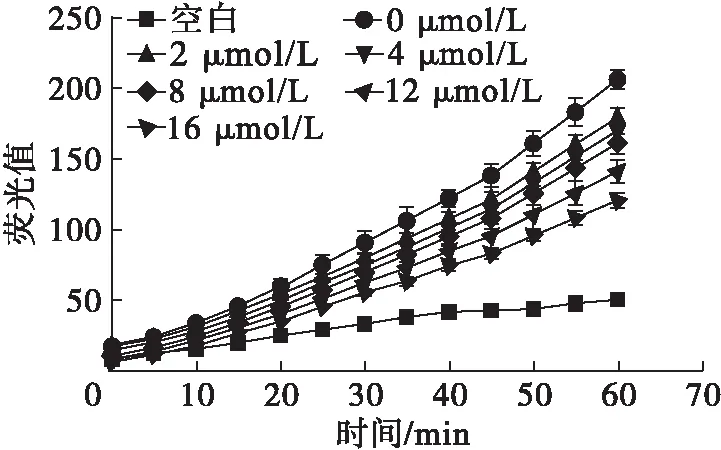
图3 不同浓度槲皮素的细胞毒性及时间-荧光值曲线
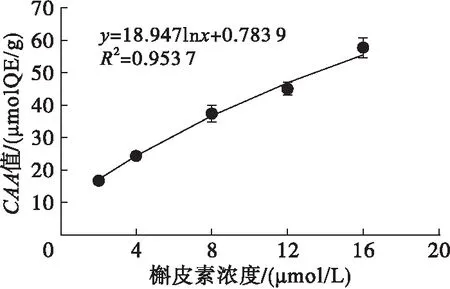
图4 不同浓度槲皮素的CAA值
由图3可以看出,槲皮素在0~16 μmol/L浓度范围内处理HepG2细胞时,细胞存活率均在90%以上,表明无细胞毒性。进一步考察不同浓度槲皮素处理后,加入自由基引发剂ABAP后1 h内荧光值随时间变化的动力学曲线,结果表明,槲皮素浓度越大,同一时刻酶标仪检测出的荧光值越小,对自由基引发剂诱发荧光的过程抑制效果越明显[15]。对每一条曲线进行积分,通过公式计算得到浓度范围为0~16 μmol/L的槲皮素所对应的CAA值(见图4),并得到回归方程y=18.947lnx+0.783 9(R2=0.953 7)。CAA值越大,表征抗氧化物质的细胞抗氧化活性越强,并可以通过拟合的回归方程对抗氧化物质的细胞抗氧化活性进行定量。
2.5 沙棘果油纳米乳液的细胞抗氧化活性
根据细胞毒性实验结果,选取100 μg/mL的5种沙棘果油纳米乳液和100 μg/mL的橄榄油纳米乳液(GL)进行细胞抗氧化活性评价,结果见图5。
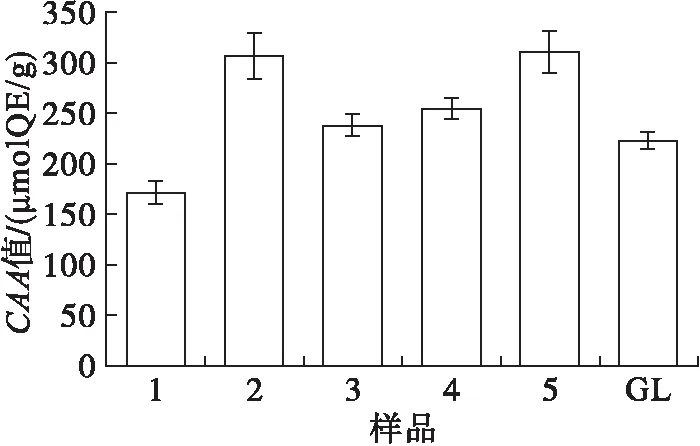
图5 以槲皮素定量的沙棘果油纳米乳液及橄榄油纳米乳液的CAA值
由图5可知,5种沙棘果油纳米乳液的CAA值分别为(171.88±11.43)、(307.71±22.19)、(238.03±10.30)、(255.24±10.83)、(310.54±21.35)μmolQE/g,橄榄油纳米乳液的CAA值为(222.89±13.43)μmolQE/g。结果表明:除1号样品外,沙棘果油纳米乳液均表现出更好的细胞抗氧化活性。同时,2号和5号样品的细胞抗氧化活性最强,1号样品的细胞抗氧化活性最弱,可能与1号样品的脂质伴随物含量较少有关,有待进一步研究。
3 结 论
以食品级的酪蛋白酸钠作为乳化剂,采用高压均质的方法制备沙棘果油纳米乳液并对其相关性质进行了研究。结果表明:沙棘果油主要脂肪酸包括棕榈油酸、棕榈酸、油酸和亚油酸,其中棕榈油酸含量高达32.23%~35.24%,与一般植物油有明显区别;总生育酚含量为188.28~244.18 mg/kg,植物甾醇含量为6 994.34~11 091.26 mg/kg,β-胡萝卜素含量为183.25~241.25 mg/kg;制得沙棘果油纳米乳液平均粒径范围在156.3~173.4 nm,PDI小于0.3,Zeta电位的范围在-50.51~-57.95 mV,Ke小于15%,乳液体系均匀,稳定性良好。
在高质量浓度情况下沙棘果油纳米乳液对HepG2细胞具有一定的抑制作用,IC50为1 443 μg/mL,并且100 μg/mL的5种沙棘果油纳米乳液的CAA值分别为171.88、307.71、238.03、255.24、310.54 μmolQE/g,除1号样品外,均优于相同质量浓度的橄榄油纳米乳液(CAA值为222.89 μmolQE/g),表现出良好的细胞抗氧化活性。

