HepG2细胞中SDR9C7蛋白的亚细胞定位研究
周 洁,曾志鹏,李金月,陈俏媛,林万华*
(1. 广西高校干细胞与医药生物技术重点实验室(广西师范大学),广西 桂林 541004;2. 广西师范大学 生命科学学院,广西 桂林 541006)
在生物界短链脱氢/还原酶SDR(short chain dehydrogenase/reductase, SDR)基因家族成员众多,目前仅在人类基因组中就发现了75个SDR蛋白[1],它们在物质代谢途径和信号传递中起着关键的调控作用,已经证实SDR酶的缺陷或功能丧失往往会导致疾病的产生,其中一些SDR基因已被证实与疾病(如阿尔茨海默症、癌症)以及肥胖等的发生密切相关[2-4]。SDR9C7是短链脱氢/还原酶(SDR)蛋白超家族成员之一,目前人们还没有找到SDR9C7作用底物,故又称其为SDRO(short chain dehydrogenase/reductase orphan,SDRO)。Chen Weiguo等[5]首先从小鼠胚胎和人胚胎的RNA中克隆出SDR9C7基因,发现二者翻译成蛋白质后的氨基酸序列进化上高度保守,有83%相似性。蛋白氨基酸序列分析结果表明SDR9C7含有SDR蛋白家族保守的特征性模序,如甘氨酸富含区TGxxxGxG和催化区YxxxK,N端也有Rossmann保守区[5]。mSDR9C7基因在小鼠胚胎期第7天就开始表达,但在成年鼠和成人体内只有肝脏组织中特异性高表达。虽然在染色体位置上与具有维甲酸或羟基类固醇脱氢酶活性的CRAD1、CRAD2和RDH4基因串联,基因序列上与大鼠RoDH1、小鼠RDH1高度保守(相似度高达69%~70%),但SDR9C7并没有表现出维甲酸脱氢酶、3α-和20α-羟基类固醇脱氢酶、17β-和11β-羟基类固醇脱氢酶的活性,其确切功能仍不清楚。Kowalik等[6]采用N端或C端分别标记Flag或His标签蛋白,免疫荧光法检测了SDR9C7蛋白在Hela细胞的分布情况,发现SDR9C7在细胞内呈典型颗粒状分布于细胞质中,但并没有亚细胞器如过氧化物酶体、早期内涵体、线粒体、内质网或细胞核共定位结合。
研究表明脂滴在脂质和蛋白质的细胞处理中起着重要和多样的作用,包括疏水性维生素和信号传导 前体的储存、内质网和氧化应激的管理、细胞和病毒多肽的成熟,储存和更新[7]。HepG2细胞的油酸诱导单纯性肝脂肪变性细胞模型已是一种较为成熟的模型,常用于肝脏细胞脂肪变性机理及小分子化合物改善作用与分子机理的研究[8-10]。饥饿诱导细胞自噬模型也常用于对自噬体与自噬机理的研究[11-12]。虽然有研究发现SDR9C7蛋白其在细胞内呈颗粒状分布,动物出生后SDR9C7基因仅在肝脏组织中特异性高表达,但迄今为止其具体生物学功能和确切亚细胞定位仍未知。对基因表达蛋白的亚细胞定位进行分析,能对基因功能的研究带来很好的提示作用,也有助于对其功能做出合理的解释。为此本文采用细胞免疫组化、激光共聚焦显微镜观察法,分别检测SDR9C7蛋白与油酸诱导单纯性肝脂肪变性HepG2细胞模型中的脂滴、饥饿诱导的HepG2细胞自噬模型中的自噬体和正常培养的HepG2细胞中的高尔基体的共定位情况。
1 材料与方法
1.1 材料与试剂
人肝肿瘤细胞株HepG2(本室保存),HepG2细胞完全培养基为DMEM+10%FBS+1%双抗(青/链霉素100 U/mL);DMEM、胎牛血清、PBS均购自于Hyclone公司;高尔基体标志蛋白抗体Anti-GM130、自噬体标志蛋白抗体Anti-LC3B、脂滴标志蛋白抗体Anti-Perilipin A/B(SIGMA公司);Anti-Mouse Ig-CFL555,Anti-Rabbit IgG-CFL488(SANTA CRUZ公司)。SDR9C7蛋白抗体Anti-SDR9C7(SIGMA公司),激光共聚焦显微镜(LSM 710 on Inverted Stands)。
1.2 实验方法
1.2.1 细胞培养、脂滴及自噬的形成
使用含有10%胎牛血清DMEM培养基,在体积分数为5%的CO2、37 ℃条件下培养HepG2细胞,待细胞准备传代时,胰蛋白酶消化接种至24孔板,挑取8孔放入爬片,平均每孔接种2.5×105个细胞,分别使用浓度为0.1、0.2、0.3、0.4 mmol/L的油酸刺激细胞24 h,以形成脂滴。为促进自噬体的形成,对细胞进行无血清饥饿培养24 h。以正常培养的HepG2细胞做高尔基体免疫共定位,设置空白对照组。
1.2.2 细胞免疫荧光
吸取孔中的培养基,每孔加入1 mL PBS,洗涤细胞3次,洗涤时轻摇孔板,以确保细胞形态的完整性。吸去PBS,加入300 μL 4%多聚甲醛,室温下固定30 min。吸取多聚甲醛,PBS洗涤3次,每次洗涤时间不少于5 min,加入300 μL渗透液(含有1%Trition-X100、5%山羊血清的PBS),37 ℃放置30 min。吸去渗透液,PBS洗涤3次,每次洗涤时间不少于5 min,加入300 μL封闭液(含有5%山羊血清的PBS)。37 ℃放置1 h。吸去封闭液,PBS洗涤细胞3次,每次洗涤不少于5 min。将按抗体说明书稀释的SDR9C7抗体分别与同样按抗体说明书稀释的脂滴标志蛋白抗体Anti-Perilipin A/B、自噬体标志蛋白抗体Anti-LC3B、高尔基体标志蛋白抗体Anti-GM130同比例(体积比)混匀;每孔加入300 μL,孵育细胞4 ℃过夜。吸去一抗,PBS洗涤3次,每孔中加入300 μL按一定比例稀释的Goat Anti-Mouse Ig-GFL555、Goat Anti-Rabbit IgG-CFL488的二抗,37 ℃孵育1 h。吸取二抗,PBS洗涤3次,每次洗涤时间不少于5 min,加入300 μL DAPI溶液,染核15 min。吸去DAPI,PBS洗涤细胞3次,每次洗涤时间不少于5 min,加入适量抗荧光猝灭封片液,在激光共聚焦下进行观察拍照。
2 实验结果
2.1 SDR9C7蛋白与脂滴的共定位结果
使用0.1 mmol/L至0.4 mmol/L的不同浓度油酸刺激HepG2细胞24 h,细胞免疫荧光(Anti-SDR9C7+Anti-Perilipin A/B)结果如图1所示。由图可见,脂滴主要分布于细胞质,并随油酸刺激浓度增加而增加,结果显示SDR9C7为全细胞分散分布,没有呈颗粒状与脂滴共定位。
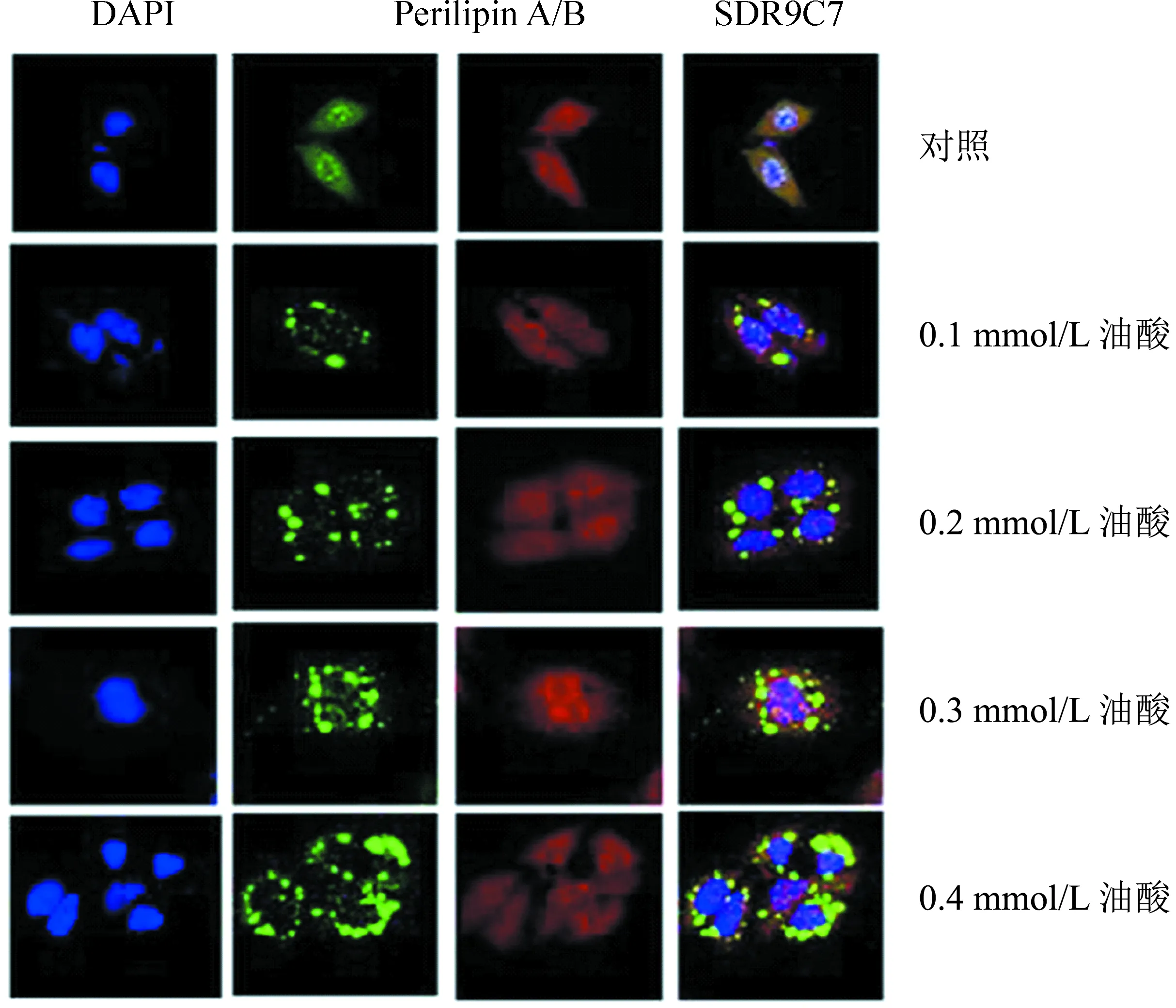
图1 SDR9C7蛋白与脂滴在HepG2细胞中的亚细胞定位分析Fig.1 Subcellular localization of SDR9C7 protein and lipid droplets in HepG2 cells
2.2 SDR9C7蛋白与自噬体共定位结果
细胞免疫荧光(Anti-SDR9C7+Anti-LC3B)结果(图2)表明,HepG2细胞在经过无血清培养饥饿24 h后,与未经过饥饿处理的细胞相比,自噬体增多,但SDR9C7为全细胞分散分布,没有呈颗粒状与自噬体共定位。
2.3 SDR9C7蛋白与高尔基体共定位结果
使用DMEM+10%FBS+1%双抗(青链霉素)培养HepG2细胞,细胞免疫荧光(Anti-SDR9C7+ Anti-GM130)结果(图3)表明,高尔基体分布于细胞核周围,SDR9C7为全细胞分散分布,没有呈颗粒状与高尔基体共定位。
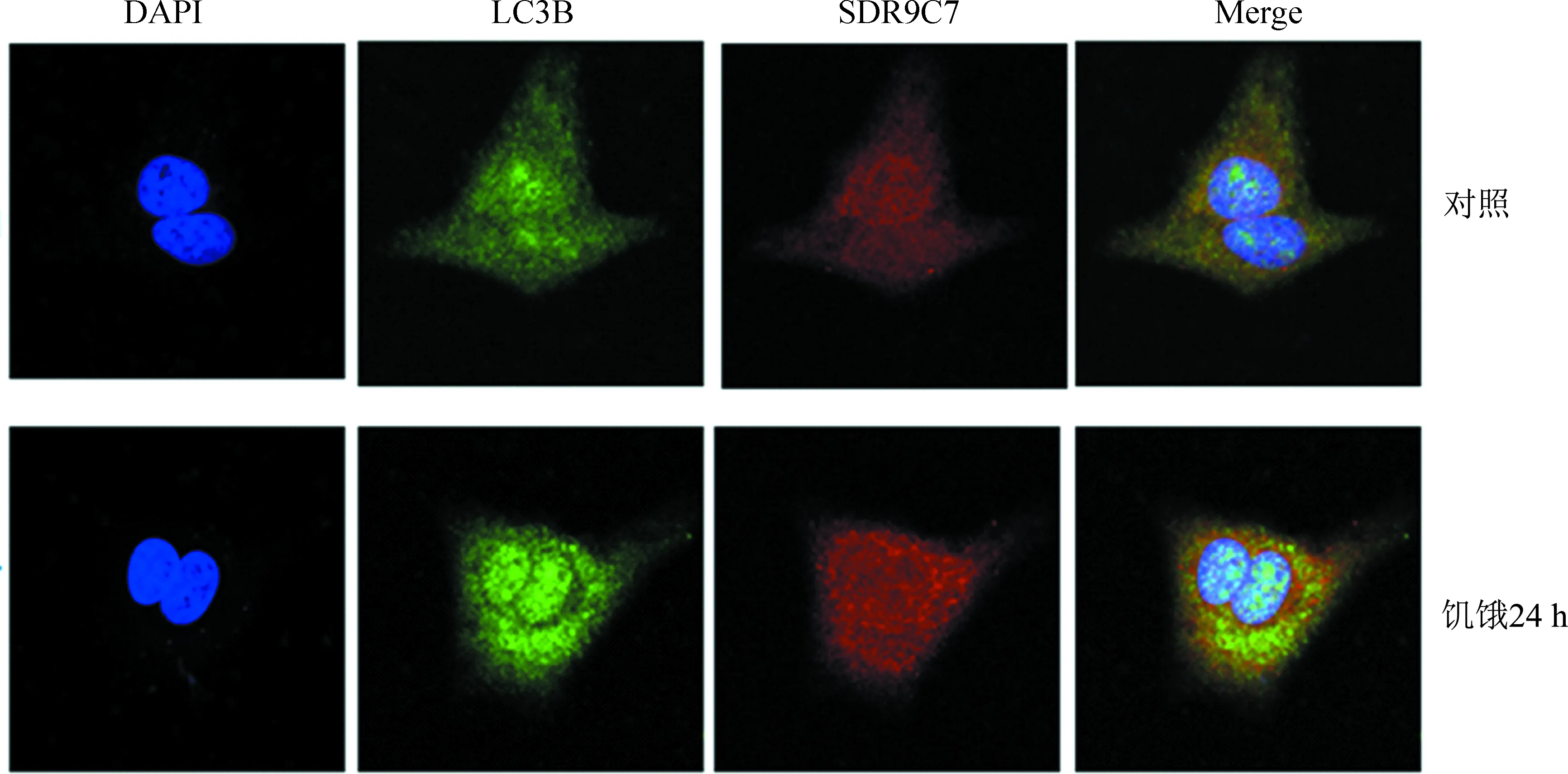
图2 SDR9C7蛋白与自噬体在HepG2细胞中亚细胞定位分析Fig.2 Subcellular localization of SDR9C7 protein and autophagosomes in HepG2 cells
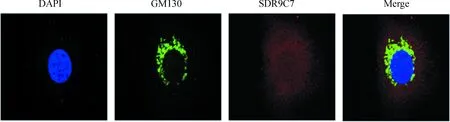
图3 SDR9C7蛋白与高尔基体在HepG2细胞中亚细胞定位分析Fig.3 Subcellular localization of SDR9C7 protein and Golgi apparatus in HepG2 cells
3 讨论
Kowalik等对N端或C端分别加有标签蛋白Flag或His的SDR9C7融合蛋白的亚细胞定位进行了研究,免疫荧光法检测发现SDR9C7在细胞内呈典型颗粒状分布于细胞质中,但并不与亚细胞器如过氧化物酶体、早期内涵体、线粒体、内质网或细胞核结合[6]。由于在成年鼠和成人体内肝脏组织特异性高表达SDR9C7蛋白,为此本文采用免疫荧光法对人肝细胞系HepG2细胞中的SDR9C7蛋白与亚细胞结构脂滴、自噬体和高尔基体的共定位情况进行了检测,但发现SDR9C7为全细胞分散分布,没有呈颗粒状,也没有与脂滴、自噬体和高尔基体的共定位,说明SDR9C7并没有直接参与脂滴形成、细胞的自噬再循环活动等,与高尔基体也无直接联系。目前有较多文献报道SDR9C7基因突变与常染色体隐性遗传先天性鱼鳞病(ARCI)相关,如提出SDR9C7基因突变造成维生素A代谢途径异常导致ARCI[13],或认为SDR9C7缺乏引起的LI的病理机制可能涉及角质细胞中脂质的异常代谢和合成缺陷,导致角质层细胞间脂质层畸形[14-15]。肝脏是维生素A和脂肪酸代谢的重要场所,本文研究发现SDR9C7为全细胞分散分布,其具体功能有待进一步研究。

