PEI功能化秸秆生物炭对水中Cr6+的吸附性能
徐建玲, 张 頔, 聂苗青, 王汉席, 李龙威
(国家环境保护湿地生态与植被恢复重点实验室, 东北师范大学环境学院, 长春 130117)
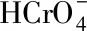
1 实验部分
1.1 试剂与仪器
重铬酸钾、 氢氧化钠、 浓硝酸, 分析纯, 北京化工厂; 二苯碳酰二肼, 分析纯, 天津书光复精细化工研究所; 戊二醛, 分析纯, 天津市华东试剂厂; 聚乙烯亚胺, 分析纯, 成都化夏化学试剂有限公司.
SK-G06123K型管式电炉, 天津中环电炉股份有限公司; UVmini-1280型紫外-可见分光光度计, 日本岛津公司; HITACHI-SU8010型场发射扫描电子显微镜, 日本日立公司; ASAP 2020 plus HD88型比表面及孔隙度分析仪, 美国麦克公司; Nicolet-IS10型红外光谱仪, 美国赛默飞公司.
1.2 实验过程
1.2.1 PEI生物炭的制备 将玉米秸秆原材料洗净, 放入500 ℃电炉中缺氧裂解6 h后, 得到秸秆生物炭(CBC). 分别用50%(质量分数)H2SO4和3 mol/L KOH对CBC进行改性, 制得酸改性生物炭(Acid-biochar)和碱改性生物炭(Alkali-biochar). 将酸改性生物炭和碱改性生物炭分别加入到10%(质量分数)PEI-甲醇溶液中, 震荡30 min后迅速转移到1%(质量分数)戊二醛溶液中进行交联, 洗涤后烘干, 即制得PEI酸性生物炭(HBC)和PEI碱性生物炭(PBC).
1.2.2 吸附实验 将0.05 g生物炭加入到50 mL浓度变化范围为10~1000 mg/L的Cr6+溶液中, 在140 r/min转速下吸附640 min, 测定溶液中Cr6+的浓度, 进行等温吸附实验. 分别使用1 mol/L HNO3和NaOH调节溶液pH值为2.0, 4.0, 6.0, 8.0, 10.0, 进行吸附实验. 为了评价生物炭的稳定性, 进行吸附-解吸附连续周期实验, 使用1 mol/L盐酸将0.2 g进行吸附实验后的PBC处理1 h, 用去离子水洗涤后烘干备用. 将烘干后的生物炭加入到50 mL 100 mg/L的Cr6+溶液中吸附640 min, 周期实验连续重复6次.
1.2.3 结构表征 使用比表面及孔隙度分析仪测定生物炭的比表面积和孔径分布情况[16]; 使用红外光谱仪测定生物炭的表面官能团[16]; 使用场发射扫描电子显微镜分析生物炭的结构特征[17].
1.2.4 数据分析及吸附理论 生物炭对溶液中Cr6+的吸附量(qt)和去除率(Q, %)计算如下:
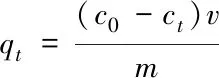
(1)
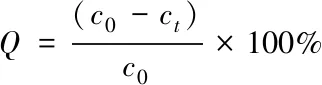
(2)
式中:qt(mg/g)为t时刻的吸附量;c0(mg/L)为溶液初始浓度;ct(mg/L)为溶液t时刻浓度;v(mL)为溶液体积;m(mg)为CBC和PBC质量.
动力学吸附采用一级动力学方程和二级动力学方程对实验结果进行拟合[18,19]:
dqt/dt=k1(qe-qt)
(3)
dqt/dt=k2(qe-qt)2
(4)
式中:qe(mg/g)为平衡时的吸附量;k1(min-1)为一级动力学常数;k2(g·mg-1·min-1)为二级动力学常数;t(min)为时间.
等温吸附采用Langmuir方程和Freundlich方程进行拟合, Langmuir吸附模型是一种单分子层吸附模型, 认为吸附质并非吸附在吸附剂的整个表面, 而是吸附在吸附剂表面特定的点位上. Freundlich等温吸附式是一个经验方程, 通常认为, 1/n的数值越小, 吸附剂的吸附性能越好, 当1/n>2时, 吸附较难进行. Langmuir方程和Freundlich方程如下[20,21]:
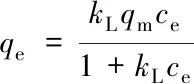
(5)
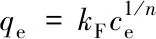
(6)
式中:qm(mg/g)为饱和时的最大吸附量;ce(mg/L)为平衡浓度;kL(L/mg)为Langmuir吸附特征常数;kF和n为Freundlich吸附特征常数. 所有吸附实验重复3次, 结果取平均值.
2 结果与讨论
2.1 PEI生物炭复合材料吸附Cr6+效果对比
在吸附温度为318 K, Cr6+初始浓度为100 mg/L条件下控制吸附时间为2 h, CBC, HBC和PBC对水中Cr6+的吸附效果如图1所示.
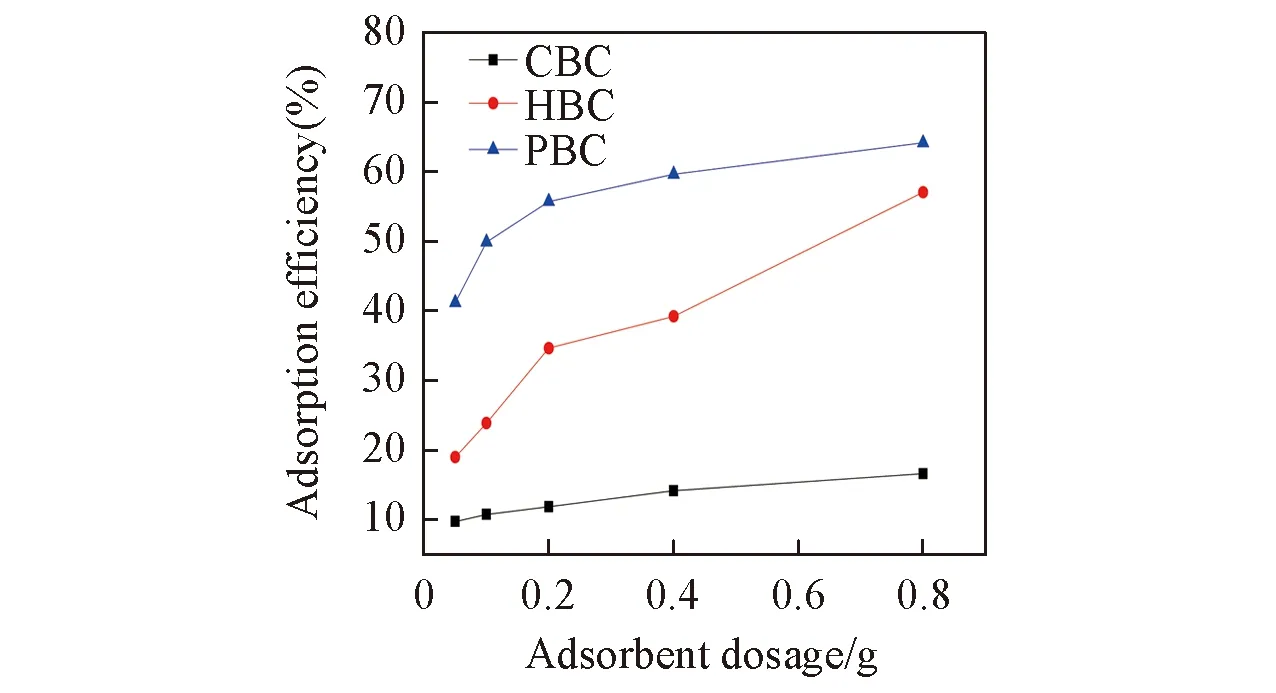
Fig.1 Comparison of adsorption efficiency of CBC and PEI biocharcoal composites
由图1可知, 在吸附剂添加量相等、 吸附条件相同的情况下, 相对于原始生物炭, 负载PEI的生物炭复合材料对水中Cr6+的吸附效果明显提高, 其中PBC的吸附效率比CBC提高4倍, 且明显高于HBC. 是由于生物炭对重金属的吸附以静电作用和络合作用为主[22], 在吸附初期主要以络合作用为主, 而络合作用主要来自于生物炭经过碱改性后表面存在的羟基等官能团, 而经过PEI修饰后, 生物炭表面被引入大量的胺基, 对水中Cr6+吸附也具有重要作用, 生物炭的改性过程如图2所示. 因此, 选取PBC进行后续研究, 探究其对水中Cr6+吸附的热力学特征及吸附效率的影响因素.
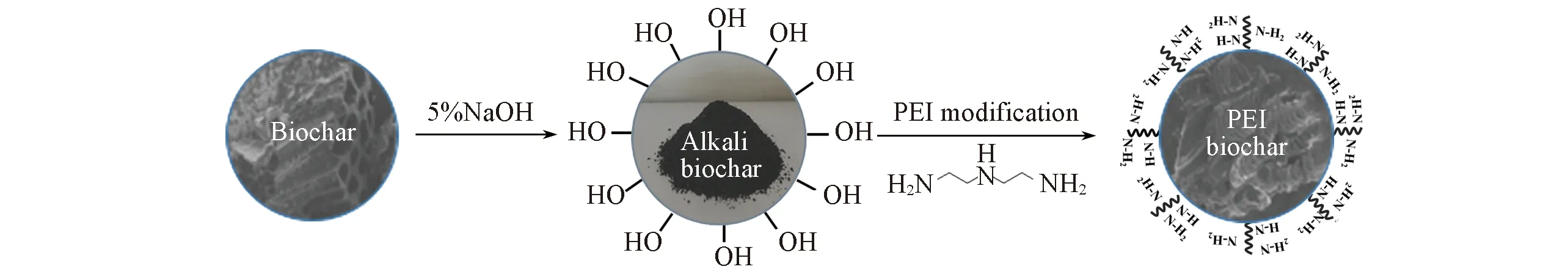
Fig.2 Schematic diagram of preparation process of modified biochar
2.2 比表面积及孔径分析
表1列出了CBC和PBC的比表面积、 孔体积和平均孔径. 由表1可见, BET比表面积由CBC的1.3047 m2/g增至PBC的1.4934 m2/g, 生物炭的微孔面积由CBC的1.3425 m2/g减至PBC的0.0499 m2/g, 微孔体积从CBC的0.728×10-3cm3/g降至PBC的0.017×10-3cm3/g, 可能是由于PEI为黏稠状液体, 用于修饰生物炭时会占据其表面的微孔孔隙[23]. 由孔径分析可知, CBC表面只存在微孔, PBC表面同时存在微孔和介孔2种孔隙, 其中介孔面积为2.4137 m2/g, 介孔的出现使PBC的比表面积较CBC有所增加[24], 也为Cr6+的吸附提供了更多的吸附位点, 因此, PBC对Cr6+的吸附效果优于CBC.
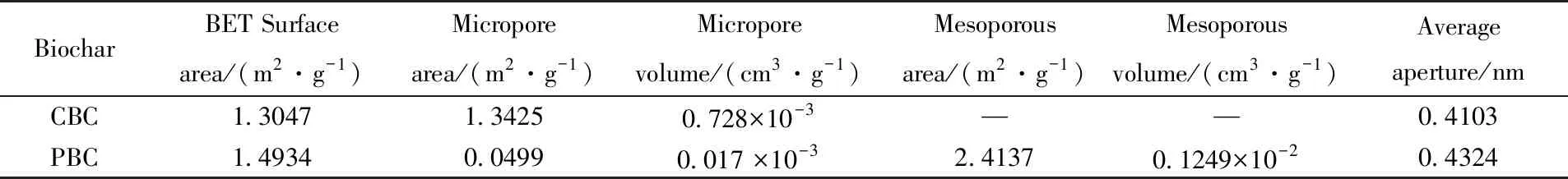
Table 1 Specific surface area/aperture analysis of CBC and PBC
2.3 SEM和红外光谱分析
CBC外观呈现黑色, 颗粒比较疏松, 而PBC则呈现砖红色, 颗粒状更加明显. 采用扫描电镜进一步分析生物炭改性前后表面的形貌变化, 结果如图3所示. 可以看出, CBC和PBC的表面形貌结构具有明显的差异, CBC的表面较为粗糙且有很多不规则的孔隙; 而经PEI修饰后的生物炭表面很光滑, 分布着很多细小的颗粒物, 更利于吸附过程的进行.

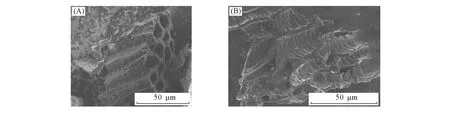
Fig.3 SEM images of CBC(A) and PBC(B)
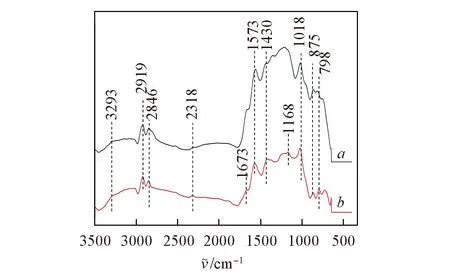
Fig.4 Infrared spectra of CBC(a) and PBC(b)
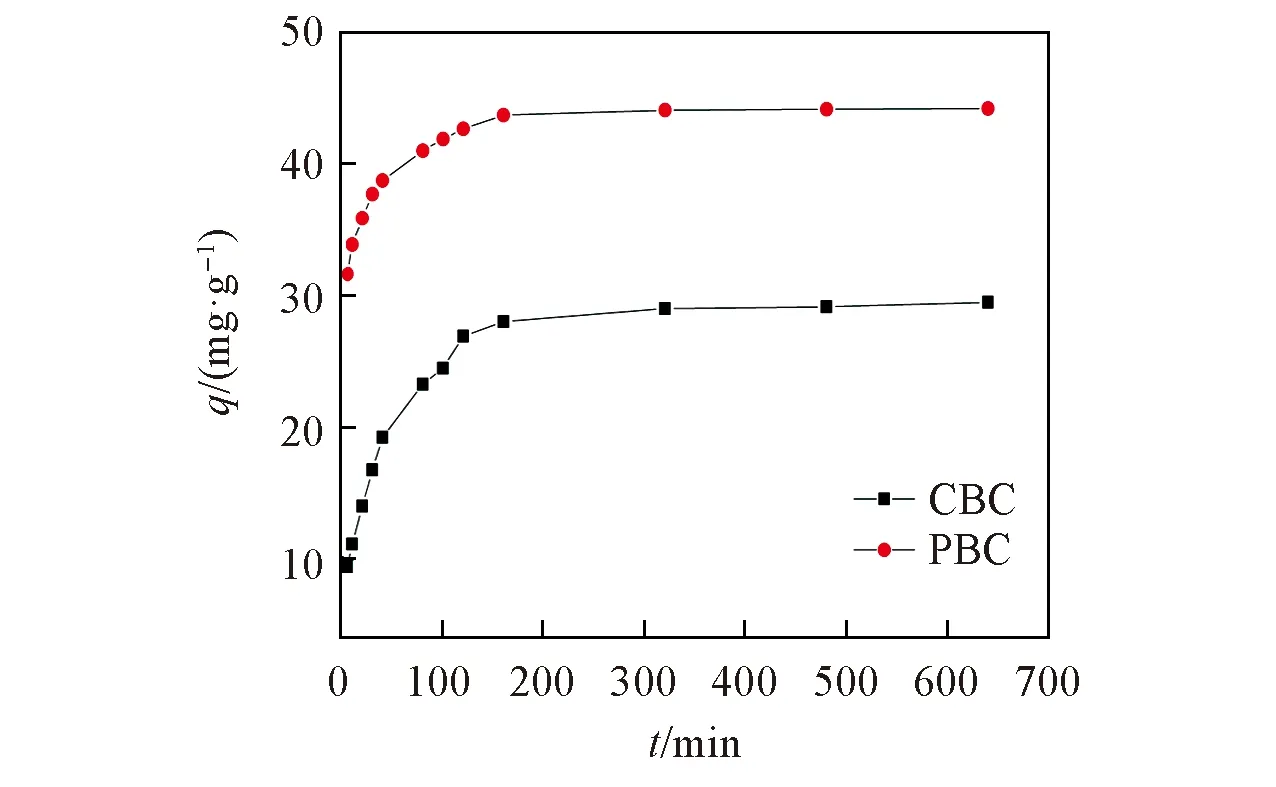
Fig.5 Effect of adsorption time on the adsorption effect of Cr6+
2.4 动力学吸附
Cr6+的吸附量随时间变化曲线见图5. 结果表明, 当Cr6+的初始浓度为100 mg/L时, PBC对Cr6+的吸附量明显大于CBC, 2种生物炭对Cr6+的吸附趋势基本相同. 由图5可知, 0~50 min为吸附反应的快速吸附阶段, CBC和PBC对Cr6+的吸附效率随着吸附时间的增加而快速增加; 50~200 min为缓慢吸附阶段, 在此时间段内吸附效率增加速度随着时间的推移逐渐变缓; 300 min后吸附效率变化趋于平缓, 达到吸附平衡状态. 原因在于生物炭表面能够有效吸附Cr6+的吸附位点数量有限[26], 随着吸附反应的不断进行, 生物炭表面的吸附位点逐渐被Cr6+占据. 同时, 生物炭表面吸附的Cr6+与溶液中的Cr6+产生静电排斥作用, 导致溶液中Cr6+的生物炭表面吸附受到静电力阻碍. 此外, 随着吸附反应的不断进行, 生物炭表面的Cr6+浓度与溶液中Cr6+的浓度梯度逐渐减小, Cr6+溶液对生物炭吸附Cr6+的推动力逐渐减小[27], 因此吸附速率逐渐减小, 最终达到吸附平衡.
表2为CBC和PBC对Cr6+吸附动力学参数拟合结果. 拟合结果表明, 二级动力学方程对CBC和PBC吸附Cr6+过程拟合效果更好. 同时, 用一级动力学方程计算出的qe明显小于实际吸附量, 而用二级动力学方程计算出的qe与实际吸附量相差不多, 也说明二级动力学方程更适合反映CBC和PBC对Cr6+的吸附过程. 二级动力学模型假定吸附过程受化学吸附机理的控制, 吸附剂与吸附质之间存在电子共用或电子转移作用, 因此, 拟合结果说明CBC和PBC对Cr6+的吸附主要以化学吸附为主.
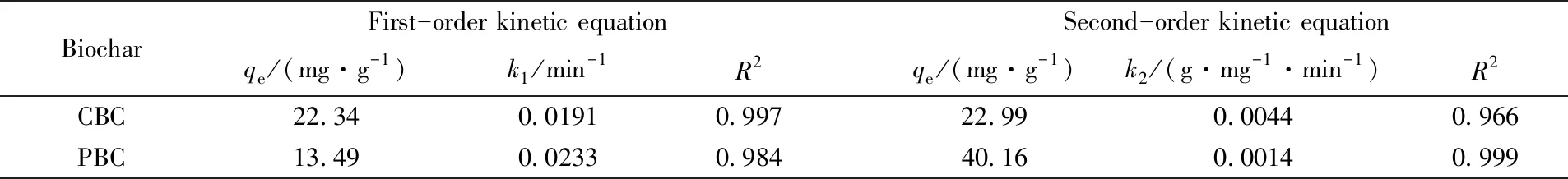
Table 2 Fitting parameters of adsorption kinetics of CBC and PBC for Cr6+
2.5 等温吸附
CBC与PBC吸附水中Cr6+的Langmuir和Freundlich等温线如图6所示, Langmuir和Freundlich 等温吸附模型的热力学参数如表3所示. 由图6可见, 随着反应温度的升高, 2种生物炭对Cr6+的吸附量均呈现升高的趋势, 说明温度升高可以提高生物炭对Cr6+的吸附能力; 同时, 由于PEI线性大分子链中含有大量的伯胺、 仲胺和叔胺等功能基团[28], 能以静电吸引、 官能团络合等方式结合水溶液中的Cr6+, PBC对Cr6+的吸附能力明显高于CBC.

Fig.6 Adsorption isotherms of CBC and PBC for Cr6+ at different temperatures (A) Langmuir equation fitting; (B) Freundlich equation fitting.
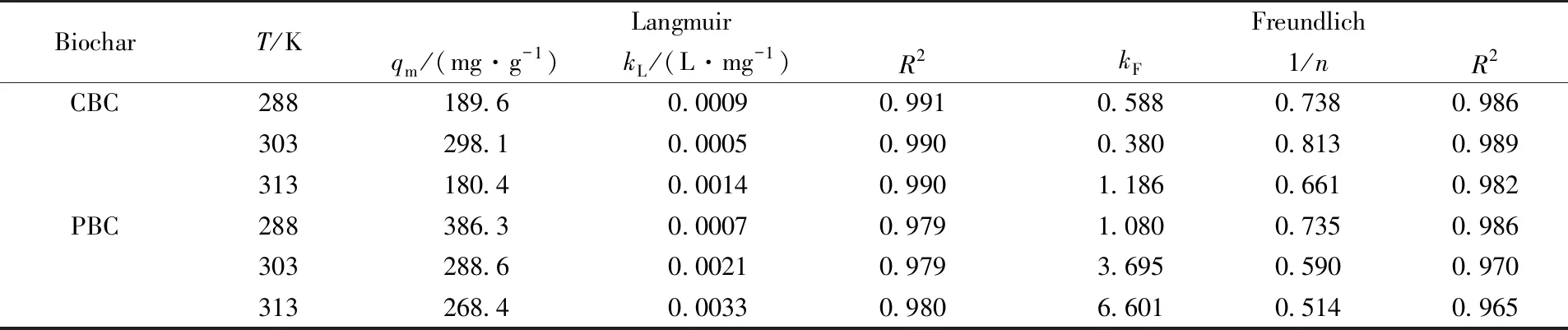
Table 3 Fitting parameters of adsorption isotherms of CBC and PBC for Cr6+
由表3可见, Langmuir等温吸附模型及Freundlich 等温吸附模型均可很好地描述CBC与PBC对水中Cr6+吸附的热力学特征, Langmuir等温吸附模型与实验数据的拟合度更高. Langmuir吸附等温方程具有明确的物理化学意义, 其中,qe为吸附剂的最大吸附量, 因此Langmuir吸附等温方程能够具体体现出吸附剂的吸附能力[29]. 由Langmuir等温吸附模型计算得到, PBC对水中Cr6+的最大吸附量为386.3 mg/g, 明显大于CBC对水中Cr6+的吸附能力, 因此PBC对水中Cr6+具有很好的吸附效能, 在Cr6+污染的水体治理中具有很大的潜在应用价值.
根据Freundlich等温吸附模型, PBC的吸附过程呈现出非均质吸附特性, 是由生物炭表面特性基团及吸附位点分布不均匀所致. 在Freundlich等温吸附模型中, 1/n为Freundlich等温吸附方程的特征常数, 当1/n在0.1~0.5之间时, 表明吸附过程为优先吸附; 当1/n>2时, 表示吸附反应难以进行. PBC吸附Cr6+的1/n均>0.5且<2, 因此PBC对水中Cr6+的吸附过程偏向于优先吸附[30].
2.6 溶液初始pH对吸附效果的影响
不同初始pH条件下CBC和PBC对Cr6+吸附效果的变化情况如图7所示. 当pH值由2.0增至10.0时, PBC对Cr6+的吸附量由95.94 mg/g降至11.47 mg/g; CBC对Cr6+的吸附量由4.84 mg/g增至53.78 mg/g; 当pH在2.0左右时, PBC对Cr6+的吸附量最大, 说明酸性环境有利于吸附过程的进行. 随着pH值增大, CBC对Cr6+的吸附量呈现上升趋势, 是因为OH-浓度增大, 会与溶液中H+结合, 降低H+与Cr6+的静电排斥作用, 导致溶液中H+浓度降低, 竞争作用减弱[31], 使Cr6+更易与生物炭表面带负电荷的点位相结合, 从而导致吸附量增大, 吸附效率增加. 因此, 酸性条件更利于PBC对水中Cr6+的吸附.
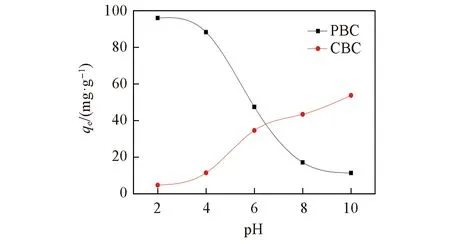
Fig.7 Effect of CBC and PBC on the adsorption of Cr6+ at different initial pH
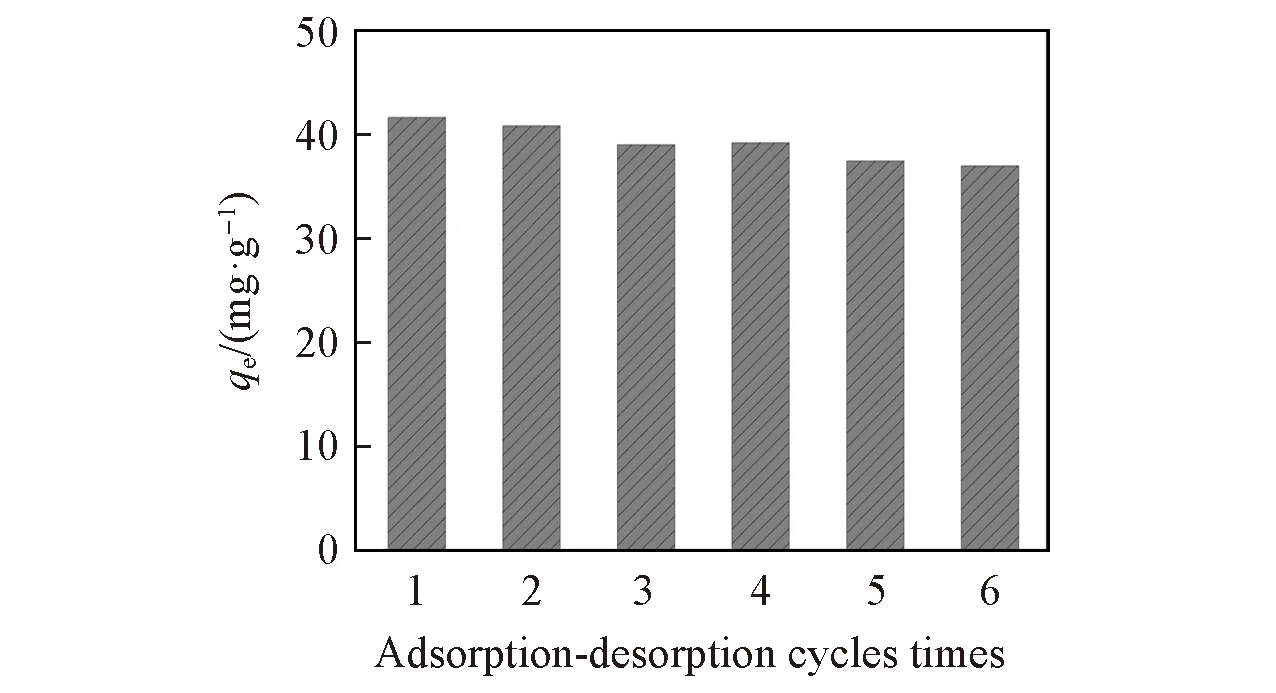
Fig.8 Adsorption-desorption cycles of Cr6+ adsorption on PBC
2.7 改性生物炭对Cr6+的解吸特性
为了评价PBC稳定性和实用性, 进行连续6个周期的吸附-解吸实验, 结果如图8所示. 随着吸附-解吸次数的增加, PBC对Cr6+的吸附能力有所降低. PBC对Cr6+的吸附量由最初的44.26 mg/g降至36.98 mg/g, 吸附量降低较少, 可见PBC具有良好的重复利用性能.
3 结 论
以玉米秸秆为原材料, 经过缺氧炭化制备玉米秸秆生物炭, 采用戊二醛做交联剂, 将聚乙烯亚胺负载于玉米秸秆生物炭表面, 研究了 PEI生物炭复合材料对水中Cr6+的吸附性能及吸附热力学特征. 研究结果表明, PBC表面出现介孔, 介孔面积为2.41 m2/g, PBC表面存在提供更多的吸附Cr6+的吸附位点, 同时PBC表面存在配位基团, 这些原因使PBC对Cr6+的吸附量较CBC显著增加, 相同吸附剂添加量条件下, PBC的吸附去除效率是CBC的4倍. 生物炭对水中Cr6+的吸附可以用Langmuir和Freudlich等温吸附模型进行较好地拟合, 随着温度的升高和溶液初始浓度的增加, CBC与PBC对Cr6+的吸附量呈现增加趋势. PBC对Cr6+的最大吸附量为386.3 mg/g; CBC与PBC对Cr6+的吸附过程在300 min达到平衡, 二级动力学方程更适合反映Cr6+的吸附过程, CBC与PBC对Cr6+的平衡吸附量分别为22.99和40.16 mg/g; 吸附效率受溶液初始pH的影响较大, 酸性环境有利于PBC对Cr6+的吸附, 当pH在2.0左右时, PBC对Cr6+的吸附效率最大可达到95.94%; 随着pH值的升高, CBC对Cr6+的吸附率最大可达53.78%. 综上, 与未改性的生物炭相比, 经过改性修饰的生物炭显著提高了对重金属的吸附效率.

