Fsp27 基因沉默载体的构建及其对细胞脂解的影响研究
许祥 董维鹏 张少华 冯晨毅 刘田福 燕炯
(1. 山西医科大学公共卫生学院,太原 030001;2. 山西医科大学动物实验中心,太原 030001)
脂质代谢紊乱会造成脂肪堆积,进而引发肥胖症、脂肪肝、糖尿病等一系列代谢性疾病[1-2]。在哺乳动物体内,异常或过量的脂肪会在脂肪细胞中累积,形成脂滴(Lipid droplets,LD)。脂滴是一个与脂质储存、代谢和分泌密切相关的细胞器,由甘油三酯(Triglyceride,TG)、胆固醇酯的中性脂肪核心及单层磷脂包被组成[3]。Fsp27 是一种脂滴表面结合蛋白,是调控脂滴发育和脂质沉积的关键因子[4]。Fsp27 蛋白定位于脂滴表面,并富集在脂滴与脂滴的接触位点(Lipid droplet contact site,LDCS),调节脂滴代谢,介导脂滴之间的相互融合形成单个大脂滴[5-6],但其具体的作用机制尚不明确。
本研究以分化的3T3-L1[7]脂肪细胞作为研究模型,通过构建shRNA 基因沉默载体沉默Fsp27基因,探究Fsp27基因沉默对脂肪细胞脂解的影响,以及对脂滴的形成、融合过程中的作用,推断其具体机制,旨在为了解Fsp27基因的生物学功能、脂类代谢疾病的治疗和预防奠定重要的实验基础和提供依据。
1 材料与方法
1.1 材料
3T3-L1 前脂肪细胞系、DMEM 高糖细胞培养基、BCA 蛋白定量试剂盒、β-Actin 抗体、山羊抗兔Ig G 抗体、山羊抗鼠Ig G 抗体(武汉BOSTER 生物工程公司),3-异丁基-1-甲基黄嘌呤(IBMX)、地塞米松(DEX)、胰岛素(Ins)、Lipofectamine 3000、P3000TM试剂、油红O 染料(Sigma 公司,美国),真核表达载体(编号:GV104)(上海吉凯基因化学技术有限公司),离心柱型质粒小提试剂盒(北京天根生化科技有限公司),甘油三酯检测试剂盒、甘油含量检测试剂盒(南京建成生物工程研究所),HSL抗体、ATGL 抗体、Fsp27 抗体(Abcam 公司,英国),PPARγ 抗体(Bioworld 公司,美国),GAPDH(CST公司,美国)。
1.2 方法
1.2.1 sh-Fsp27 干扰载体的构建 查找NCBI 基因数据库中小鼠Fsp27基因mRNA(NM_001301295)碱基序列,设计3 条与小鼠Fsp27基因序列一致,且与其它基因同源性最低的阳性序列,同时再设计1 条与小鼠Fsp27基因无任何同源性的阴性对照序列(表1)。设计好的4 个靶点序列委托上海吉凯基因化学技术有限公司合成。构建带有RFP 红色荧光的真核表达质粒载体GV104,鉴定其DNA 序列。3 条阳性重组干扰载体分别命名为sh-Fsp27-1、sh-Fsp27-2、sh-Fsp27-3,阴性对照为sh-Fsp27-0。

表1 小鼠sh-Fsp27 重组载体干扰靶点
1.2.2 质粒的扩增(工具菌培养)与提取 取适量菌液均匀涂布在含有氨苄青霉素的LB 固体培养基平板上,37℃恒温倒置培养,待培养平板上长出单个菌落后,挑取菌落接种于含有氨苄青霉素(终浓度为50 μg/mL)的LB 液体培养基中。将接种好的锥形瓶置于37℃恒温摇床中220 r/min,振荡培养16 h。采用碱裂解法,严格按天根质粒小提试剂盒说明书在无菌环境中提取质粒。通过微孔板分光光度计测定质粒的浓度和纯度(A260/A280值),剩余质粒放于-20℃保存备用。
1.2.3 细胞培养与诱导分化 用含10%FBS 的DMEM 高糖培养基培养3T3-L1 前脂肪细胞:将其放置于环境为37℃、5% CO2的恒温培养箱中培养,2 d 更换完全培养液1 次。将细胞接种于6 孔板中,待细胞汇合至80%左右时,按本课题组前期优化过的经典“鸡尾酒”方法,诱导分化3T3-L1 前脂肪细胞成为成熟的脂肪细胞。对照组诱导分化后用完全培养基继续培养,2 d 换液1 次,sh-Fsp27-0 组(即阴性对 照组)、sh-Fsp27-1 组、sh-Fsp27-2 组、sh-Fsp27-3 组在诱导分化4 d 时进行脂质体转染。
1.2.4 脂质体转染 sh-Fsp27-0 组、sh-Fsp27-1 组、sh-Fsp27-2 组、sh-Fsp27-3 组细胞在诱导分化4 d 时,取出六孔板,按照Lipofectamine 3000 转染试剂说明书进行转染,37℃孵育细胞2 d,然后荧光显微镜观察转染效果。
1.2.5 油红O 染色 在细胞干预完成后,弃掉六孔板中培养基,每孔加入1 mL 4%多聚甲醛缓冲溶液,室温固定细胞1 h。用PBS 洗净残留的多聚甲醛缓冲溶液,每孔加入油红O 工作液1 mL(现配现用)。室温染色1 h 后蒸馏水清洗残留油红O 工作液,置于显微镜下观察并拍照。
1.2.6 TG 含量与甘油含量检测 细胞干预完成后,收集6 孔板中的细胞至EP 管。每个EP 管中加入900 μL PBS 缓冲液,用枪头吹打细胞沉淀至细胞悬浮。在冰水浴条件下进行超声破碎细胞。制备好的匀浆液直接按照甘油三酯(TG)试剂盒检测说明书测定TG 含量,每组以细胞总蛋白浓度对测定值进行校正。制备好的匀浆液70℃金属浴10 min,灭活脂肪水解酶,严格按照甘油测定试剂盒说明测定样本甘油含量。根据预先绘制的标准曲线计算各样本的甘油含量,并以每mg 蛋白浓度对测定值进行校正。
1.2.7 Western-blot 检测细胞中Fsp27、HSL、ATGL和PPARγ 蛋白表达 收集各组细胞沉淀至EP 管中,加入200 μL 细胞总蛋白裂解液,冰上裂解10 min,4℃、12000 r/min 离心15 min,取上层液体即为待测总蛋白样品。采用BCA 法测定各组待测样品的总蛋白浓度,并调平浓度。PAGE 电泳,电泳参数:浓缩胶80 V 恒压,分离胶120 V 恒压;湿式转膜,参数:220 mA 恒定电流,转膜持续2 h。取出NC 膜,浸入封闭液中封闭2 h。蛋白一抗4℃过夜孵育。次日,取出条带,孵育二抗,37℃摇床2 h。显影仪曝光目的条带,挑选出目的条带清晰、背景浅的图片。用ImageJ 软件对目的蛋白条带进行分析并测定吸光度值,以β-actin 进行校正。
1.2.8 统计学分析 采用SPSS 22.0 软件进行统计学分析。实验数据统一采用x-±s来描述。计量资料采用t检验进行分析,多组样本均数比较采用one-way ANOVA 进行分析。
2 结果
2.1 干扰载体的鉴定
通过0.8%琼脂糖凝胶电泳,4 组质粒电泳条带均位于6500 bp 附近(图1-A),提取的质粒准确,可进行后续实验。经过DNA 测序结果证实,3 个sh-Fsp27 阳性干扰载体中的插入的shRNA 编码序列正确,与预期设计合成的干扰序列相符合(图1-B)。
2.2 质粒浓度、纯度
经DH5α 大肠杆菌培养后提取质粒,质粒浓度为300-700 μg/mL,A260/A280均介于1.8-2.0 之间,可用于脂质体转染(表2)。
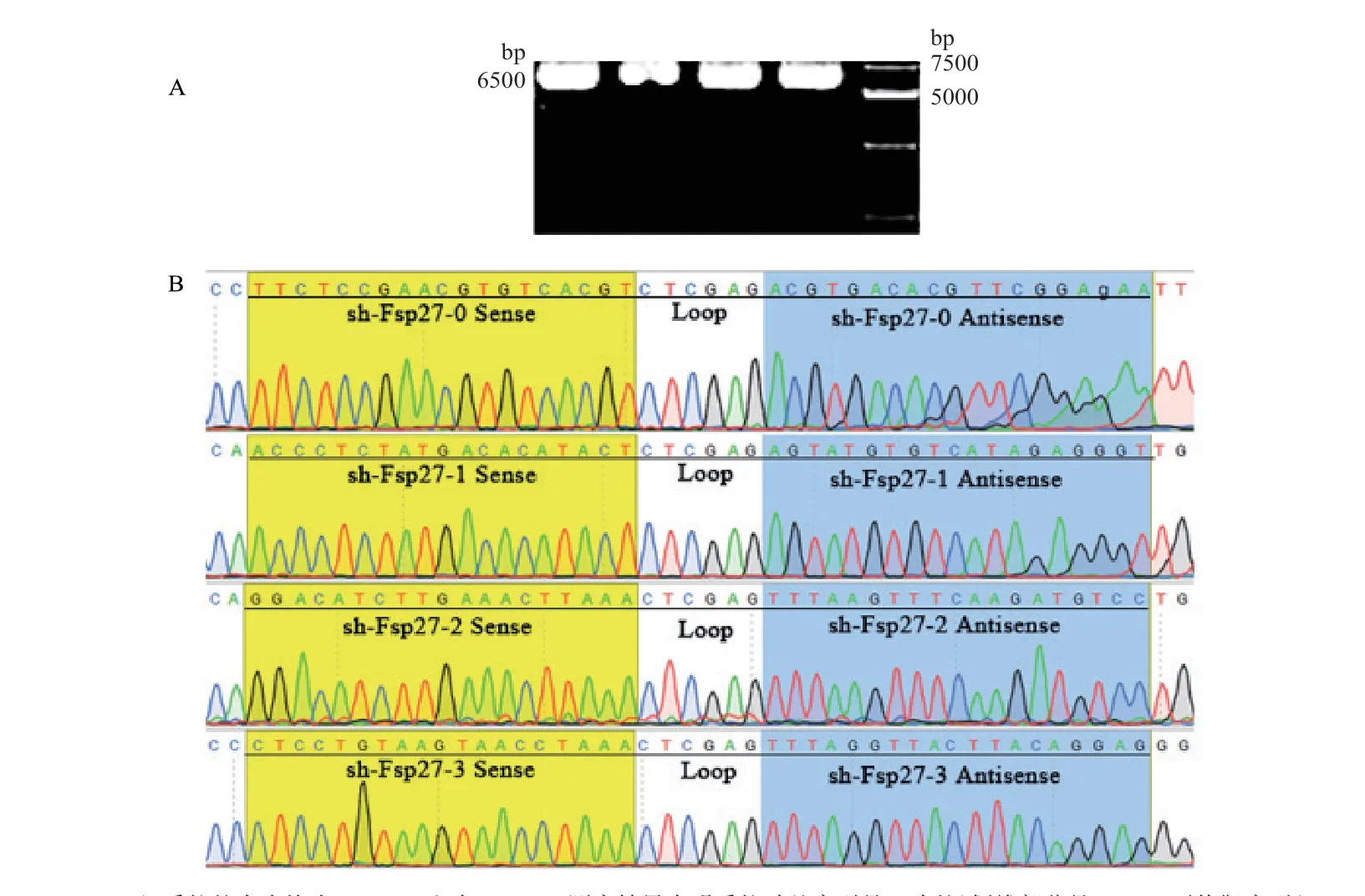
图1 sh-Fsp27 质粒序列鉴定
表2 质粒浓度和纯度鉴定(±s)

表2 质粒浓度和纯度鉴定(±s)
Vector A260/A280 Concentration/(μg·μL-1)sh-Fsp27-0 1.87±0.03 430±7.8 sh-Fsp27-1 1.83±0.15 356±5.2 sh-Fsp27-2 1.90±0.07 468±8.2 sh-Fsp27-3 1.94±0.15 536±10
2.3 细胞转染效果及Fsp27蛋白的沉默效果
细胞脂质体转染4 d 后,荧光显微镜下观察拍照显示:4 组红色荧光蛋白基本表达一致,转染效率在45%左右(图2-A),阴性对照组和阳性sh-Fsp27 干扰载体之间的转染效果没有显着差异。Western blot 结果显示,与sh-Fsp27-0 组和空白组比较,3 个阳性干扰载体可以明显下调Fsp27 蛋白的表达量(P<0.05)(图2-B),且在3 个阳性载体中sh-Fsp27-2 干扰载体下调Fsp27 蛋白表达的效果最好,后续实验以sh-Fsp27-2 作为阳性组。
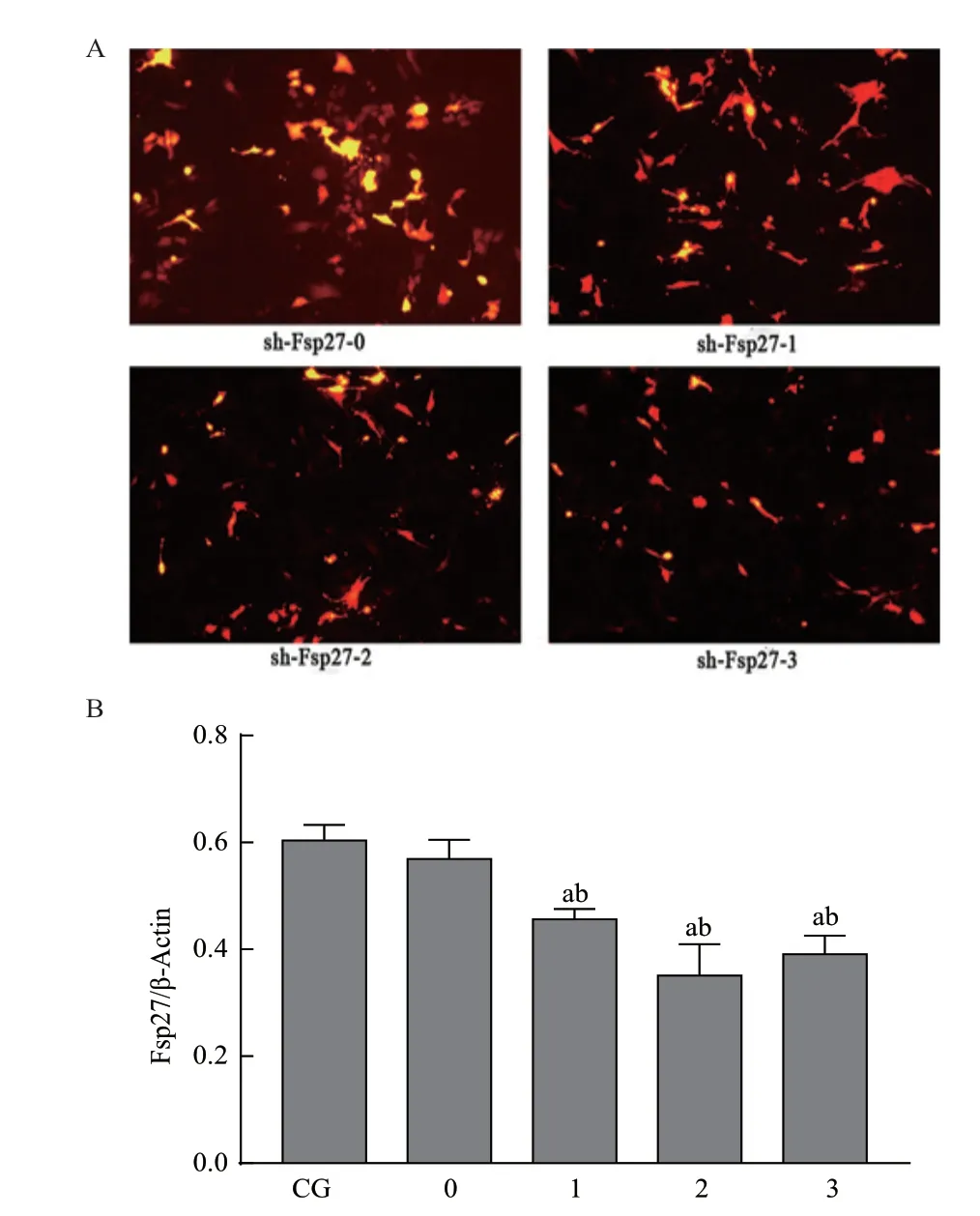
图2 Fsp27 基因沉默效果
2.4 脂肪细胞中脂滴的变化
未分化的3T3-L1 前脂肪细胞呈纤维样,胞质内无明显脂滴。诱导分化后,细胞形态由成纤维样变为圆形,伴随着胞体的增大,胞内出现脂滴。油红O 将细胞中的脂质染成红色,普通光学显微镜下观察可见,对照组与sh-Fsp27-0 组脂滴生成较快,8 d时能明显观察到脂滴聚集,12 d 可见小脂滴融合成大脂滴;阳性sh-Fsp27 组均可见大量小脂滴广泛地分布于细胞核周围,且在12 d 时仍未出现明显的大脂滴(图3)。
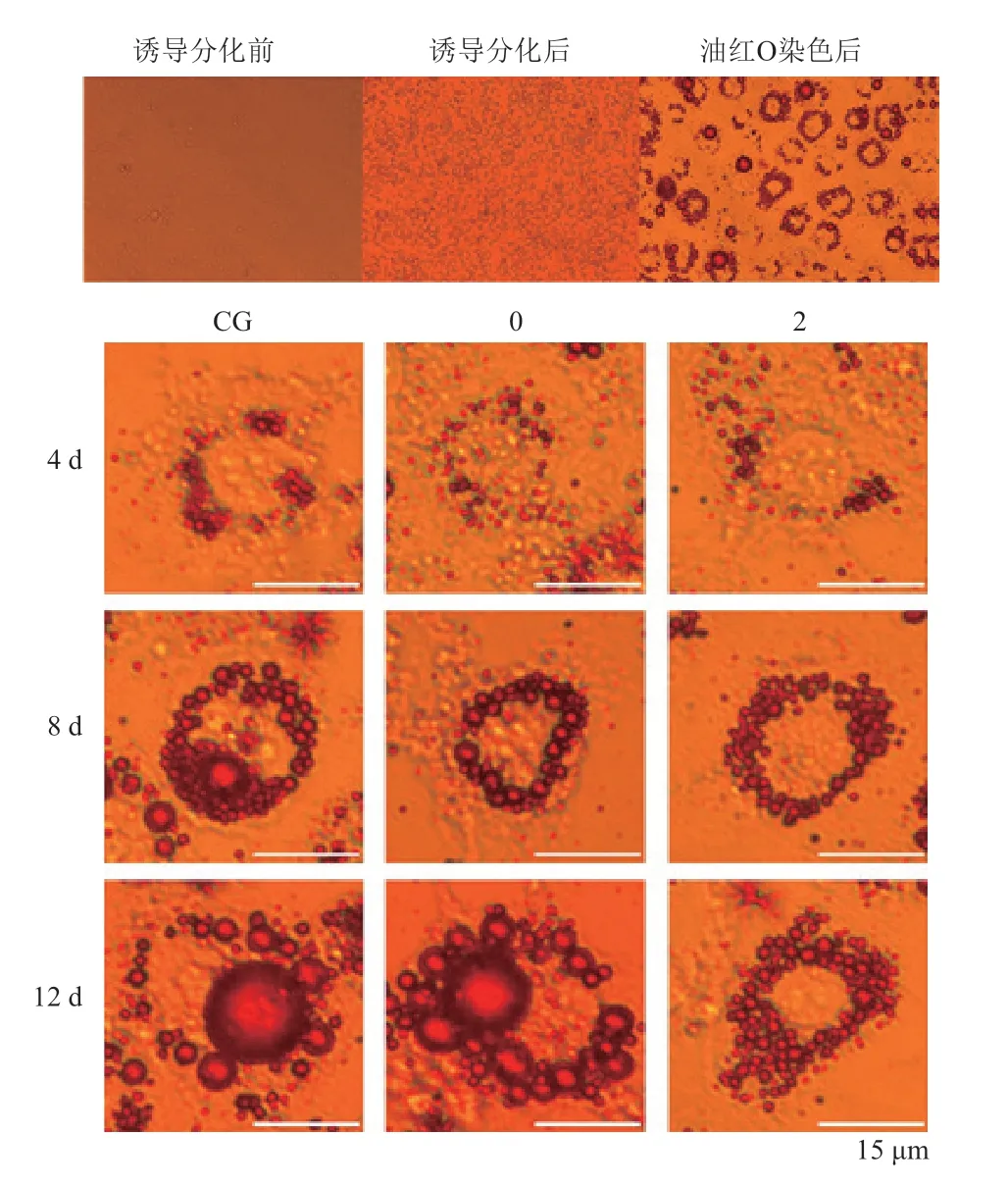
图3 脂滴油红O 染色
2.5 脂肪细胞内TG和甘油含量
采用酶学方法检测3T3-L1 脂肪细胞内的TG 和甘油含量。与对照组和sh-Fsp27-0 组相比,阳性sh-Fsp27 组中TG 含量明显下降,甘油含量明显升高,差异有统计学意义(P<0.05)(表3)。
2.6 脂肪细胞中MAPK信号通路及脂肪水解酶的表达
经Western blot 检测显示(图4),与空白对照组和阴性对照组相比,阳性sh-Fsp27 组PPARγ 蛋白表达量显著升高,差异有统计学意义(P<0.05);阳性sh-Fsp27 组ATGL 蛋白表达量显著升高,差异有统计学意义(P<0.05);各组之间HSL 蛋白表达量无显著差异(P>0.05)。
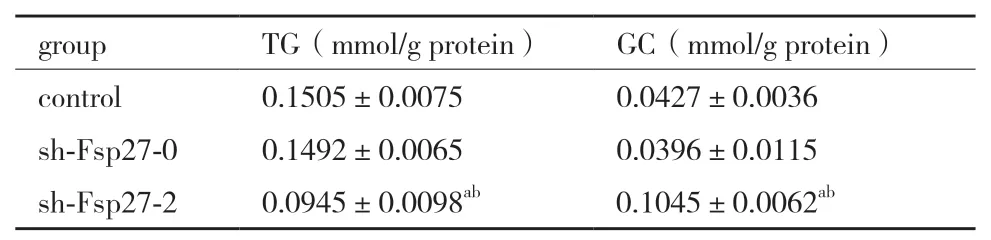
表3 各组的TG 和甘油含量
3 讨论
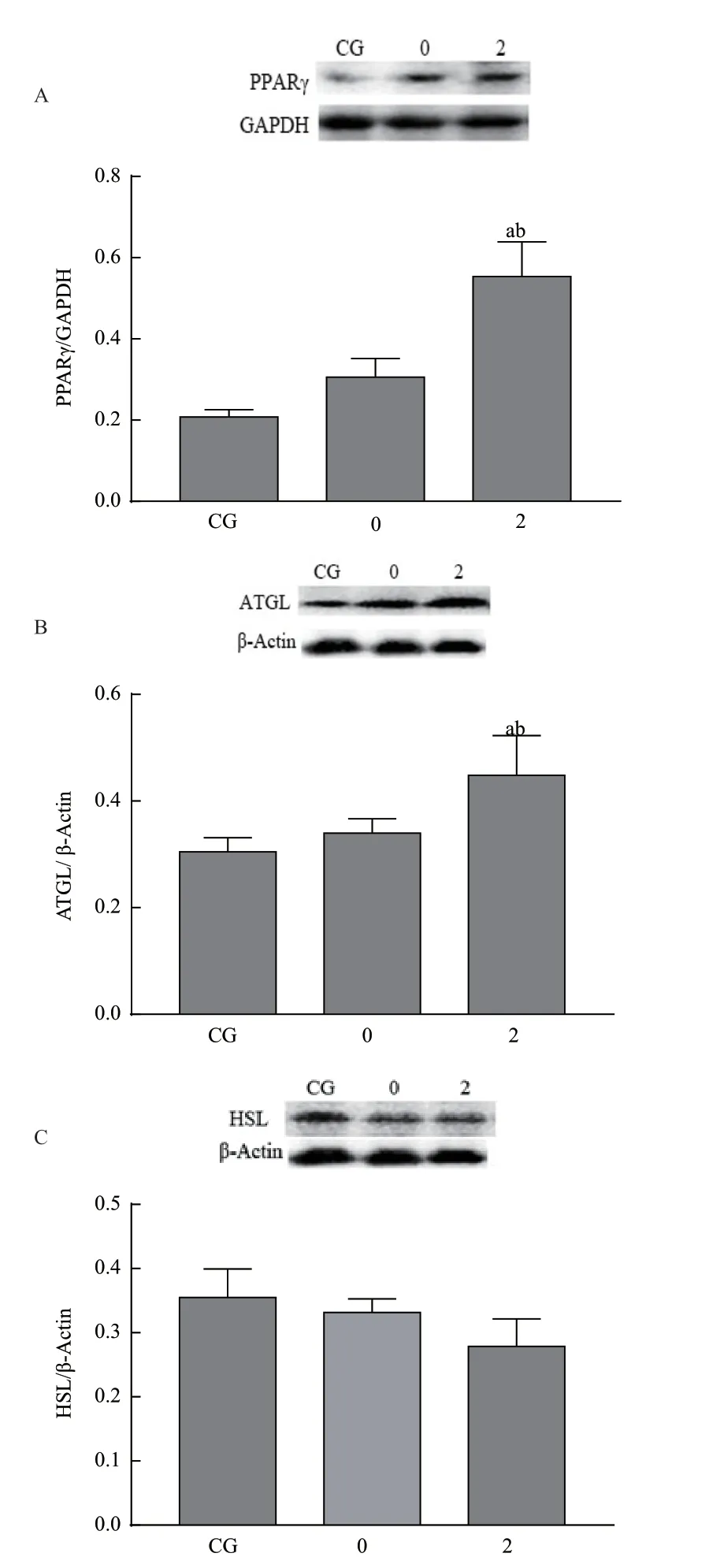
图4 各组蛋白表达情况
脂肪组织是集体贮存和提供能量的主要组织,当脂质代谢紊乱时就会引发肥胖症、脂肪肝、高脂蛋白血症等疾病,严重危害人们的健康[8-9]。脂滴是脂肪组织的主要贮存场所,其表面存在众多的脂滴相关蛋白,在脂肪的代谢、转运和信号转导等方面发挥作用[10]。Fsp27 是新近才发现的一种脂滴相关蛋白,研究发现Fsp27 在促进脂滴融合,形成单房大脂滴,调控甘油三酯贮存方面具有重要作用,但其具体的作用机制尚不明确[11]。
Fsp27 蛋白表达于脂肪细胞中,当两个小脂滴相互接触时,Fsp27 在脂滴之间的接触点富集,小脂滴中的中性脂质定性转移到大的脂滴中,导致小脂滴的相互融合形成大脂滴[12]。本实验使用RNAi技术,成功构建了3 条Fsp27 基因沉默载体,并且证明了sh-Fsp27-2 组载体的效率最高,可用于后续实验。成功沉默了Fsp27基因,可以明显观察到脂肪细胞内大脂滴数量减少,小脂滴广泛分布,说明Fsp27基因表达量的减少可以抑制小脂滴的融合,使其呈“戒环样”结构包围着细胞核,从而减少了大脂滴的生成,结果与之前的报道一致[7,13]。在脂肪分解的过程中,细胞内甘油三酯水解主要是通过激素敏感脂肪酶(Hormone-sensitive lipase,HSL)和甘油三酯脂肪酶(Adipose triglyceride lipase,ATGL)两种关键脂肪水解酶来完成的。本实验中可以明显观察到阳性实验组中TG 含量减少,而甘油含量增加,说明通过下调Fsp27 基因的表达可以促进甘油三酯的水解。Fsp27 可以激活ATGL 的抑制因子早期生长反应蛋白1(Early growth response protein 1,Egr1),从而抑制ATGL 的转录水平[14-15]。本次实验在降低脂肪细胞中Fsp27 的表达后,可以观察到ATGL 表达升高,而ATGL 表达量的增加,进一步促进了脂肪的水解。
过氧化物酶体增殖物激活受体γ(Peroxisome proliferators-activated receptors-γ,PPARγ)是调节脂肪形成和能量代谢的关键因子,丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)信号通路的下游靶点,其作为核转录因子可调控Fsp27 的表达,促进脂肪细胞的分化和脂质沉积[16-17]。在沉默Fsp27基因后,Fsp27 蛋白的表达减少,从而负反馈调节使PPARγ 的表达升高(图5)。PPARγ 表达的升高也从侧面印证了Fsp27基因通过PPARγ 通路促进脂肪的生成,对脂肪细胞中甘油三酯的蓄积起正调控的作用。

图5 Fsp27 与MAPK/PPARγ 信号通路
4 结论
综上所述,sh-Fsp27-2 组基因沉默载体的效率最高,沉默Fsp27基因可以促进3T3-L1 前脂肪细胞的脂解。推测其作用机制可能是:Fsp27基因表达的缺失抑制了小脂滴的相互融合,增大了脂肪酶的接触面积,减少了对ATGL 转录的抑制,增强了ATGL介导的脂肪水解作用,从而促进了3T3-L1 前脂肪细胞的脂解。Fsp27基因通过PPARγ 通路促进脂肪的生成,对脂肪细胞中甘油三酯的蓄积起正调控的作用。

