一种基于甲基纤维素半固体培养基的真菌单孢分离新方法
秦鹏,路等学,康红梅,韩融冰,郭瑞,赵玉卉,魏甲乾,王治业, 2*
1(甘肃省科学院 生物研究所,甘肃 兰州,730000)2(甘肃省科学院 生物研究所,甘肃省微生物资源开发利用重点实验室,甘肃 兰州,730000)
真菌的分离纯化是真菌生物学研究和资源开发利用的基础和前提[1],真菌培养基存在大量的异质细胞样本,对该样本进行生化分析,其结果仅反映了平均水平,可能会掩盖关键因素,影响真菌生物学机理的解析,所以,可靠、稳定和便捷的单孢分离方法对真菌资源的开发利用、生物学特性的研究以及群体细胞中的罕见基因资源的挖掘有着重要的意义。常用的真菌单孢分离纯化法有:平板涂布法、琼脂糖半固体培养基法、微孔过滤法、密度梯度法和显微操作法等。平板涂布法是应用最广泛的方法,GARCIA等[2]应用平板涂布法分离和明确了200个调味料样品中的污染真菌;NOMAN等[3]应用平板涂布法分离了医疗废弃物的真菌并分析了污染源;LIM等[4]应用平板涂布法从野生蛹虫草(Cordycepsmilitaris)子实体分离出桑白盾蚧病原真菌(Simplicilliumlanosoniveum)。此外,YUAN等[5]联合应用琼脂糖半固体和显微操作法分离野生黑木耳(Auriculariaheimuer)的单孢并进行了全基因组测序;KOYAMA等[6]联合应用微孔过滤和密度梯度法从野外土壤中分离丛植菌根真菌(Arbuscular mycorrhizal fungi)的单孢;SELVAKUMAR等[1]应用显微操作法分离和纯化了丛植菌根真菌;刘一凡等[7]应用显微操作法成功地分离和纯化了十字花科作物病害真菌芸薹根肿菌(Plasmodiophorabrassicae)。
分离真菌单孢的方法具有不同的优缺点:平板涂布法操作简便易行、适用性广,但真菌单孢仅能在培养基表面形成单菌落,单孢分离的通量较低,涂布操作不仅损失较多孢子而且使部分孢子聚集;琼脂糖半固体培养基方法操作简便,真菌单孢在培养基表面和内部均能形成单菌落,单孢分离通量较高,但琼脂糖培养基流动性差、熔点高(44 ℃),不利于孢子的混匀和生长;有限稀释法易于显微观察孢子和单菌落的形态特征,单孢分出率较高,但操作繁琐耗时,效率极低,易污染;显微操作法便于显微观察真菌孢子,获得单孢的可靠性较高,但操作繁琐耗时,易污染;微孔过滤法分离效率较高,但单孢分出率低,易污染,常与其他单孢分离法联合使用[6]。
近年来,肿瘤细胞异质性的研究促进了单细胞分离技术的迅猛发展,为真菌单孢分离技术的开发提供了新思路,如微孔过滤[8]、有限稀释、双向电泳[9]、磁泳[10]、电镜拍照[11]。这些技术已用于分离单个癌细胞,然而依然存在局限性。如,双向电泳分离通量低,微孔过滤和有限稀释操作繁琐,低通量和高成本的电镜拍照技术限制了其广泛应用,免疫磁珠的分离效率亦较低,荧光标记和激光捕获方法损伤细胞功能,不利于下游分析[12]。依赖于细胞分选设备和显微镜的微流体技术也被用于分离单个癌细胞[13],但该技术高昂的仪器成本和条件需求限制了其广泛应用。甲基纤维素半固体培养基已被广泛应用到杂交瘤单细胞系的筛选[14],该方法具有简单、便捷、稳定、高通量和成本低的特点。但是,国内外尚未见利用甲基纤维素半固体培养基分离真菌单孢的研究尚未见国内外报道。
甲基纤维素半固体培养基具有良好的流动性和固定作用,而真菌孢子不具备运动功能,混匀后的真菌孢子在甲基纤维素培养基内的相对位置固定。静置培养后,孢子萌发形成彼此隔离、分布均匀的单菌落,可利用移液枪将单菌落转移至下游培养基。因此,甲基纤维素半固体培养基法可能具备以下优点:移液枪操作,简便、高效、稳定、孢子损失少;真菌单孢在甲基纤维素半固体培养基内部和表面均能萌发形成单菌落,显著提高了真菌单孢分离的通量;在0~50 ℃时,甲基纤维素半固体培养基为透明黏稠液体,可通过调节其有色组分的质量浓度以适应不同真菌单孢的分离;甲基纤维素半固体培养基能溶解少量氧气,具备常温下分离专性需氧和兼性厌氧真菌单孢的潜力。甲基纤维素半固体培养基法的诸多优点使其不仅在专性需氧、兼性厌氧型真菌单孢分离中有良好的应用前景,而且具有分离专性厌氧和呼吸缺陷型真菌的潜力。而在分离大量的诱变真菌单孢时,甲基纤维素半固体培养基法联合96深孔板高通量筛选目标诱变菌的策略将极大地提高诱变真菌选育的效率。
本研究以蛹虫草菌为例,开发了一种基于甲基纤维素半固体培养基的真菌单孢的分离方法,并将该方法与平板涂布、琼脂糖半固体培养基、有限稀释和显微操作法进行了比较,为真菌单孢分离提供新方法。
1 材料与方法
1.1 材料
1.1.1 菌种与培养基
菌种:蛹虫草菌C.militarisCICC 14014(CM-1),中国工业微生物菌种保藏中心;蛹虫草菌C.militarisCGMCC 3.4655(CM-3),中国普通微生物菌种保藏中心。
基础培养基(g/L):葡萄糖16、蛋白胨8、KH2PO41、MgSO4·7H2O 1。
平板培养基:基础培养基添加琼脂18 g/L。
甲基纤维素半固体培养基:基础培养基添加适量甲基纤维素。
琼脂糖半固体培养基:基础培养基添加适量琼脂糖。
PBS(g/L):NaCl 8.000、KCl 0.201、Na2HPO4·12H2O 3.581、KH2PO40.240,pH值约7.2。
1.1.2 试剂与耗材
试剂:葡萄糖、蛋白胨、MgSO4·7H2O、KH2PO4、NaCl、KCl、Na2HPO4·12H2O、琼脂、琼脂糖,中国医药集团有限公司;质量浓度1 g/L亚甲基蓝溶液,北京索莱宝科技有限公司;中黏度甲基纤维素(黏度:4 000 MPa·s),生工生物工程上海股份有限公司;水为市售纯净水。
耗材:聚丙烯96深孔板(每孔体积2 mL)、96深孔板聚丙烯软盖、聚苯乙烯96微孔板和50 mL聚丙烯离心管,百思泰实验器材有限公司(江苏省南通市)。
1.1.3 设备与仪器
移液枪,北京大龙兴创实验仪器有限公司;生物显微镜(XSP-2CA),上海光学仪器公司;生化培养箱(SPJ-150),上海君竺仪器制造有限公司。
1.2 实验方法
1.2.1 孢子悬液的制备
各取一支保存CM-1和CM-3蛹虫草菌的试管,分别制备CM-1和CM-3孢子悬液。用5 mL无菌PBS洗脱孢子,用无菌脱脂棉过滤孢子溶液,采用1 g/L亚甲基蓝溶液染色[15]和血球计数板计数法[16],统计并稀释活孢子浓度至1×103个/mL备用。
1.2.2 五种真菌单孢分离方法的操作步骤
甲基纤维素半固体培养基法:向250 mL锥形瓶装入70 ℃的200 mL基础培养基后并添加一定质量浓度的甲基纤维素,于冰浴冷却至室温并不断用玻璃棒搅拌,以20 mL/50 mL三角瓶的装液量装载甲基纤维素半固体培养基,塞紧瓶塞,灭菌后备用;向上述甲基纤维素半固体培养基接种150 μL CM-1孢子悬液;塞紧瓶塞后充分摇匀;于25 ℃恒温避光静置培养3 d,用1 000 μL无菌移液枪头吸附可分离单菌落并接入下游培养基。
关键技术点:在溶解甲基纤维素时,为防止产生甲基纤维素的沉淀,使得甲基纤维素均匀分散到基础培养基内,基础培养基的温度应高于70 ℃。孢子悬液(使用PBS制备)的接种量应低于200 μL/20 mL以防止发生盐析;摇匀培养基中的孢子时,培养基液面不宜超出三角瓶高度的1/3,以防止孢子滞留形成贴壁单菌落,影响观察。
有限稀释法:参考李小芬等[17]的方法并改进。将96微孔板置于超净工作台紫外灯照射3 h灭菌;移取200 μL CM-1孢子悬液至96微孔板A1孔,其他各孔添加75 μL已灭菌的基础培养基,以每孔75 μL的移液量,从A1依次连续稀释至H1,再按A1~A12,……,H1~H12顺序依次连续稀释,每组操作前更换已灭菌的枪头;用已灭菌的封口膜密封96微孔板,于25 ℃恒温避光静置培养3 d后,用已灭菌的1 000 μL移液枪头将可分离单菌落接入下游培养基。96微孔板的灭菌为关键步骤。
平板涂布法步骤:参考段斌等[16]的方法并修改。无菌条件下,将涂布器在酒精灯外焰灭菌,待涂布器温度降至室温后,移取150 μL的上述CM-1孢子悬液至已灭菌的PDA平板中央,均匀涂布后,于25 ℃恒温避光静置培养3 d后,用已灭菌的接种针将可分离单菌落接入下游培养基。其中,涂布器灭菌及其温度降至室温后再接种为关键步骤。
琼脂糖半固体培养基法:参考任瑞敏等[14]的方法并改进。每50 mL三角瓶装载20 mL琼脂糖半固体培养基,灭菌,待培养基温度降至室温后,无菌条件下,向已灭菌的琼脂糖半固体培养基接种150 μL上述CM-1孢子悬液,塞紧瓶塞后充分摇匀,于25 ℃恒温避光静置培养3 d,用已灭菌的接种针将可分离单菌落接入下游培养基。其中,琼脂糖半固体培养基的温度降至室温后再接种为关键步骤。
显微操作法:参考魏峰等[18]的方法并改进。取上述CM-1孢子悬液,用灭菌水稀释成一系列浓度梯度,各取10 μL滴在各载玻片上,静置5 min,用记号笔标记液滴范围,利用生物显微镜计算每10 μL各浓度梯度的孢子悬液的孢子个数;无菌条件下,利用筛选的每10 μL孢子悬液含1个孢子的稀释方法,对150 μL的CM-1孢子悬液进行稀释,再以每孔10 μL的接种量,向灭菌的每孔含1 mL PDA培养基的96深孔板接种稀释的孢子悬液,接种完所有的稀释孢子悬液后,用灭菌的软盖密封96深孔板并于25 ℃恒温避光静置培养3 d,用接种针将可分离单菌落接入下游培养基。其中,利用生物显微镜计算孢子数量的操作为关键步骤。
1.2.3 甲基纤维素及琼脂糖半固体培养基的优化
采用单因素实验分别研究不同质量浓度的甲基纤维素(7、11、15、19、23、27 g/L)和琼脂糖(5、10、20、30、40、50、60、70 g/L)对半固体培养基中可分离单菌落数量的影响。实验步骤同上述1.2.2的甲基纤维素和琼脂糖半固体培养基法,再以半固体培养基内可分离单菌落的数量为指标,确定最优浓度。
1.2.4 五种真菌单孢分离方法的比较
利用上述1.2.3筛选的甲基纤维素和琼脂糖半固体培养基,以及有限稀释、平板涂布和显微操作法(实验步骤同上述1.2.2),分别对150 μL的上述CM-1孢子悬液进行单孢分离,以可分离单菌落数量、操作步骤、培养基特性、操作特性和分离效率为指标比较5种方法。
1.2.5 优化的甲基纤维素半固体培养基分离不同真菌单孢的可行性
利用上述1.2.3筛选的甲基纤维素半固体培养基分别对150 μL和30 μL的上述CM-1以及150 μL的上述CM-3孢子悬液进行单孢分离,明确上述筛选的甲基纤维素半固体培养基分离不同的蛹虫草菌孢子的可行性。
1.4 数据处理
结果采用均值±标准差表示;统计软件采用SPSS 22.0,多重检验采用Duncan法;折线和柱形图采用Origin 2018;彩色照片矢量图的处理,采用软件Adobe Illustrator CS6。
2 结果与分析
2.1 半固体培养基的优化
可分离单菌落是彼此隔离、无交互作用和易于分离的单菌落。2种半固体培养基法获得的单菌落分为3类:可分离单菌落、聚集的单菌落、培养基液面以上的贴壁单菌落。其中,聚集的单菌落之间存在交互作用,对单菌落的遗传背景和分离产生了不利的影响,此外,贴壁单菌的分离难度大。因此,以可分离单菌落数量为指标优化半固体培养基。
实验设置甲基纤维素的质量浓度范围为7~27 g/L,在设置的质量浓度范围内,随甲基纤维素质量浓度的增加,可分离单菌落数量先增加后下降(图1和图2-a)。不同质量浓度的甲基纤维素对可分离单菌落数量的影响见图2-a,当甲基纤维素质量浓度小于11 g/L时,单菌落均位于培养基底部,可分离单菌落数量为零;当甲基纤维素质量浓度在15~19 g/L时,可分离单菌落数量开始缓慢增加,较小的单菌落均匀分散在培养基内,可分离单菌落数量为17个,而较大的单菌落散落至培养基底部,培养基表面无单菌落形成;当甲基纤维素质量浓度为23 g/L时,全部的单菌落均匀分散至培养基,培养基表面的可分离单菌落数量达6个,可分离单菌落总数达最大,为78个,显著多于其他质量浓度下的可分离单菌落数量(P<0.01);而当甲基纤维素质量浓度大于23 g/L,培养基中出现甲基纤维素沉淀,单菌落聚集,可分离单菌落数量快速下降至18个(P<0.01)。究其原因,静置培养过程中,真菌孢子在培养基中的空间位置受孢子质量和培养基黏度的影响,当培养基黏度增加至足以支撑孢子的质量时,孢子在培养基中的空间位置得以固定,否则便会沉降至培养基底部。当培养基黏度较低(7~11 g/L)时,全部的孢子逐渐沉降至培养基底部形成聚集的单菌落;继续增加培养基黏度(11~19 g/L),因孢子的遗传背景、大小和质量存在差异,少数质量较小的孢子的空间位置固定从而形成可分离单菌落,而质量较大的孢子逐渐沉降至培养基底部形成聚集的单菌落;当培养基黏度适宜(23 g/L)时,全部孢子的空间位置得以固定形成了可分离单菌落;继续增加培养基黏度(大于27 g/L)时,培养基中的甲基纤维素无法充分溶解而形成沉淀,无法充分摇匀孢子,进而形成大量聚集生长的单菌落,可分离单菌落数量急剧下降。

a-7 g/L;b-11 g/L;c-15 g/L;d-19 g/L;e-23 g/L;f-27 g/L图1 不同质量浓度的甲基纤维素对液体培养基中单菌落分布的影响Fig.1 The effect of different concentration of methylcellulose in liquid medium on thedistribution of single colonies
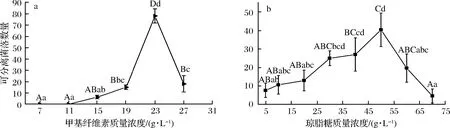
a-甲基纤维素质量浓度的优化;b-琼脂糖质量浓度的优化图2 半固体培养基的优化Fig.2 Optimizing component concentration in the semisolid medium注:所有大写字母不同表示在P<0.01水平上差异显著,所有小写字母不同表示在P<0.05水平上差异显著。下同。
在设置的质量浓度范围内,随琼脂糖质量浓度的增加,可分离单菌落数量先增加后减少,可分离单菌落均位于培养基表面。在琼脂糖质量浓度为5~50 g/L范围内,随琼脂糖质量浓度的增加,可分离单菌落缓慢增加至最大,为39个;继续增加琼脂糖质量浓度,可分离单菌落数量快速下降(P<0.05),而聚集的单菌落数量快速增加(图2-b)。因此,琼脂糖的优化质量浓度为50 g/L。
2.2 真菌单孢分离方法的比较分析
利用5种方法分别对理论活孢子数量为150个的CM-1孢子悬液进行单孢分离,优化的甲基纤维素培养基、平板涂布、显微操作、有限稀释和优化的琼脂糖培养基法获得的可分离单菌落数量依次为96、70、37、35和26个(图3)。

图3 五种真菌单孢分离方法分别获得CM-1可分离单菌落的数量Fig.3 The number of partible single colonies of strainCM-1 separately obtained by five methods used toisolate fungal single-spores
优化的甲基纤维素半固体培养基法获得的可分离单菌落数量显著高于平板涂布法(P<0.05),而平板涂布法获得的可分离单菌落数量显著高于其他3种方法(P<0.01),后3种方法获得的可分离单菌落数量之间无显著差异(P<0.05)。因此,甲基纤维素半固体培养基法获得的可分离单菌落数量显著高于其他4种方法(P<0.05)。
(a)优化的甲基纤维素半固体培养基、(b)优化的琼脂糖半固体培养基、(c)显微操作、(d)平板涂布和(e)有限稀释法在操作步骤、培养基特性、操作特性和分离效率上存在较大差异(见表1)。

表1 五种真菌单孢分离方法的比较分析Table 1 A comparative analysis of five methods used to isolate fungal single-spores
在操作步骤上,a、b和d方法简单易行,操作耗时依次为1、1和3 min,而c和e方法操作繁琐,操作耗时依次为120和90 min。在培养基特性上,a和b方法采用半固体培养基,但a方法的培养基在室温时呈液态且不损伤孢子,有利于真菌单孢的分离与培养,分离通量较高,c和d方法采用固体培养基,可分离单菌落仅位于固体培养基表面,分离通量较低,而e方法采用液体培养基,分离真菌单孢的潜力弱于其他4种方法。在获得的可分离单菌落数量上,a方法明显优于其他4种方法。因此,a方法在操作步骤、培养基特性、操作特性和分离效率上均优于其他4种方法。
分别向每50 mL三角瓶的20 mL优化的甲基纤维素半固体培养基中接入150 μL的CM-3(图4的C1)、150 μL的CM-1(图4的C2)和30 μL的CM-1(图4的C3)孢子悬液并充分摇匀,25 ℃恒温避光静置培养3 d后,形成的单菌落如图4所示。CM-1和CM-3单菌落都均匀分散至优化的甲基纤维素半固体培养基中,每个单菌落由致密的单菌落核心和疏松的周围菌丝构成,CM-1单菌落直径明显大于CM-3,说明优化的甲基纤维素半固体培养基适用于不同类型的蛹虫草菌的单孢分离。

图4 优化的甲基纤维素半固体培养基中的单菌落Fig.4 Single colonies in the optimized semisolidmethylcellulose medium
3 结论
甲基纤维素和琼脂糖的优化质量浓度分别为23和50 g/L;优化的甲基纤维素半固体培养基、平板涂布、显微操作、有限稀释和优化的琼脂糖半固体培养基法获得的可分离单菌落数量依次为96、70、37、35和26个,操作耗时依次为1、3、120、90和1 min;优化的甲基纤维素半固体培养基法在操作步骤、培养基特性、操作特性和分离效率上均优于其他4种方法。
与传统方法相比,优化的甲基纤维素半固体培养基法具备诸多优势和应用潜力:培养基在0~50 ℃时为透明黏稠液体,有利于室温条件下真菌孢子萌发形成单菌落;调整培养基中有色组分的质量浓度可改变培养基颜色,更易于观察不同类型真菌的单菌落;该方法采用的移液枪操作简单、高效和稳定,极大地提高了操作效率;真菌孢子在优化的甲基纤维素半固体培养基内部和液面均能形成单菌落,显著提高了真菌单孢分离的通量;在进行不同诱变条件下诱变孢子的分离以及诱变单菌落的转移时,优化的甲基纤维素半固体培养基法的摇匀孢子和换枪头操作简便高效,此外,甲基纤维素半固体培养基的内部和液面均适合诱变孢子形成诱变单菌落,提高了诱变孢子的分离通量,利用移液枪将目标诱变单菌落接入96深孔板的策略进一步提高诱变真菌的选育效率,而对于传统的平板涂布法[19],涂布器和接种针的灭菌操作较繁琐,诱变孢子仅在平板培养基表面生长,分离通量较低;优化的甲基纤维素半固体培养基易于构建专性需氧和兼性厌氧环境,具有分离专性厌氧和呼吸缺陷型真菌的潜力。
尽管如此,优化的甲基纤维素半固体培养基法的诸多问题仍需改进,如(1)血球计数板计数法繁琐耗时;(2)因纤维素降解酶能降解甲基纤维素,本方法可能不适用于纤维素酶产生真菌的孢子分离;(3)当每20 mL优化的甲基纤维素半固体培养基中的PBS添加量超过200 μL时,优化的甲基纤维素半固体培养基易发生盐析,影响单菌落的观察。对于第一个问题,采用无需荧光标记的神经网络算法计数活细胞[20]和人工智能实验系统[21]来提高效率;优化培养条件以克服第2个,如降低纤维素酶活性和分泌的同时提高菌丝体生长速度,但此问题有待进一步验证明确;可使用灭菌的纯净水制备孢子悬液解决第3个问题。综上,本研究明确了优化的甲基纤维素半固体培养基法分离CM-1和CM-3蛹虫草菌孢子的可行性,利用该方法分离其他真菌孢子的可行性有待进一步验证。

