常压中温下水稻秸秆预处理及酶解研究
白光剑,马一凡,邹伟*
1(四川轻化工大学 生物工程学院,四川 宜宾,644005) 2(浓香型白酒资源微生物与大数据实验室,四川 宜宾,644005)
木质纤维素是地球上最为丰富的有机资源,每年生物圈中可产生大约850亿t,人类仅利用了4.8%[1]。木质纤维素结构独特,是植物经亿万年自然选择的结果,微生物很难快速、直接的将其降解转化,对于生物质资源开发利用是一大难题。大部分的木质纤维素都需要先经过一定的预处理才能被微生物快速利用,预处理是实现木质纤维素高值转化的重要过程。美国国家研究委员会认为好的预处理是不需要减小生物质的粒度,保留半纤维素组分,降低抑制发酵产物的形成,使能耗和成本最低等[2]。中国科学院过程工程研究院陈洪章等指出:理想的预处理应该集中在木质素的去除,以保持细胞壁中结构多糖的完整性,以实现生物质的全利用;同时,希望预处理过程在“常压”下进行,并且使用最小的预处理能耗、价格低廉的预处理化学品和尽可能少的用量[3-4]。
水稻秸秆作为世界三大农作物秸秆之一,全世界2016年水稻秸秆产量约在12.67亿t,其中中国约2.28亿[5]t。水稻秸秆结构独特,生物质顽抗性[6]很强,结晶度高,难以直接利用[7],导致大量的秸秆资源被白白浪费,其资源化的高效利用具有重要意义,水稻秸秆生物炼制是一个重要的方向。但未经过预处理的水稻秸秆难以被微生物利用,因此需要高效的水稻秸秆预处理技术。
根据木质纤维素预处理的相关研究报道,化学处理是生产中最常用的、适于大规模推广的预处理方式。但许多研究为高温高压高浓度的预处理技术,对于水稻秸秆的常压中温低浓度的预处理技术研究较少。本研究探究常压中温低浓度下的、不减小生物质粒度的碱预处理方法,旨在为温和的水稻秸秆预处理技术提供相应的研究探索,为水稻秸秆的相关生物炼制奠定基础。
1 材料与方法
1.1 材料
秸秆来自江苏宿迁某农田,用铡刀铡成1~2 cm的小段,烘干用于后续实验。
1.2 主要试剂与仪器
QYC-2102摇床,上海沪奥明科学仪器有限公司;MJ-250恒温培养箱,四川蜀科仪器有限公司;TG-16医用离心机,四川蜀科仪器有限公司;V-1000可见分光光度,翱艺仪器有限公司;HH-6D数显恒温水浴锅,常州普天仪器制造;VEGA 3SBU扫描电子显微镜,捷克TESCAN公司;Nicolet 6700 FTIR傅立叶变换红外光谱仪,美国Thermo Scientific公司。
里氏木霉CICC 41027,中国工业微生物菌种保藏管理中心;纤维素酶C8270,北京Solarbio。
纤维素酶液:称取 0.200 0 g纤维素酶,溶于pH 4.8 的柠檬酸-柠檬酸钠缓冲液中,并用此缓冲液定容至100 mL,浓度为2 mg/mL。测得此酶液CMC酶活[8]为0.82 IU/mL,滤纸酶活(filter paper activing, FPA)为0.38 IU/mL,β-葡萄糖苷酶活为0.38 IU/mL。酶液应现配现用。
里氏木霉发酵培养基:预处理秸秆(未处理秸秆)20 g,蛋白胨1 g,(NH4)2SO42 g,MgSO4·7H2O 0.5 g,KH2PO22 g,FeSO4·7H2O 0.005 g,吐温-80 1 mL,H2O 1 000 ml,调节pH 5.5~6.0。
2 实验方法
2.1 预处理
实验流程:水稻秸秆→切段(1~2 cm)→烘干→不同条件下处理→水洗→烘干→酶解→计算产糖量
预处理:准确称取20 g烘干秸秆,装于抗腐蚀的滤袋(M0)中,记录秸秆和滤袋总重M1,装于500 mL广口瓶中,浸没于不同的处理液中,固液比1∶10(g∶mL),用保鲜膜套在瓶塞前防止腐蚀,置于对应温度的恒温培养箱中(加温度计校正),每12 h翻动一次。浸泡处理结束后,水洗至中性,70 ℃烘干36 h,待用,记录总重量M2。
2.1.1 不同试剂处理秸秆
根据预实验和文献参考,选择NaOH、Ca(OH)2、亚硫酸钠、尿素、稀硫酸配制成相应浓度稀溶液,固液比为1∶10(g∶mL),将秸秆浸没其中,于50 ℃下处理36 h,水洗、烘干、酶解。
2.1.2 预处理温度
选择2.1.1中效果最好试剂NaOH进行温度单因素实验,将处理温度设置为20、30、40、50、60 ℃,固液比1∶10,质量浓度1 g/dL,处理36 h,水洗、烘干、酶解。
2.1.3 不同时间
在NaOH质量浓度1 g/dL,温度50 ℃,固液比1∶10的条件下,选择不同浸泡时间,6、16、24、36、48、72 h,水洗、烘干、酶解。
2.1.4 不同浓度
在温度50 ℃,处理时间48 h,固液比1∶10的条件下,选择不同质量浓度的NaOH溶液,0、0.4、0.8、1、1.2、1.4、1.6、2 g/dL,水洗、烘干、酶解。
2.1.5 响应面
以单因素实验结果为基础和Box-Behnken实验原理,以初始秸秆比产糖量为响应值,分析NaOH预处理秸秆过程中温度、时间、NaOH浓度3个因素对秸秆酶解产糖的影响。
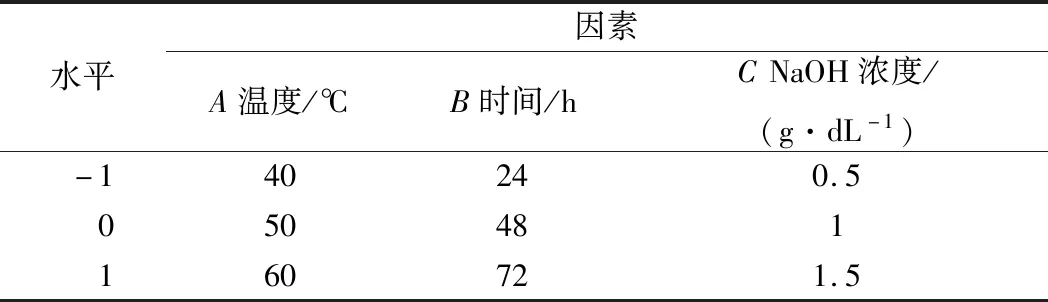
表1 响应面试验因素与水平表Table 1 Factors and levels of response surface design
2.3 酶解
准确称取0.500 0 g预处理烘干至恒重的秸秆,置于150 mL锥形瓶中,加45 mL柠檬酸缓冲液(0.05 mol/L, pH 4.8),加5 mL配制好的标准酶液,将锥形瓶封口后置于恒温摇床,50 ℃,80 r/min,酶解72 h,取样测还原糖[9]。
取酶解液5 mL于离心管中,8 000 r/min,离心5 min,取上清液用DNS法测还原糖含量[10],计算产糖量。
预处理后秸秆保留量(g/g):预处理过程中会有木质素、纤维素、半纤维素、脂肪等物质的流失,处理强度越大秸秆质量流失越严重,通过对预处理前后质量的检测,计算出单位初始秸秆经过预处理后剩余质量,作为对预处理的评估指标之一。
(1)
预处理秸秆酶解产糖量(g/g):对预处理后的秸秆用标准酶液在适宜的酶解条件下酶解,使纤维素、半纤维素变成还原糖,测单位预处理秸秆在相同酶解条件下还原糖的产量,产糖量越多说明其预处理效果越好,更利于秸秆纤维素的分解转化。
预处理秸秆产糖量(g/g)=
(2)
初始秸秆比产糖量(g/g):在一定的预处理强度范围内,预处理后的单位秸秆酶解产糖量随着预处理强度增加,对秸秆结构的破坏程度越强,其酶解产糖量也越高,但同时预处理造成的秸秆质量损失也越多,因此引入单位初始秸秆经过预处理和酶解后的产糖量作为预处理的综合评估指标。
初始秸秆比产糖量(g/g)=预处理秸秆产糖量(g/g)×预处理秸秆保留率
(3)
2.4 电镜扫描
取未处理和预处理的水稻秸秆,制片、喷金,用电子扫描显微镜观察样品微观结构,比较结构变化。
2.5 红外光谱分析
取未预处理和预处理的水稻秸秆,粉碎为40目粉末,进行红外光谱分析,扫描波数范围为4 000~500 cm-1,比较预处理前后秸秆结构和官能团的变化。
2.6 微生物发酵产酶初试
以秸秆为唯一碳源,分别取预处理和未处理秸秆2 g,配制液态培养基,于250 mL锥形瓶装液100 mL接种5 mL里氏木霉种子液,28 ℃、180 r/min培养5 d,测发酵液中的还原糖和FPA酶活[10]。
2.7 统计分析
采用Excel对试验数据初步处理,再用Design Expert 8.0处理数据,Origin8.5作图,试验结果以“平均值±标准差”表示。
3 结果
3.1 预处理结果
3.1.1 不同试剂
根据秸秆类原料预处理的相关文献[11-12],选择NaOH、Ca(OH)2、Na2SO3,尿素,H2SO4等几种对秸秆预处理效果较好的化学试剂作为预处理试剂[13],在预设的较温和预处理条件下比较预处理效果。由于Na2SO3、尿素、H2SO4在同类预处理研究中所用浓度较高,故本试验中其浓度为NaOH、Ca(OH)2的2倍。由图1可知,从秸秆保留量来看,在实验条件下,NaOH、Ca(OH)2、H2SO4三种试剂处理明显对秸秆的结构造成了影响,而Na2SO3、尿素对秸秆质量的影响小,同时对其预处理后的秸秆质地观察,发现秸秆结构完整,处理前后变化小。从产糖量来看,经Na2SO3,尿素溶液处理后的秸秆,纤维素酶基本不能酶解,结合相关研究,说明在本试验所选择的温和条件下,Na2SO3、尿素,不适合作为处理试剂。
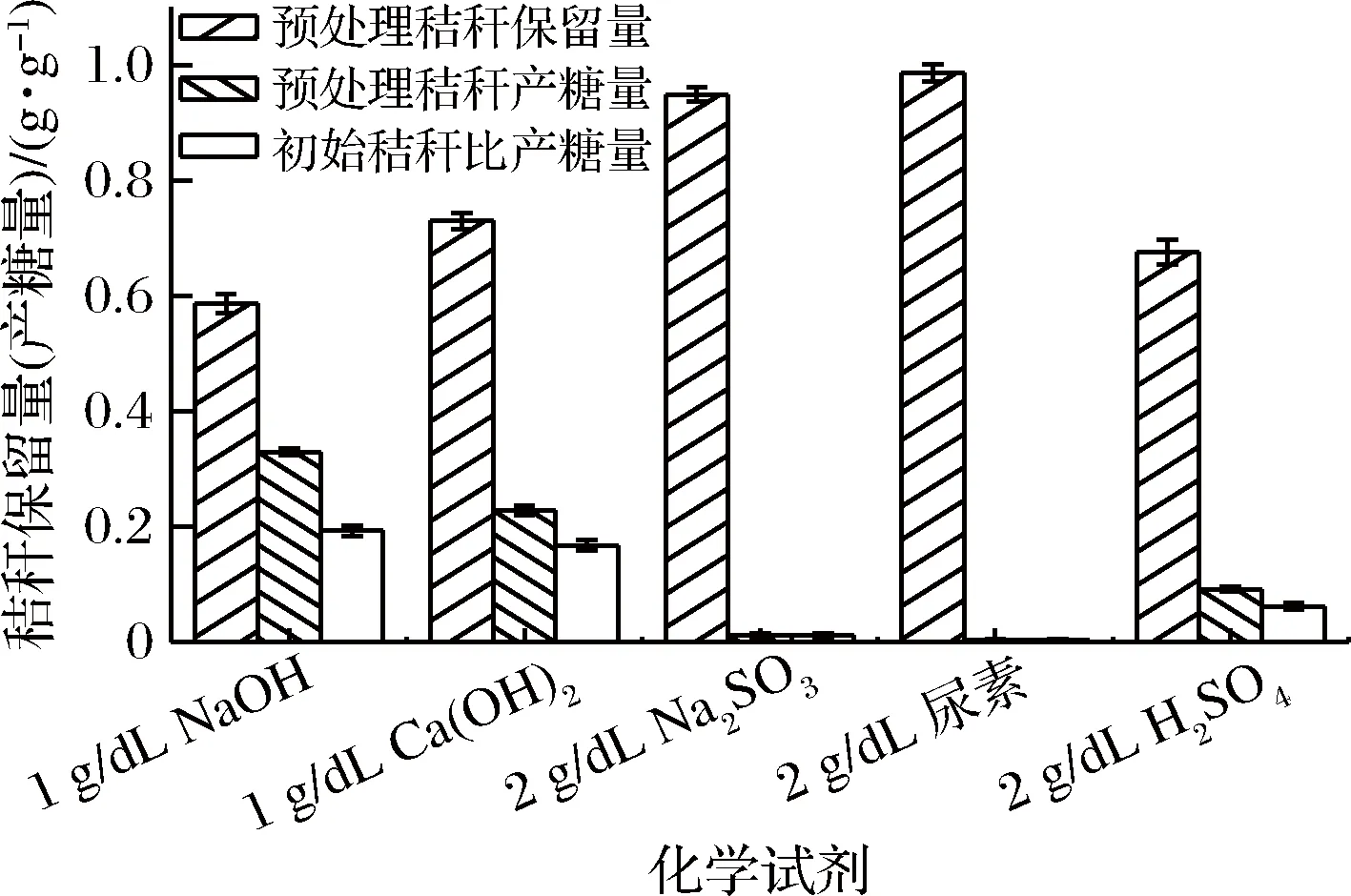
图1 不同化学试剂对预处理的影响Fig.1 Effect of different chemical reagents on pretreatment
由图1可知NaOH、Ca(OH)2、H2SO4三种试剂溶液对水稻秸秆有处理效果,预处理秸秆酶解产糖量(g/g)分别为0.329、0.228、0.092 g/g,初始秸秆比产糖量(g/g)分别为0.193、0.167、0.062 g/g,结合同类研究[14],Ca(OH)2对秸秆有不错的效果,但一般处理时间较长,而H2SO4对秸秆的处理机制是溶解半纤维素转化为还原糖[12],许多还原糖直接溶于处理液中[15],对打破秸秆结构和木质素的去除是不如碱处理的[16]。与同类研究结果能相互印证[17],结合试验目的,最终选择NaOH作为后续实验试剂。
3.1.2 不同温度的预处理
由图2可知在固液比1∶10,NaOH浓度1 g/dL,36 h条件下预处理,秸秆保留量随温度升高而减少,而同时预处理秸秆产糖量随温度升高而增加,说明随着温度升高,在处理液的作用下秸秆的结构被破坏程度越高,秸秆更容易被纤维素酶酶解为还原糖,这符合秸秆预处理过程的理论。初始秸秆比产糖量随温度先升高后缓慢下降,在50 ℃时达到最高,而预处理秸秆产糖量仍在增加,说明随着温度的升高,秸秆保留量的减少与预处理秸秆产糖量增加的效能平衡开始向不利于比产糖量发生偏移。

图2 温度对预处理的影响Fig.2 Effect of temperature on pretreatment
3.1.3 不同时间的预处理
由图3可知,在NaOH 1 g/dL,温度50 ℃,固液比1∶10(g∶mL)的条件下,预处理时间越长,秸秆保留量越少,预处理秸秆产糖量和初始秸秆比产糖量均随时间先增加后减少,48 h达到最高。由图3可知,3种评估指标随时间的变化趋势缓慢,说明时间因素对预处理影响较小。
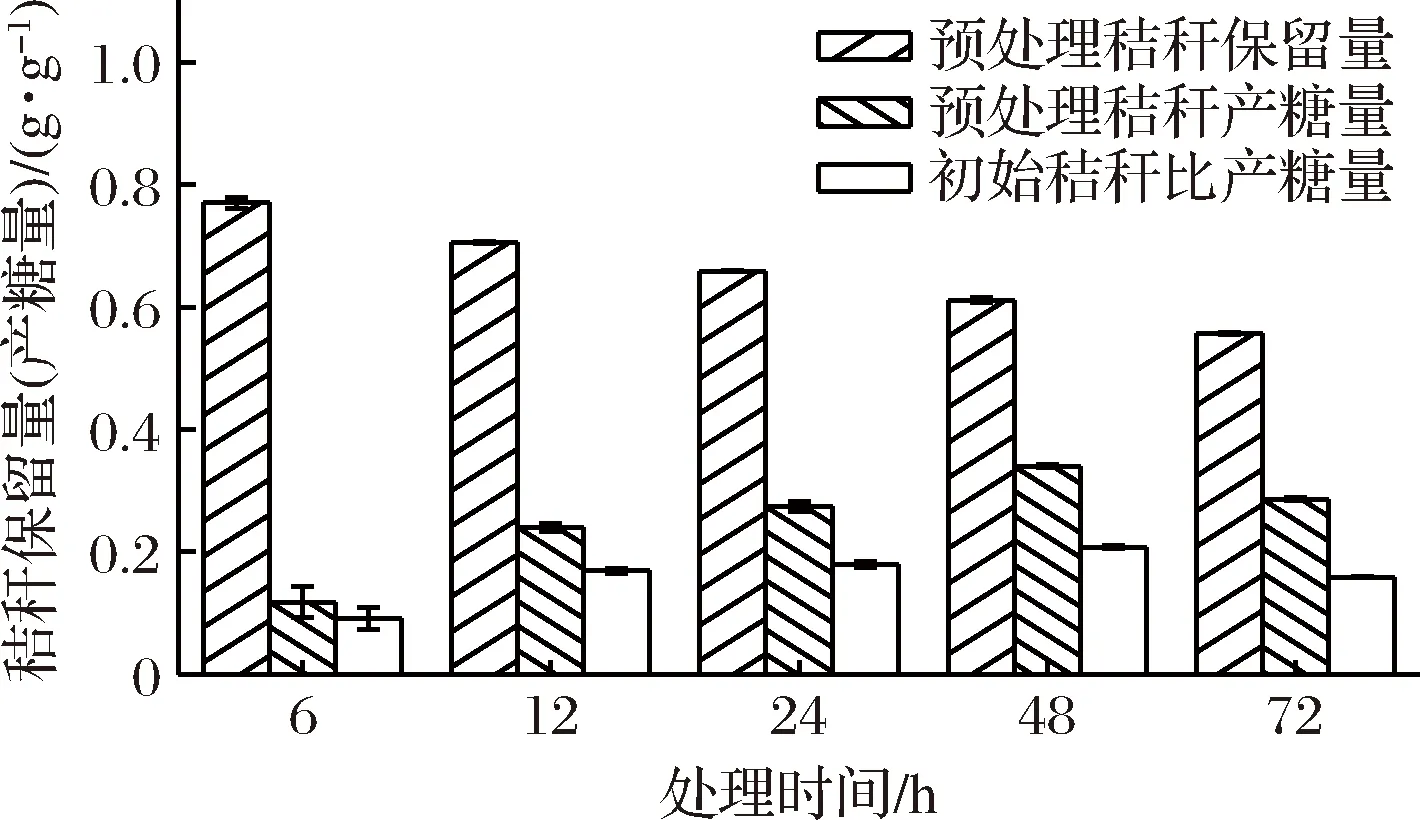
图3 处理时间对预处理的影响Fig.3 Effect of process time on pretreatment
3.1.4 不同浓度的预处理
由图4可知,在温度50 ℃,处理时间48 h,固液比1∶10的条件下,秸秆保留量随浓度增加而减少,预处理秸秆产糖量随浓度先增加后趋于平稳最后开始减少,初始秸秆比产糖量先增加后平稳后减少。在蒸馏水中浸泡秸秆质量损失约为12%,但酶解产还原糖量几乎没有,仅为0.004 g/g,实验中发现蒸馏水预处理后的秸秆,物理结构和化学结构基本无变化,酶解后变化也很小,与未处理秸秆酶解效果非常接近。相较于蒸馏水,经0.4 g/dL NaOH溶液处理后,酶解后预处理秸秆产糖量和初始秸秆比产糖量有明显提升,分别为0.136 g/g和0.109 g/g。水稻秸秆结构致密,结晶度高,顽抗性高,蒸馏水无法打破其结构,而NaOH可以切断木质素和碳水化合物之间的连接键并破坏木质素的结构,使碳水化合物更容易受到酶的攻击[18]。由图4可以看出在本试验条件下,NaOH浓度在0~1 g/dL内产糖量随浓度增加趋势大,在高于1 g/dL以后增长慢,并逐渐趋于平稳,至16 g/dL后开始下降。初始秸秆比产糖量在1 g/dL时达到最大。
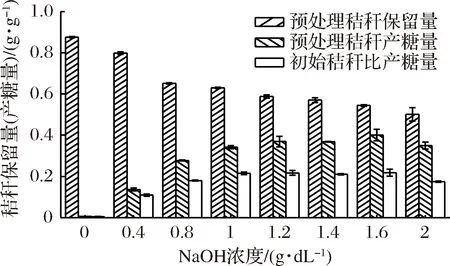
图4 NaOH浓度对预处理的影响Fig.4 Effect of NaOH concentration on pretreatment
3.1.5 响应面试验及分析
按表2进行回归分析,初始秸秆比产糖量(R)的回归方程:
R=0.22+0.021A+0.004 125B+0.069C-0.012AB-0.021AC-0.006BC+0.009 3A2+0.003 825B2-0.054C2
根据方差结果分析(表4),模型项极显著(P<0.01);失拟项(P>0.05)不显著。表明在试验参数范围内,模型合理,可以用来推测和分析预处理试验结果。由表3可知,3个因素对初始秸秆比产糖量的影响顺序为C(浓度)>A(温度)>B(时间),其中一次项A、C,交互项AC、二次项C2对响应值极显著(P<0.01),B(时间)在试验参数范围内对响应值初始秸秆比产糖量无显著影响(P>0.05)。
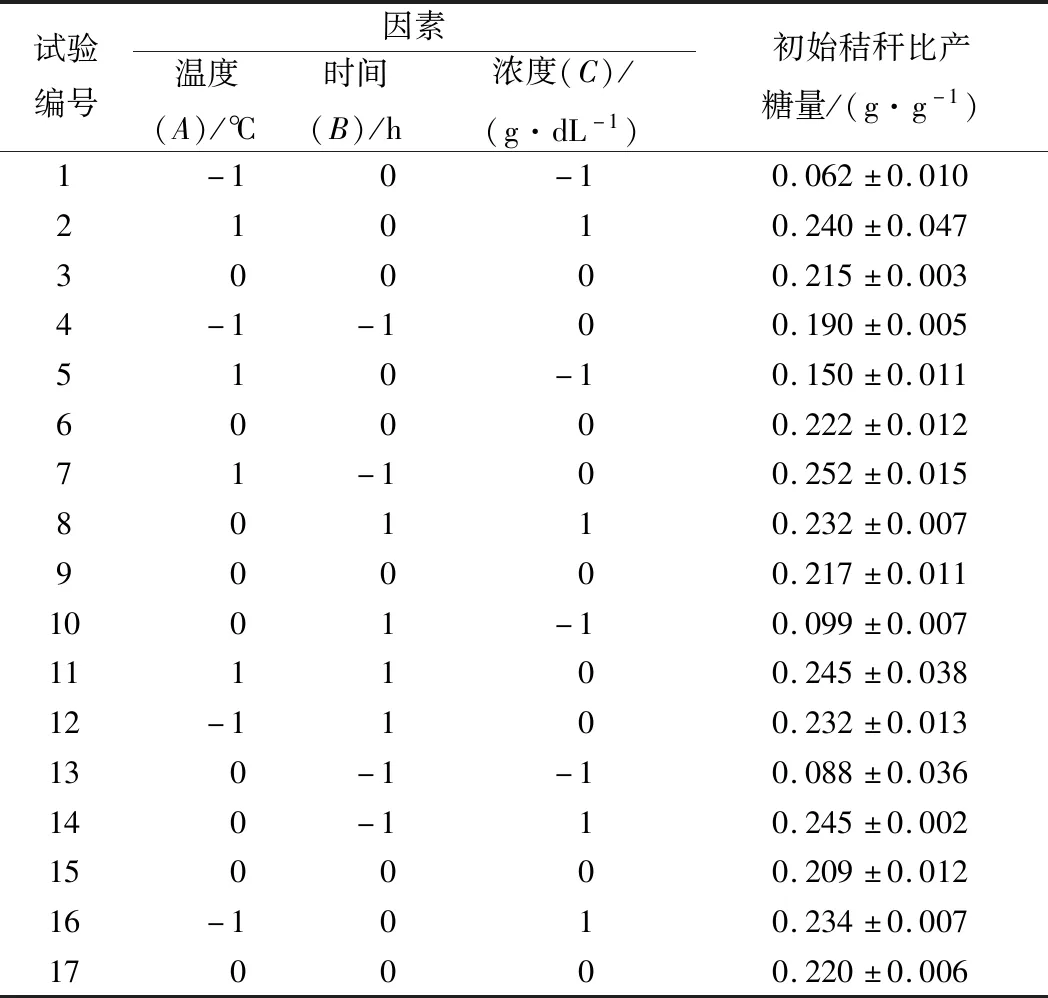
表2 Box-Behnken设计与结果Table 2 Experimental design and result of response surface design
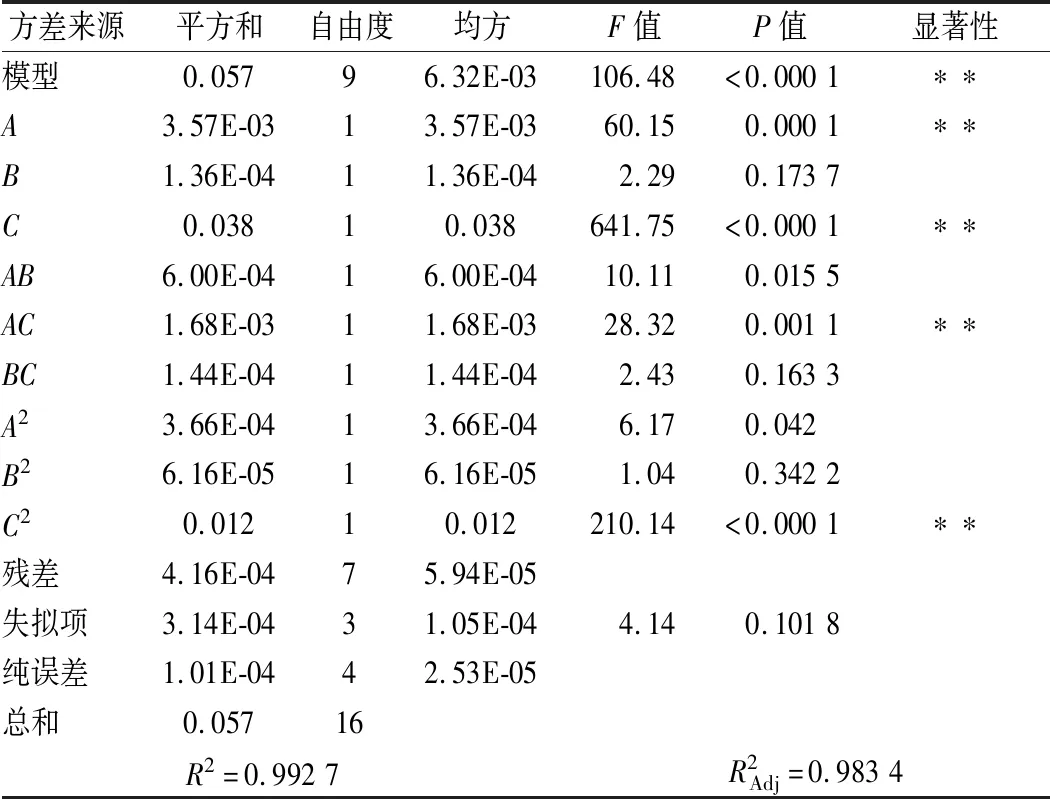
表3 回归方程方差分析表Table 3 Analysis of variance for the regression equation
注:P<0.05(显著,*);P<0.01(极显著,**)。
由图5-A温度和时间对预处理产糖交互作用图可知,浓度一定时,处理时间越短,温度对预处理的贡献越大。在同类预处理研究中也证明温度越高所需预处理时间越短,也有研究表明高温长时间的预处理会使秸秆中可酶解的成分流失更多,反而预处理效果不好[18]。结合图5-B和图5-C可知在试验条件下,预处理效果的对时间的响应小于温度和浓度的。

A-温度和时间;B-浓度和温度;C-浓度和时间图5 响应面交互作用图Fig.5 Contour and interaction diagrams of response surface analysis
3.1.6 结果验证
经过响应面优化,得到最适酶解的预处理条件参数为A(温度) 56.7 ℃、B(时间) 29.52 h、C(浓度) 1.35%。在此条件下初始秸秆比产糖量最大预测值为0.256 g/g。为了便于操作,将优化参数修正为温度55 ℃、时间30 h、浓度1.3%。在此条件下,进行3次试验验证,下初始秸秆比产糖量为 0.271 g/g,与预测值相比,误差为1.06%。因此该模型能够预测该条件下水稻秸秆预处理和初始秸秆比产糖量的关系。
3.2 预处理前后结构变化
由图6可知,未处理秸秆表面光滑,结构完整,呈规则的网状三维结构,刚性强,不易被破坏;预处理后秸秆表面粗糙,蓬松柔软,结构坍塌,失去完整结构。
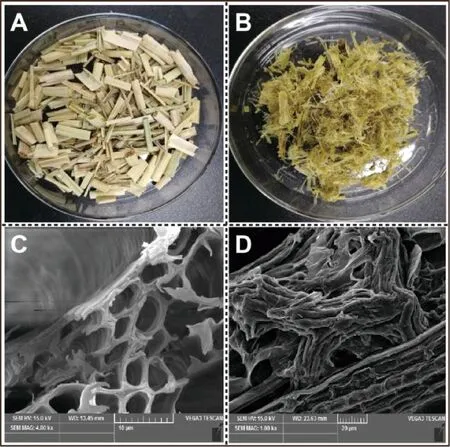
A-未处理秸秆;B-预处理后的秸秆;C-未处理秸秆扫描电镜图;D-预处理秸秆扫描电镜图图6 未处理(左)与碱处理秸秆(右)扫描电镜图Fig.6 Scanning electron micrographs of untreated (left) and NaOH treated (right) straw
结合碱处理机理,OH离子能削弱半纤维素同纤维素之间的氢键和木质素分子与半纤维素之间的酯键,使秸秆结构被打破,使半纤维素和木质素溶出,使得碳水化合物更容易受到酶的攻击,同时由于NaOH的作用,纤维素发生水化膨胀,导致纤维素的聚合度和结晶度有所下降,木质素和碱抽出物等组分降解和溶出以及原料空隙发生润胀,使原料的多孔性增加和内比表面积的增大,改善了酶的可渗透性,从而提高了酶与纤维素的接触面积和酶的水解速率[18]。故经过预处理的秸秆更易于纤维素酶的吸附、酶解。
3.3 红外光谱分析
由图7可知经过预处理后,秸秆的部分特征峰发生了明显变化。根据木质纤维素官能团的特征峰所知[19-20],3 426 cm-1处代表的是O—H伸展振动,而2 922 cm-1处的峰代表的是脂肪族中CH2和CH3伸缩振动,这些与纤维素及木质素、半纤维素中的脂肪族基团相应;1 734 cm-1代表半纤维中的乙酰基或糖醛酸酯键或者木质素和半纤维素间通过阿魏酸或对香豆酸连接的酯键;1 604 cm-1代表芳香族骨架振动;1 246 cm-1代表愈创木基C—O;1 032 cm-1代表芳香碳氢键在平面变形。

图7 预处理秸秆与未预处理秸秆红外光谱图Fig.7 Infrared spectra of untreated and NaOH treated straw
这说明碱处理后,水稻秸秆外表面由长链脂肪酸形成的致密保护层被破坏,水稻秸秆中纤维素、半纤维素和木质素间通过化学键连接的晶格结构被打破,秸秆的顽抗性降低,结晶度减弱,微生物和酶更易进入到水稻秸秆的内部结构中,增强了微生物对水稻秸秆的生物降解性能。
3.4 微生物发酵产酶初试
由图8可以看出,以未处理的水稻秸秆唯一碳源的发酵培养基中,接种里氏木霉后,发酵液中未见微生物生长,秸秆形态完整。与之相比,经预处理的秸秆发酵培养基中,发酵液变成里氏木霉发酵的典型黄色,观察发酵过程,在第2 d即可明显看到大量里氏木霉菌体,同时观察到秸秆段断裂、变小;在发酵第5 d时,发酵液中已看不到成形的秸秆,而未处理秸秆几乎无变化。对图8中两种发酵液,取发酵液测酶活,测得预处理秸秆发酵液中FPA酶活为0.522 IU/mL,未处理秸秆发酵液中未检测到FPA酶活。

图8 未处理(左)和预处理秸秆(右)接种里氏木霉发酵5 dFig.8 Untreated (left) and pretreated straw (right) were inoculated with Trichoderma reesei for 5 days
4 讨论
水稻秸秆全球产量大,又需要合理利用,是重要的生物质资源,但由于其独特的结构,难以直接利用,对于水稻秸秆的生物炼制来说,预处理是必不可少的一个环节。通过有效的预处理改变木质纤维素的结构,使纤维素易被酶解转化为可发酵糖,进而转化为更多的高值产品。预处理是木质纤维素生物炼制中成本最高的一步操作,通过研发、技术的改进,预处理成本的降低还有很大的空间[21]。
通过试验和结合文献发现,在一定范围内,温度、时间和浓度对水稻秸秆预处理的影响都是正向贡献的,是从三个维度上的强度积累,且都积累于打破秸秆结构上。在这三个因素中,时间是对另外两个因素的完全积累作用,温度和浓度对预处理的积累作用是既有交互又有独立的。因此,预处理对秸秆的影响的强度积累必然存在“阈值”,这个阈值很难直接找到,通常间接表现为一些观测值,例如秸秆的物理性质、化学性质、试验响应值等。阈值源于整个预处理过程中所有影响因素的共同积累,因此可以表现成多个点。在试验过程中可以根据单因素、正交、响应面等试验方法寻找这些阀值的简化表现点,然后根据具体情况选择我们需要的点,并做出适当优化,得到好的预处理方案。
本试验以常温常压低浓度,不需要减小秸秆的粒度的预处理思路出发,采用单因素和响应面法探究水稻秸秆的碱处理条件,以秸秆保留量(g/g),预处理秸秆产糖量(g/g)、初始秸秆比产糖量(g/g)为评估指标。不同试剂的单因素实验显示,NaOH对水稻秸秆的预处理效果最好,处理条件各因素对其影响主次为:浓度>温度>时间,响应面实验也验证了这一点。通过响应面确定了最佳预处理条件为温度55 ℃、时间30 h、浓度1.3%。对预处理后的水稻秸秆进行扫描电镜微观结构观察和红外光谱分析都表明预处理打破了水稻秸秆的一些关键结构,使其更容易被纤维素酶吸附、酶解。对预处理后的水稻秸秆用里氏木霉进行发酵,里氏木霉生长良好,在发酵5 d测得FPA酶活为0.522 IU/mL,而未处理的秸秆完全不能被微生物利用。经过预处理的水稻秸秆具有一定的生物炼制潜力,可以通过微生物发酵制备燃料乙醇、丁醇、秸秆饲料等。

