耐高糖产香酵母菌的分离鉴定及其应用
李梦琦,赵一凡,郑飞云,钮成拓,刘春凤,李崎,王金晶*
1(江南大学 生物工程学院,工业生物技术教育部重点实验室, 江苏 无锡,214122)2(江南大学,酿酒科学与工程研究室, 江苏 无锡,214122)
食品中常添加酵母以增加食品的香气及特殊风味。在葡萄酒发酵中,添加胶红酵母提高糖苷酶活性以增加香气[1]。酿酒酵母和毕赤酵母混合发酵增加花香果香[2],尤其热带水果香气。白酒酒糟中分离得到的高产酯的毕赤酵母高产乙酸乙酯也用于发酵食品的增香[3]。球拟酵母加入酱醪中使酱油酯香更浓郁。食用酵母对人体的健康有益。酵母本身富含多种营养物质,如VB族;部分酵母还富含微量元素,如硒等[4]。此外,氨基酸、多糖等也是酵母中对人体健康有益的成分,如酵母多糖是一种天然高效的活性调控剂,可调节肠道菌群平衡,维持肠道健康和增强机体免疫力,减少疾病发生,增强消化吸收功能[5]。因此在食品中直接添加酵母在增加食品风味的同时也增加了食品的营养。食品中也常添加酵母抽提物,它具有核苷酸、多肽、氨基酸等风味物质,是继味精、水解蛋白、呈味核苷酸后的第4代富含营养物质的天然调味料。
鲁氏酵母(Zygosaccharomycesrouxii)是常见的耐高渗透压酵母菌,在含食盐质量分数为5%~8%的培养基中生长良好,能在一定浓度的葡萄糖、麦芽糖、果糖、甘油为碳源的培养基上生长[6-7],耐高糖的鲁氏酵母有利于促进甜酱酱油等食品的发酵。鲁氏酵母主要作为发酵食品的生产菌,常应用于生产酱油[8]、酱[9]、甜酱、日本味增和泰国发酵鱼制品、面包[10]等发酵制品。鲁氏酵母在酱油发酵中主要作用为产生乙醇、高级醇,如异戊醇、异丁醇等醇类物质、芳香杂醇类物质(如乙醇、3-甲硫基丙醇、异戊醇)[11]。此外,鲁氏酵母可以增加酱油中的琥珀酸含量使酱油的滋味得到改进。从糠醛生成糠醇也是鲁氏酵母的重要作用。鲁氏酵母在酱中发酵产生类似焦糖味的呋喃酮类风味物质,可以提高酱中的总氨基酸含量,增加甜酱的鲜味,增加酱的香味,并且提高总抗氧化活性[12]。酱、酱油等食品的高糖和高盐的特性使获得1株耐高糖的鲁氏酵母具有重要的意义[13]。我国关于鲁氏酵母的研究多集中于在发酵食品中的应用,比如在香肠的发酵中添加鲁氏酵母提高发酵香肠品质[14],添加在酱和酱油等制品中使其有更好的风味及挥发性香气等[11-13]。国外对于鲁氏酵母的研究除了在食品中的应用,还对鲁氏酵母耐高渗等特性的的机理进行研究[15-16]。甜酱、酱油等食品中糖度高,若能在酱中进行发酵的耐高糖鲁氏酵母菌株更有生存优势,为酱带来更好的风味。不仅如此,鲁氏酵母本身具有鲜味,加入酱中也可以明显提升酱的鲜味。
柿子饼又称柿饼,天然晒制而成,是我国的传统特色小吃。柿饼富含果糖、葡萄糖、天然有机酸、锰、钙、维生素等[17],营养价值高,所含维生素和糖分比一般水果高1~2倍。在晒制过程中,柿子汁液中的糖分得到了浓缩,柿子表面存在的细菌和真菌大都已经凋亡,仅有一些耐高渗的菌株存活下来。同时,由于柿饼的风味独特,柿饼表面存活的菌株可能会存在特殊风味。本研究从柿饼表面筛选耐高糖的酵母菌株,在不同碳源、不同浓度的固体培养基上点样确定该菌株不同碳源的耐受性,在液体培养基中发酵6 d对发酵液风味物质进行测定,并将其加入酱、酱油等发酵食品中,品评得到该菌发酵食品的影响,以期获得较好的增香效果。
1 材料与方法
1.1 主要试剂
富集培养基(g/L):氨苄青霉素0.1,酵母粉10,蛋白胨20,葡萄糖20;YPD培养基(g/L):酵母粉10,蛋白胨20,葡萄糖20;高葡萄糖培养基(g/L):葡萄糖,酵母粉10,蛋白胨20;高葡萄糖固体培养基(g/L):葡萄糖,酵母粉10,蛋白胨20,琼脂20;高蔗糖固体培养基(g/L):蔗糖,酵母粉10,蛋白胨20,琼脂20;高果糖固体培养基(g/L):果糖,酵母粉10,蛋白胨20,琼脂20;高麦芽糖固体培养基(g/L):麦芽糖,酵母粉10,蛋白胨20,琼脂20;淀粉固体培养基(g/L):淀粉,酵母粉10,蛋白胨20,琼脂20;高盐固体培养基(g/L):NaCl,酵母粉10,葡萄糖20,蛋白胨20,琼脂20。
1.2 仪器与设备
PL2002电子天平、AL204分析天平,梅特勒-托多仪器有限公司;BSP-250生化培养箱,上海博讯公司;气相色谱串联质谱联用仪,美国瓦里安公司;DYY-8C型电泳仪,北京市六一仪器厂;TC5000 PCR仪,英国TECHNE公司;GelDoc-ItTM凝胶成像系统,美国UVP公司;GC-2010顶空气相色谱仪,日本岛津公司;显微镜,日本Olympus公司;UV1102可见分光光度计,上海天美科学仪器有限公司。
1.3 实验方法
1.3.1 样品采集
从柿饼表面采用随机取样的原则收集样品,装入灭菌袋,于冰箱中贮藏备用。
1.3.2 菌种的分离与筛选
将样品过滤除杂后取适量加入有100 mg/L的氨苄青霉素的富集培养基中28 ℃培养24 h,取镜检后有活菌存在的培养液1 mL接入含有葡萄糖400 g/L的高糖固体培养基中。28 ℃培养72 h待长出菌落后,选长势良好,且具有典型酵母菌落特征单菌落进行划线分离,经镜检为纯种后分别转入YPD固体斜面,低温保存。
1.3.2.1 菌株耐受性分析
对分离获得的菌株进行耐受性分析,评价菌株在不同碳源及不同浓度的NaCl平板上的生长状况。取1环酵母在不同浓度不同碳源(葡萄糖、蔗糖、果糖、麦芽糖、淀粉)的平板培养基上由外至圆心进行扇形划线,28 ℃培养48 h,测定所筛酵母对于不同碳源的耐受性。取一环酵母在不同浓度NaCl的平板培养基上由外至圆心进行扇形划线,28 ℃培养48 h,测定所筛酵母对于NaCl耐受度。
1.3.2.2 菌株生长曲线的测定
酵母菌株以1%的接种量接种入YPD培养基中,28 ℃,180 r/min摇床培养12 h,再以10%接种量接入YPD培养基,200 g/L高葡萄糖培养基,400 g/L高葡萄糖培养基。从接入时计为0 h,0~46 h内定点取样。无菌水清洗1次,酶标仪测定600 nm处分光光度值。
1.3.3 菌种鉴定
挑取斜面保藏的菌株1~7号于10 mL YPD培养基中,28 ℃、180 r/min培养24 h。取适量培养液离心1 min(12 000 r/min),弃上清,采用酵母DNA提取试剂盒提取菌体DNA,用酵母ITS通用引物(引物序列见表1)扩增基因组DNA,PCR产物用2.0%琼脂糖凝胶电泳检测,并进行测序。采用BLAST方式将测定的18S rDNA序列与GenBank中酵母菌的序列进行比对,构建菌株系统发育树。

表1 酵母ITS通用引物序列Table 1 Common primer sequences of yeast
1.3.4 菌株发酵实验及基本风味物质测定
1.3.4.1 菌株发酵实验
取1环酵母接种入10 mL的YPD培养基中,28 ℃,180 r/min过夜活化。在400 g/L葡萄糖含量的高糖培养基中以107CFU/mL接种量接种,在28 ℃静置发酵6 d。发酵完成后,以GB/T 4928—2008中方法对发酵液酒精含量及总浸出物含量进行测定[18]。
1.3.4.2 发酵液风味物质含量测定
酵母菌株发酵液主要醇酯类风味物质含量采用顶空气相色谱法进行测定。发酵结束后,取酵母发酵液样品过滤除气。添加1.8 g无水NaCl到5 mL除气之后的发酵液样品,置于顶空进样瓶中并盖好橡胶盖,振荡溶解。气相色谱条件如下:
色谱柱采用PEG-20M石英毛细管柱(30 m,I.D. 0.32 mm),检测顶空平衡温度70 ℃下平衡30 min。130 ℃传输线温度,200 ℃进样口温度,进样时间为0.04 min。柱流量为1.2 mL/min,载气(N2)流量为30 mL/min,燃气采用H2流量为47 mL/min,助燃气流量400 mL/min。检测器采用氢火焰离子化检测器(FID),温度为250 ℃,程序升温(10 ℃/min):40~180 ℃。
1.3.4.3 菌体挥发性物质测定
将酵母菌活化后按1%接种量接种入YPD培养基,28℃,180 r/min摇床培养24 h后,无菌水清洗,离心取菌泥。
样品前处理萃取条件:20 mL顶空瓶中,加入2 g酵母菌泥样品,10 μL、10 280 μg/L 2-辛醇,在45 ℃预热5 min,萃取60 min。萃取完成后,将萃取头插入进样口,解吸附5 min,进行GC-MS分析,实验以2-辛醇为内标作半定量分析。
GC分析条件为:PEG-20 M弹性石英毛细管柱(30 m×0.25 m×0.25 μm);载气为高纯氦气,恒定流量为0.8 mL/min;升温程序:从180 ℃开始,保持2 min,以3 ℃/min升温到230 ℃,保持10 min;进样口温度250 ℃,出样口温度200 ℃;检测电压350 V。MS条件:EI离子源,发射电流200 μA,电子能量70 eV,扫描范围20~550 U。
1.3.5 菌株JNBZR01的应用
菌株于YPD培养基中培养后收集菌泥,冷冻干燥后添加于食品中:将冻干得到的菌粉取0.5 g添加到100 g食醋1,食醋2,黄豆酱1,黄豆酱2,酱油中,即添加量均为0.5 %(质量分数)。搅拌均匀。
2 结果与分析
2.1 菌种的筛选及鉴定
柿饼表面存在大量的微生物,且由于其含糖量极高,非常适于筛选耐高渗透压的微生物。本研究在柿饼表面筛选获得了具有耐高渗、耐高糖特性的酵母菌,能够在具有高渗透压的环境中生长发酵,其发酵液有特殊香气,有利于其在工业中的应用。
2.1.1 菌种的分离筛选
在柿饼表面随机取样并在含有氨苄青霉素的富集培养基培养,之后于含有400 g/L葡萄糖的高糖YPD平板上分离获得了7株菌株。菌落菌体特征如表2所示,菌落均呈乳白色且表面光滑,5号菌细胞为椭圆形,其余6株为圆形。

表2 菌落菌体特征Table 2 Colony and bacte1ial characteristics
2.1.2 碳源及渗透压耐受性分析
将分离获得的7株菌在不同浓度不同碳源的高糖培养基上进行扇形划线,以菌株是否生长确定出每一株菌对不同碳源的最高耐受浓度。结果如图1所示,1号和6号菌株对于蔗糖的耐受性在7株菌中最高,达到600 g/L,对NaCl的耐受性在7株中最高,达到120 g/L。2号、3号、4号、5号菌株对于葡萄糖、蔗糖、果糖、麦芽糖的耐受性相同,但对蔗糖耐受性低于1号、6号、7号菌株,对于NaCl的耐受性略有差异,分别为80、80、70、90 g/L。7号菌株对于葡萄糖的最高耐受浓度为540 g/L,耐受性略高于其他6株,对蔗糖及麦芽糖的最高耐受浓度均为600 g/L,对NaCl的最高耐受浓度为120 g/L。7株菌对果糖的最高耐受均为600 g/L,对淀粉的最高耐受浓度均为100 g/L。
由图1可知7株菌株对不同的碳源有着不同的利用偏好,1号菌株及6号菌株对于蔗糖的耐受性及渗透压耐受性更好。2号、3号、4号、5号菌株更偏爱利用葡萄糖,果糖,麦芽糖,对于渗透压耐受性相较其他菌株较差。7号菌株更喜爱利用蔗糖和果糖,有较高的渗透压的耐受性。总体而言,7株菌株对于葡萄糖、果糖、麦芽糖、蔗糖这几种碳源都有良好的耐受性,一定的淀粉酶活性和较好的渗透压耐受性,7株菌株之间差距虽较小,但1号菌株和6号菌株的综合耐受性更优。
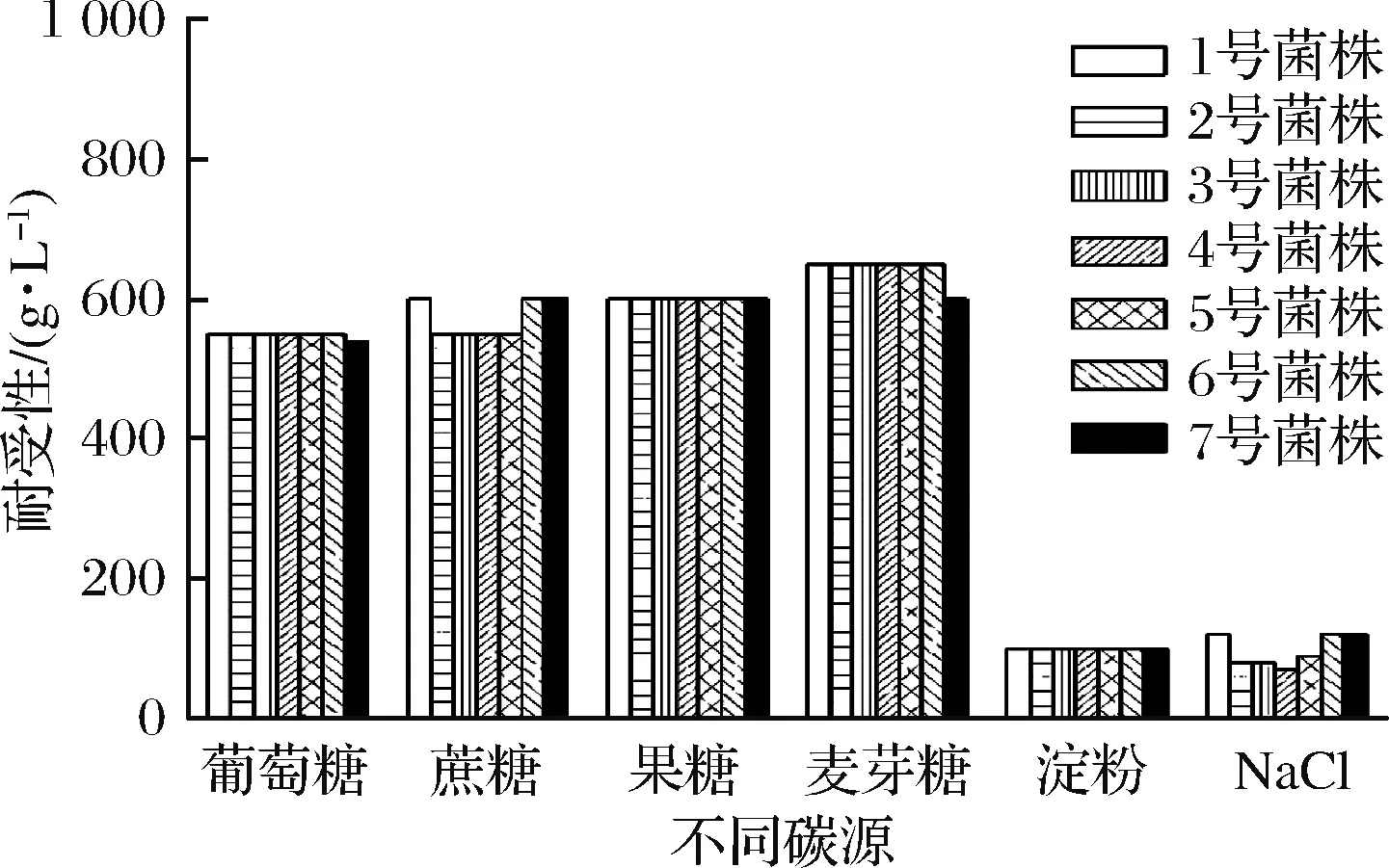
图1 菌株对不同碳源及NaCl的耐受性分析Fig.1 Tolerance analysis of different strains against different carbon sources and NaCl
2.1.3 菌种鉴定
7株菌的基因组DNA用酵母ITS通用引物进行PCR扩增(图2),将产物进行测序,结果与Genbank中酵母菌的18S rDNA序列进行比对,结果均为鲁氏酵母(Zygosaccharomycesrouxii),其中1号和6号为同一株菌,2号、3号、4号、5号菌株为同一株菌。选取1号、5号和7号进行进一步研究。
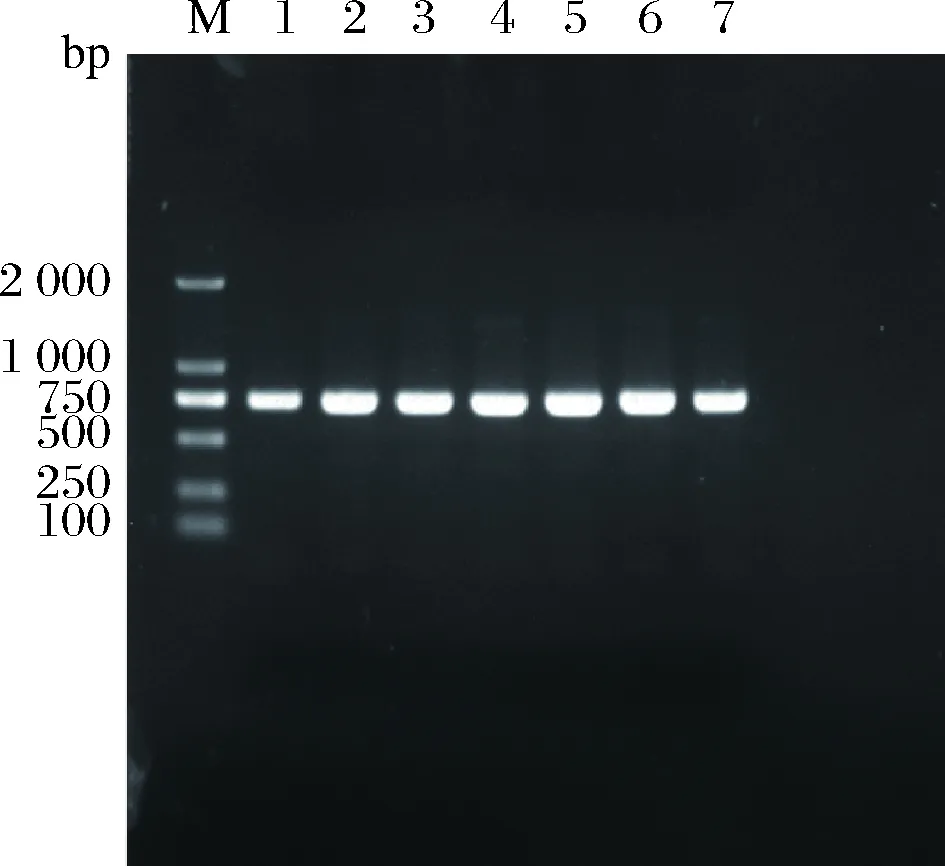
M-Maker;1-1号菌株;2-2号菌株;3-3号菌株;4-4号菌株;5-5号菌株;6-6号菌株;7-7号菌株图2 七株菌18S rDNA PCR产物电泳图Fig.2 PCR results of 18S rDNA of 7 strains
2.1.4 发酵液主要风味物质分析
对1号、5号、7号菌的发酵液进行风味物质组成分析,结果如表3所示,发现1号菌株的酯类物质含量最高,其发酵液酱香、酯香等香气明显。因此确定1号菌株为目的菌株,对其进行保藏,命名为JNBZR01。

表3 酵母菌株1号、5号、7号发酵液风味物质组成 单位:mg/L
将菌株JNBZR01测序结果在NCBI中使用BLAST进行同源性比较,与ZygosaccharomycesRouxiiAB302829.1 同源性最高,为98.21 %,系统发育树如图3所示。筛选获得的菌株JNBZR01为鲁氏结合酵母Zygosaccharomycesrouxii,已于2018年9月28日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No 16547,保藏地址为北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所。

图3 菌株JNBZR01系统发育树Fig.3 Phylogenetic tree of JNBZR01
2.2 鲁氏酵母JNBZR01的理化性质分析
2.2.1 鲁氏酵母JNBZR01的生长曲线测定
对菌株JNBZR01进行理化性质的分析,将其置于含糖量不同的培养基中培养,测定其生长曲线。如图4所示,在3种葡萄糖浓度的培养基中,对数期生长速度并没有明显区别,在26 h左右进入稳定期。200 g/L高葡萄糖培养基中,JNBZR01稳定期的生物量约为2%葡萄糖培养基的2倍。而在400 g/L高葡萄糖培养基中,稳定期时的生物量比2%葡萄糖为碳源的培养基高,但远不如200 g/L高葡萄糖培养基中的生物量。从生长曲线上可以看出400 g/L的高浓度葡萄糖对JNBZR01的生长产生了一定的抑制作用。

图4 JNBZR01在不同质量浓度葡萄糖YPD培养基中生长曲线Fig.4 Growth curve of JNBZR01 in different cincentrationglucose YPD medium
2.2.2 鲁氏酵母JNBZR01的挥发性物质分析
鲁氏酵母为常见的传统发酵食品发酵菌株,其发酵过程能够明显增加传统发酵食品特殊的风味。酵母常常以抽提物的形式添加到酱类食品中增加食品风味和香气,其香气明显,并且可以抑制酱的不愉快气味,有增加鲜味、缓和酸味、淡盐、降低苦涩味等矫味作用,赋予酱浓郁香味,提高酱醇厚味的表现力,延长酱味道的持续时间,使之更加美味可口[19]。
菌株JNBZR01菌体自身整体香气酯香浓郁,有明显的酱香。因此对该菌菌泥进行GC-MS分析,菌体挥发性物质如表4所示。其中苯乙醇含量较高,苯乙醇在苹果、杏仁、香蕉、桃子、梨子、草莓、可可、蜂蜜等天然植物中发现,因为有清甜的玫瑰样花香而常用于蜂蜜、面包、苹果、玫瑰花香型香精等中。苯乙醇是白酒、黄酒、葡萄酒、酱油、馒头、面包等传统发酵食品中重要的风味物质,具有柔和、淡雅细腻的玫瑰气味[20]。苯乙醛具有类似风信子的香气,稀释后具有水果的甜香气,天然存在于鸡肉、西红柿、面包、玫瑰油、柑橘油里,是常用的花香型香精的调和香料的合成中,其香气清香透发。3-甲基丁醛带有苹果香气。2-甲基丙醇和3-甲基-1-丁醇具有辛辣的刺激性气味,而酯类物质中乙酸甲酯的香气为令人感到愉悦的果香,乙酸乙酯为微带果香的酒香气味。这些成分是该菌株菌泥有浓郁香气的主要原因。这些物质使得该菌适合加入甜酱、酱油、味增等酱类产品和其他食品中增加产品的香气,对产品的特殊风味有所贡献。

表4 鲁氏酵母JNBZR01菌体挥发性物质分析Table 4 Analysis of Volatile Substances in the JNBZR01
2.3 菌株JNBZR01在食品中的应用
鲁氏酵母菌株JNBZR01菌泥冷冻干燥后的干酵母粉0.5 g加入100 mL食醋1、食醋2、黄豆酱1、黄豆酱2、酱油5个样品中。(-)为未添加干酵母粉,(+)为添加了酵母粉,对10个样品进行感官品评,感官品评结果的平均值作雷达图。表5为感官分析评分尺度表。图5、图6分别为JNBZR01干酵母粉添加入食醋1,食醋2感官品评雷达图和JNBZR01干酵母粉添加入黄豆酱1,黄豆酱2,酱油感官品评雷达图。

表5 感官分析评分尺度表Table 5 Sensory analysis scale scale
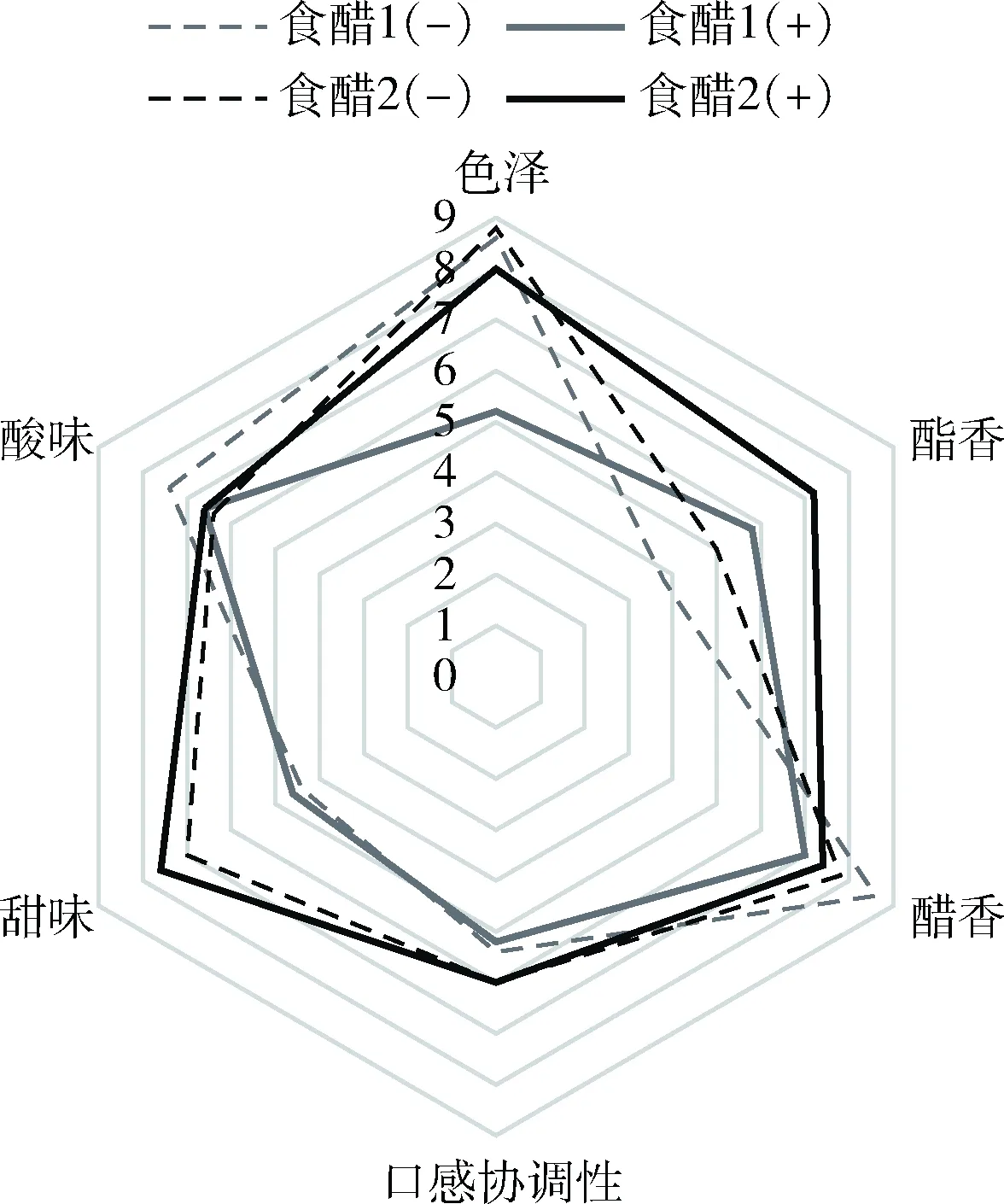
图5 添加JNBZR01干酵母粉的食醋的感官品评雷达图Fig.5 Sensory evaluation radar chart of vinegar with JNBZR01 added
由图5和图6可看出,在酱、醋类食品中添加该菌在香气和风味上都有较为明显的改变。如图5所示,在2种食醋中加入酵母粉后,酯香均明显提升,甜味及口感协调性略微增加,醋香略微减少,同时也减少了食醋的刺激性气味,使其变得更为柔和。如图6所示,在2种黄豆酱及一种酱油中加入酵母粉后,酯香味明显增加,酱香也略微提升,在风味方面,酵母粉有明显的增加鲜味的作用,口感协调性也均有提升。因此,JNBZR01可作为一种安全健康的食品提鲜剂加入发酵食品中,尤其是酱类食品,有明显的增加酯香和鲜味的作用。
在食品加工中,添加酵母抽提物为常见的增加食品鲜味的方法,不仅增加了食品的风味和香气,也因氨基酸、多肽、VB族含量增加使得食品更加营养健康[21]。酵母中的氨基酸如天冬氨酸及谷氨酸有较强的鲜味特性;丝氨酸、苏氨酸、丙氨酸有鲜味、甜味;甘氨酸呈海鲜味;肌苷酸(IMP,I)呈鸡肉鲜味;鸟苷酸(GMP,G)呈鲜菇味[22]。酵母抽提物中天然谷氨酸含量为8%左右、呈味核苷酸(I+G)含量可高达5%[23],其他成分为游离氨基酸、小分子肽,所以其有风味独特的鲜味和肉香味。产品富含多种维生素和多种矿物质等。由于酵母抽提物营养丰富,人体肠胃易于吸收,生产工艺较为简单成熟,食品加工中不仅起到有效增强产品所需的特殊风味,还能够缓和甚至除去产品本身的辛咸味和酸苦味,从而更加迎合消费者的口味及香气需求。酵母抽提物在生活中得到许多应用,如方便面、鸡精、食用香精、肉制品、酱卤制品、餐饮火锅、烘焙食品、膨化食品、酱油及养殖业等,可提升产品风味及口感[24]。

图6 添加JNBZR01干酵母粉的酱类产品的感官品评雷达图Fig.6 Sensory evaluation radar chart of soy sauce with JNBZR01 added
本研究中筛选得到的鲁氏酵母菌株JNBZR01,以干酵母粉的形式加入传统发酵食品中,如食醋,酱油,黄豆酱食品中,风味及香气有明显的提升,可作为提鲜剂,在改善食品风味的同时增加食品的营养。
3 结论
鲁氏酵母由于其耐高渗的特性在酱等传统发酵食品中发酵,并且改善发酵食品的风味而受到关注。从柿饼表面筛选酵母菌株经过菌种鉴定确定为鲁氏酵母菌株,命名该菌株为JNBZR01,保藏于中国微生物菌种保藏管理委员会普通微生物中心。JNBZR01具有高糖及高渗耐受性,对的葡萄糖、蔗糖、果糖、麦芽糖、NaCl的耐受性分别达到550、600、600、650、120 g/L。JNBZR01的发酵液及菌体自身均具有明显的香气,如玫瑰花香、风信子花香及水果的甜香气等,将菌体添加于甜酱、豆酱、酱油等酱类食品或其他食品中可明显增加酯香、酱香气味,提高食品鲜味,增强口感协调性,可作为食品提鲜剂。因此筛选的到的鲁氏酵母菌株JNBZR01由于其耐高糖的特性和能够提升酱等发酵食品的鲜味的特点,在食品方面有着重要的应用前景,但能够耐受高糖的具体原因及机理还需进一步研究。

