香叶木素对脑缺血再灌注损伤大鼠的保护作用研究①
张 楠 祁晓媛 潘思培 郑晓露 郦铮铮
(温州医科大学附属第一医院神经内二科,温州 325000)
缺血性脑卒中是一类常见、高发病率、高致残率的脑血管病,目前已经严重威胁人类健康[1]。而脑缺血再灌注损伤(Cerebral ischemia reperfusion injury,CI/R)是由于在脑缺血一段时间后恢复血液灌流而出现炎症损伤加剧的一种现象[2],其机制是恢复血液灌流后脑内会引发强烈的免疫应答反应,包括炎症反应、氧化应激、钙超载等,是脑血管损伤的主要原因,因而对其进行有效防治和治疗有很重要的意义[3]。目前已在许多植物中发现对脑缺血再灌注损伤有保护作用的物质,如川芎油[4]、拳参提取物PBNA-413[5]、荞麦黄酮[6]、黄芩苷和栀子苷[7]等。香叶木素(3′,5,7-三羟基-4′-甲氧基黄酮,C16H12O6,Diosmetin)是一种天然黄酮类化合物,主要以游离型或糖苷型存在于菊花、柑橘属类果实、橄榄树叶等天然药物中,具有抗炎、抗肿瘤、杀菌、抗氧化等多种药理效果[8-13]。而且由于香叶木素在日常饮食中容易获取,因而具有很好的药用价值和开发潜力。然而关于香叶木素对于缺血再灌注损伤是否有保护作用,目前少有报道。因此本文采用线栓法制备CI/R损伤大鼠模型,通过观察不同剂量香叶木素对该模型大鼠行为和脑梗死体积的影响以及脑组织损伤情况,检测不同处理后脑缺血再灌注损伤大鼠脑组织中凋亡相关蛋白、超氧化物歧化酶(SOD)、丙二醛(MDA)、炎症因子以及CysLTs含量的变化,最终验证香叶木素对缺血再灌注损伤大鼠是否有保护作用,以期为缺血再灌注损伤找到更好的治疗预防药物。
1 材料与方法
1.1材料
1.1.1动物 青壮年雄性SD大鼠(体质量250~300 g,7~8周龄)72只,四川大学实验动物中心,合格证号:046。
1.1.2药物与试剂 香叶木素(HPLC≥98%)(Solarbio);尼莫地平(阳性对照,拜耳);苏木素染液、伊红染液(南京凯基);酶联免疫吸附实验试剂盒(ELISA,武汉默沙克生物科技有限公司);10% 水合氯醛(山东华鲁制药有限公司);SOD和MDA检测试剂盒(南京建成生物工程研究所);半胱天冬酶3(Caspase 3)、活化型半胱天冬酶3(Cleaved caspase 3)、Caspase 9、Cleaved caspase 9、GAPDH一抗(美国CST公司);二抗(美国LICOR公司);ECL化学发光试剂盒(美国Millipore公司);蛋白提取试剂盒(上海碧云天生物技术有限公司);TUNEL试剂盒(美国罗氏公司)。
1.1.3仪器 UV1000 紫外可见分光光度计(上海天美科学仪器有限公司);显微镜(德国卡尔蔡司股份公司)。
1.2方法
1.2.1CI/R损伤大鼠模型的制备 采用MCAO线栓法参照文献[14]构建CI/R大鼠模型,具体步骤如下:将大鼠用10%水合氯醛麻醉后,仰卧固定在操作台上。于颈部正中切开,分离右侧股静脉、左右两侧颈总动脉、椎动脉和右侧颈外动脉并结扎,缺血2 h后拔线。大鼠清醒后采用Longa评分标准来检测是否造模成功,1~3分视为成功[14,15]。
1.2.2分组 将72只大鼠随机分为6组,每组各12只:假手术组、CI/R组、尼莫地平组[6 mg/(kg·h)]、香叶木素(0.25 mg/kg)、香叶木素(0.5 mg/kg)、香叶木素(1 mg/kg)。假手术组同样分离出相应血管,但不进行结扎;香叶木素各浓度组在CI/R制作前 6 h 进行香叶木素腹腔注射预处理,再灌注24 h后检测各项指标。假手术组和CI/R组给予同体积的生理盐水。
1.2.3大鼠神经功能缺陷评分 缺血2 h再灌注24 h对各组大鼠分别采用Longa评分法进行神经功能缺陷评分。分数越高,损害程度越高。
1.2.4脑梗死体积测定 各组分别取6只大鼠于再灌注24 h后用10%水合氯醛(0.35 ml/100 g)麻醉后断头取脑,将前脑由额极向枕极切成厚度相同的冠状切片,放入2%TTC溶液中,37℃避光染色30 min,非缺血组织染色后呈红色,梗死组织呈现白色。用Image J软件计算脑梗死体积百分比。
1.2.5HE染色检测病理学损伤 从剩余的各组大鼠中分别取部分脑组织固定于10%的福尔马林溶液中,24 h后进行常规脱水、包埋、切片成4 μm。经苏木精-伊红染色后于显微镜下观察,细胞核被染成紫蓝色,细胞质和细胞外基质中的成分呈红色。
1.2.6生化指标测定 各组分别取6只大鼠,取出脑组织后于冰上加入生理盐水制成10%脑匀浆,5 000 r/min 冷冻离心10 min,取上清液。用分光光度法检测SOD、MDA的活性,ELISA法检测白细胞介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)、半胱氨酰白三烯(CysLTs),方法参照其试剂盒说明书。
1.2.7TUNEL检测细胞凋亡情况 从剩余的各组大鼠中分别取部分脑组织石蜡切片,按TUNEL试剂盒操作,最后在显微镜下观察TUNEL阳性染色情况。
1.2.8Western blot检测组织中Cleaved caspase 3和Cleaved caspase 9的表达情况 从剩余的各组大鼠中分别取部分脑组织制成脑匀浆后,收集细胞,提取总蛋白于10%SDS-PAGE电泳分离蛋白,待蛋白分离后转至PVDF膜,在封闭液中封闭60 min后孵育一抗,用GAPDH作为内标蛋白,放置于4℃过夜。漂洗后添加二抗,于室温下孵育1 h,在ECL化学发光液中显色曝光,用Image J处理图像并计算蛋白相对表达量。
2 结果
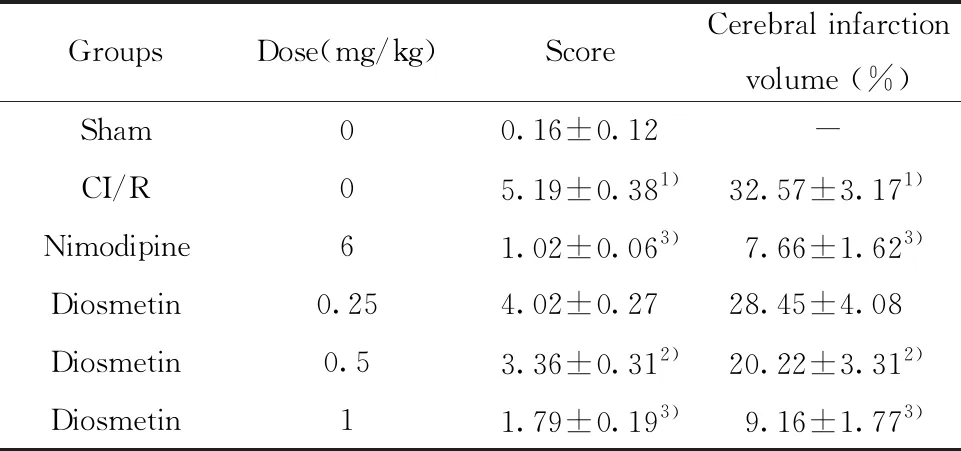
2.1香叶木素对缺血再灌注损伤大鼠神经功能缺陷评分和脑梗死体积的影响 如表1所示,从大鼠神经功能缺陷评分结果来看,假手术组评分最低,损害最小。CI/R组评分最高,受到的损害最大。尼莫地平组(阳性对照)的评分仅低于假手术组,损害得到显著修复。与CI/R组相比,随着香叶木素剂量的升高,其神经功能缺陷评分逐渐降低。与此同时,假手术组脑梗死体积为0,CI/R组最大,随着香叶木素剂量的升高,其脑梗死体积逐渐减少,表明香叶木素与尼莫地平有相似的作用和功效,它们对脑缺血再灌注损伤大鼠都有保护作用,而且具有剂量依赖性。
2.2香叶木素对缺血再灌注损伤大鼠脑组织损伤的影响 如图1所示,用HE染色检测不同处理下大鼠脑组织损伤情况,发现相对于假手术组,CI/R组大鼠脑组织被染色后呈蓝色的炎症细胞数量明显增多,损伤加重。而相对于CI/R组,用阳性对照尼莫地平和不同剂量的香叶木素处理后的缺血再灌注损伤大鼠脑组织内炎症细胞数量都相对减少,其中尼莫地平组的效果最为明显,香叶木素处理组随着香叶木素剂量的增加,炎症细胞数量逐渐减少,损伤减轻。因此说明香叶木素可减轻缺血再灌注损伤大鼠的组织损伤。
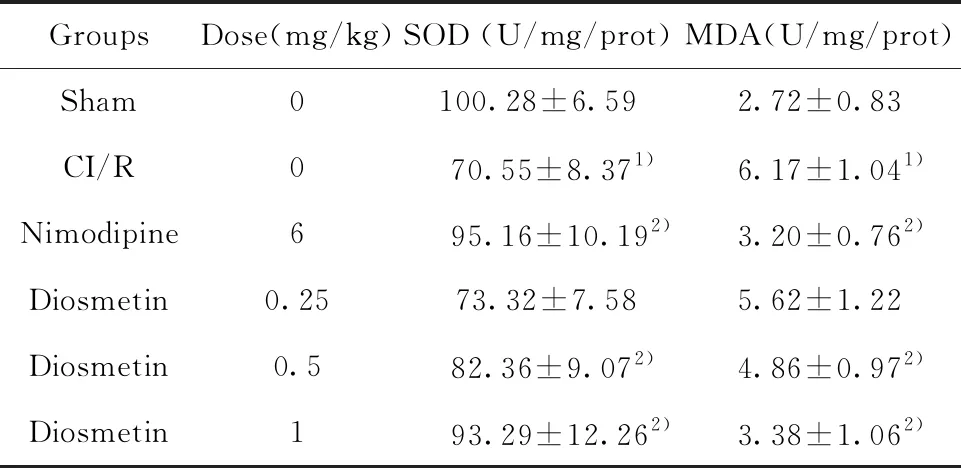
2.3香叶木素对缺血再灌注损伤大鼠脑组织中SOD和MDA活性的影响 如表2所示,与假手术组相比,CI/R组大鼠脑组织中SOD活性明显降低,MDA活性显著升高。与CI/R组相比,香叶木素低、中、高剂量组以及尼莫地平组大鼠脑组织中SOD活性逐渐升高,MDA活性逐渐降低,0.5 mg/kg和1 mg/kg香叶木素组都具有显著差异性。1 mg/kg香叶木素组SOD和MDA活性几乎达到尼莫地平组的水平。表明香叶木素可增加缺血再灌注损伤大鼠脑组织中SOD活性,降低MDA活性。
表1 香叶木素对缺血再灌注损伤大鼠神经功能缺陷评分
Tab.1 Effect of diosmetin on neurological deficits score of CI/R rats
GroupsDose(mg/kg)ScoreCerebral infarctionvolume (%)Sham00.16±0.12-CI/R05.19±0.381)32.57±3.171)Nimodipine61.02±0.063)7.66±1.623)Diosmetin0.254.02±0.2728.45±4.08Diosmetin0.53.36±0.312)20.22±3.312)Diosmetin11.79±0.193)9.16±1.773)
Note:n=6,1)P<0.01,2)P<0.05 versus Sham group;3)P<0.05 versus CI/R group.
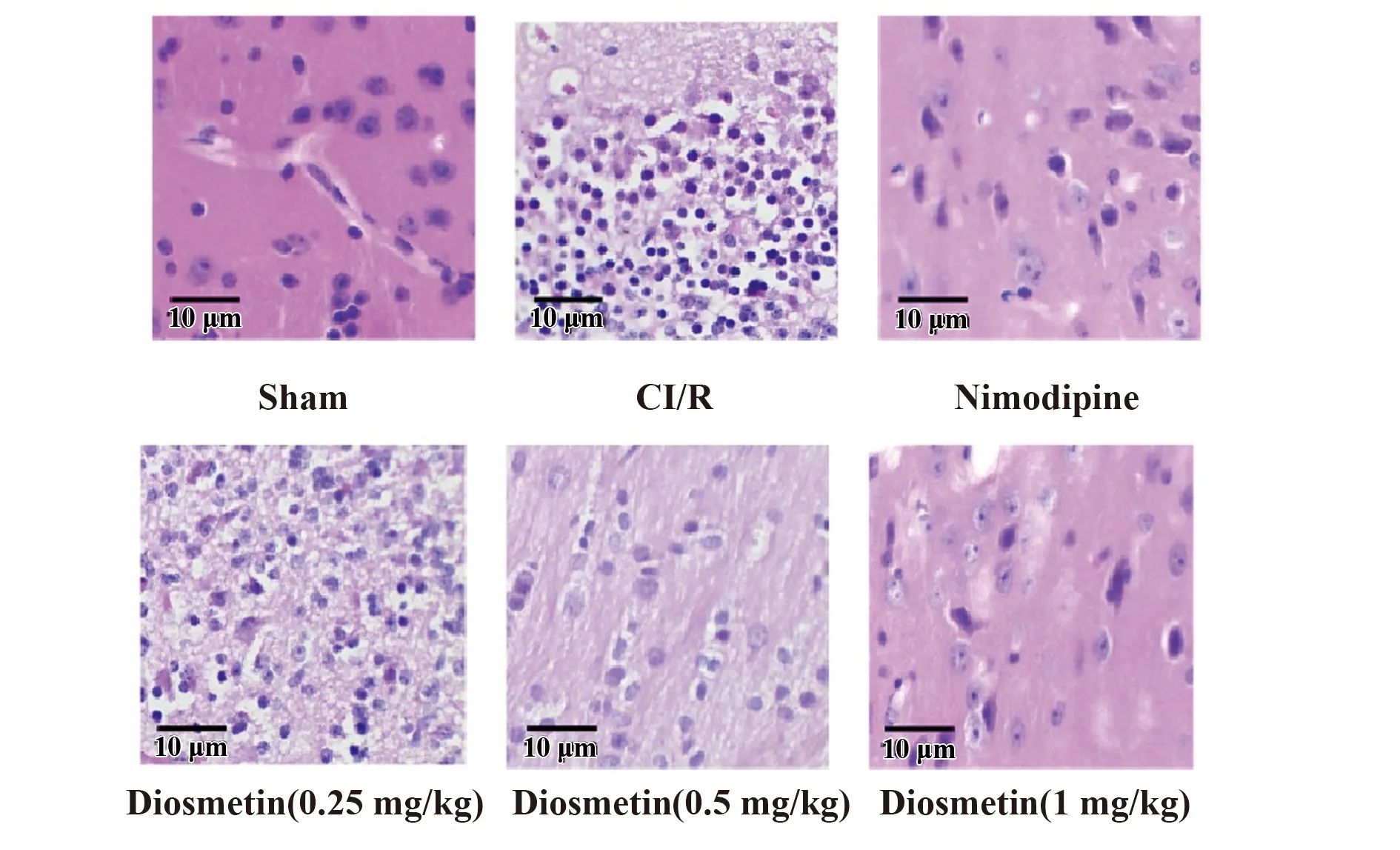
图1 香叶木素对缺血再灌注损伤大鼠脑组织损伤的影响Fig.1 Effect of diosmetin on brain tissue damage in CI/R rats
2.4香叶木素对缺血再灌注损伤大鼠脑组织细胞凋亡的影响 使用TUNEL检测不同处理下大鼠脑组织细胞的凋亡情况,发现相比于假手术组,CI/R组大鼠脑组织凋亡细胞数量明显增多。而相对于CI/R组,阳性对照组(尼莫地平组)缺血再灌注损伤大鼠脑组织凋亡细胞显著减少,随着香叶木素浓度的升高,其处理后的大鼠脑组织中凋亡细胞也呈逐渐减少的趋势(图2)。
之后,对各处理组大鼠脑组织内凋亡相关蛋白(Cleaved caspase 3和Cleaved caspase 9)的表达水平进行检测,发现相对于假手术组,CI/R组大鼠脑组织中Cleaved caspase 3和Cleaved caspase 9的表达量都显著升高,细胞凋亡程度较高。相对于CI/R组,尼莫地平组的大鼠脑组织中Cleaved caspase 3和Cleaved caspase 9的表达量显著降低。用不同剂量的香叶木素处理后,缺血再灌注损伤大鼠脑组织内的这两种凋亡相关蛋白表达量都有不同程度的降低,香叶木素(1 mg/kg)组的差异均达到极显著水平(P<0.01)(图3)。综上说明香叶木素可有效抑制缺血再灌注损伤大鼠脑组织细胞发生凋亡。
表2 香叶木素对缺血再灌注损伤大鼠脑组织中SOD和MDA活性的影响
Tab.2 Effect of diosmetin on activity of SOD and MDA in brain tissue of CI/R rats
GroupsDose(mg/kg)SOD (U/mg/prot)MDA(U/mg/prot)Sham0100.28±6.592.72±0.83CI/R0 70.55±8.371)6.17±1.041)Nimodipine6 95.16±10.192)3.20±0.762)Diosmetin0.2573.32±7.585.62±1.22Diosmetin0.5 82.36±9.072)4.86±0.972)Diosmetin1 93.29±12.262)3.38±1.062)
Note:n=6,1)P<0.01 versus Sham group;2)P<0.05 versus CI/R group.
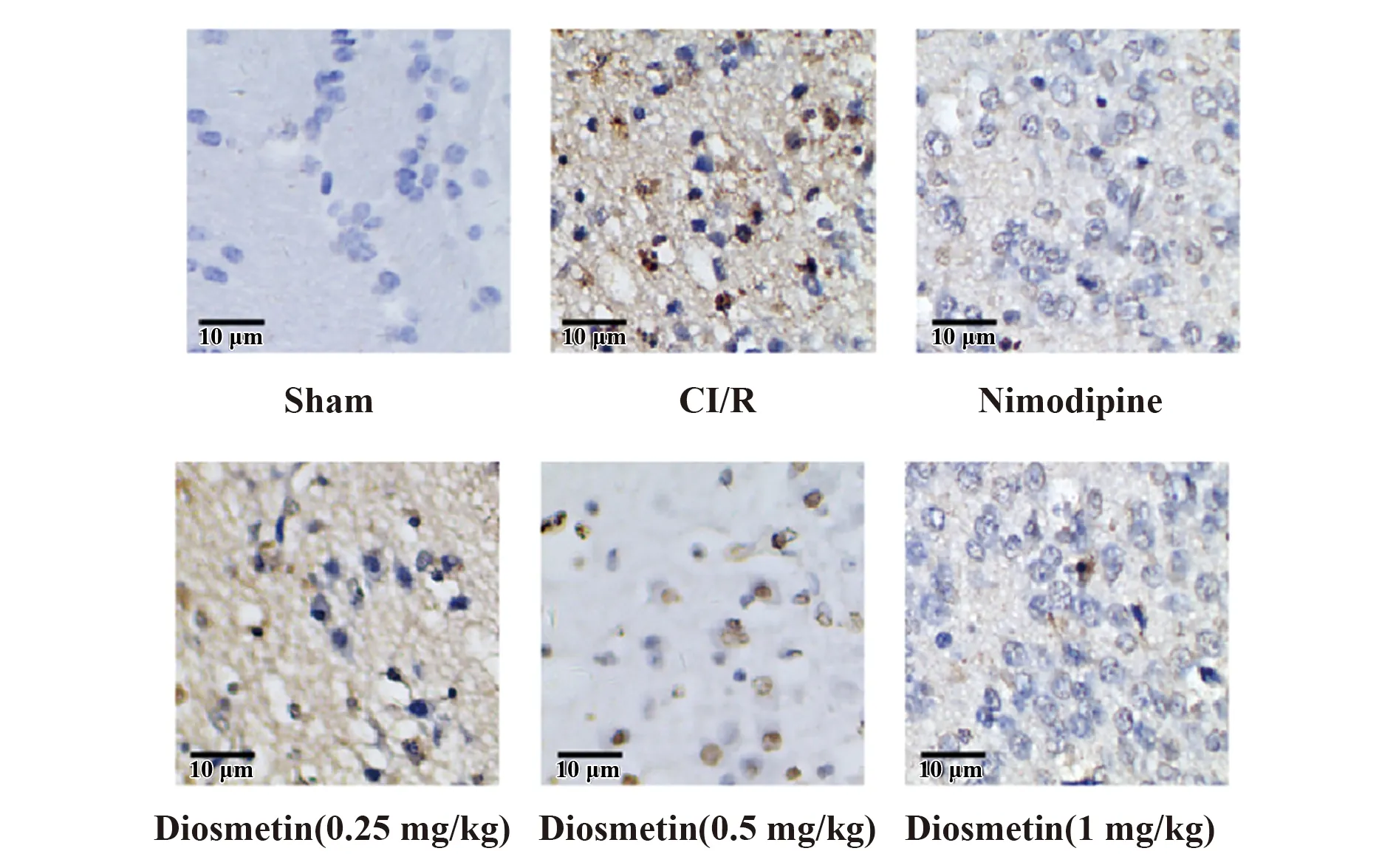
图2 TUNEL检测香叶木素对缺血再灌注损伤大鼠脑组织细胞凋亡的影响Fig.2 Effect of diosmetin on cell apoptosis of brain tissue in CI/R rats
表3 香叶木素对缺血再灌注损伤大鼠脑组织中炎症因子和CysLTs含量的影响
Tab.3 Effect of diosmetin on inflammatory factor and CysLTs levels in brain tissue of CI/R rats

GroupsDose(mg/kg)IL-1β(pg/ml)TNF-α(ng/ml)CysLTs(ng/mg)Sham0120.55±11.371.35±0.663 269±437CI/R0216.42±15.081)2.07±0.371)7 015±3892)Nimodipine6130.47±17.331.39±0.523 946±510Diosmetin0.25196.58±21.431.92±0.476 537±592Diosmetin0.5172.36±16.713)1.71±0.823)5 201±6134)Diosmetin1138.25±13.853)1.42±0.553)4 152±5774)
Note:n=6,1)P<0.05,2)P<0.01 versus Sham group;3)P<0.05,4)P<0.01 versus CI/R group.
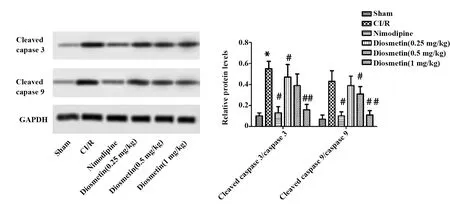
图3 Western blot检测香叶木素对缺血再灌注损伤大鼠脑组织内凋亡相关蛋白表达水平的影响Fig.3 Western blot for detecting effect of diosmetin on apoptotic related protein expressions in brain tissue of CI/R ratsNote:n=6,*.P<0.05 versus Sham group;#.P<0.05,##.P<0.01 versus CI/R group.
2.5香叶木素对缺血再灌注损伤大鼠脑组织中炎症因子和CysLTs含量的影响 如表3所示,与假手术组相比,CI/R组大鼠脑组织中炎症因子IL-1β和TNF-α含量明显升高,CysLTs的含量也显著升高。相对于CI/R组,香叶木素低、中、高剂量组以及尼莫地平组大鼠脑组织中IL-1β、TNF-α以及CysLTs的含量都表现为明显下调,中、高剂量香叶木素组下调更为显著。表明香叶木素可有效降低缺血再灌注损伤大鼠脑组织中炎症因子和CysLTs的含量。
3 讨论
脑缺血再灌注损伤(CI/R)因其危害严重、高发病率、发病机制复杂以及目前尚无特效药物的治疗而广受关注。近几年来,药物预处理是防治脑缺血再灌注损伤的一个新的研究方向,期望能通过药物来阻断神经元组织损伤的病理过程,从而对其产生保护作用[16]。脑缺血再灌注损伤的病理机制中一个重要的原因就是损伤后会引发脑细胞内产生大量氧自由基或清除能力降低以及炎症的级联反应[17]。SOD的活性可直接反映机体内氧自由基的多少。自由基攻击不饱和脂肪酸发生过氧化反应会产生大量的脂质过氧化物,MDA就是产物之一,它的多少可反映机体自由基的水平以及细胞受到损伤的程度[4]。IL-1β、TNF-α、CysLTs在炎症反应中扮演着重要的角色,尤其是脑缺血再灌注损伤的炎症反应。炎症反应加重时它们的表达量会升高,并聚集在缺血组织附近,黏附白细胞和内皮细胞,影响血液供应,使血浆在管壁聚集,管壁厚度增加,通道变窄,从而导致脑梗死[5-7,18]。已有研究表明当归多糖可通过降低大鼠脑组织氧化应激水平及炎症因子表达,减轻脑缺血再灌注损伤,因此其他具有抗氧化及炎症能力的药物可能具有同样的作用[19]。香叶木素具有很好的药用价值,它对小鼠缺血再灌注诱导的急性肾损伤具有保护作用[20],它能通过减少DNA损伤和氧化应激反应以保护视网膜受到损伤[21]。表明香叶木素具有抗氧化应激和抗炎症的作用,很可能在脑缺血再灌注损伤中通过这一作用机制保护脑组织。那么在本研究中我们主要关注的是香叶木素处理后脑缺血再灌注损伤大鼠行为、脑梗死体积、脑组织损伤程度、脑组织中凋亡相关蛋白、SOD、MDA、IL-1β、TNF-α以及CysLTs含量的变化,进而来评价香叶木素对缺血再灌注损伤大鼠的保护作用。
从实验结果来看,相对于CI/R组,香叶木素处理后的脑缺血再灌注损伤大鼠的神经功能缺陷评分和脑梗死体积降低、脑组织损伤得以减轻、SOD活性升高、MDA活性降低、凋亡细胞数量减少、促凋亡相关蛋白(Cleaved caspase 3和Cleaved caspase 9)表达量降低,炎症因子IL-1β、TNF-α以及CysLTs含量降低。表明香叶木素能减少脑缺血再灌注损伤大鼠脑梗死的发生,能减弱大鼠脑组织受到的损伤,能提升其脑组织清除氧自由基的能力以减少脑组织内氧自由基的产生,能减少其脑组织内自由基与质膜不饱和脂肪酸发生的过氧化反应,能抑制脑组织细胞发生凋亡,能降低脑组织内炎症因子的含量,从而说明香叶木素对缺血再灌注损伤大鼠具有很好的保护作用,可能的机制是抗氧化、抑制凋亡和抗炎症,这有可能是脑缺血再灌注损伤病理机制研究中的一个新发现。目前已经报道了一些中草药物质对于脑缺血再灌注损伤具有保护作用。如川芎油能降低缺血再灌注损伤大鼠的神经功能评分,减少脑梗死体积,降低鼠脑组织中MDA含量[4]。荞麦黄酮能降低脑组织内IL-1β、TNF-α水平[6];黄芩苷和栀子苷配伍可降低脑组织中CysLTs含量[7],与本研究结果是一致的。那么香叶木素也是一种防治缺血再灌注损伤的有效药物。
另外有研究称,对脑缺血再灌注损伤的保护作用可能是通过调控线粒体能量代谢和MAPK/ERK信号通路进而抑制脑细胞凋亡[22]。那么香叶木素是通过什么样的机制来对脑缺血再灌注损伤产生保护作用的呢,还有待进一步的研究与探索。