葡萄溃疡病菌外泌蛋白LtGH61A的致病力及基因表达模式
彭军波,李兴红,张玮,周莹,黄金宝,燕继晔
葡萄溃疡病菌外泌蛋白LtGH61A的致病力及基因表达模式
彭军波,李兴红,张玮,周莹,黄金宝,燕继晔
(北京市农林科学院植物保护环境保护研究所/北方果树病虫害绿色防控北京市重点实验室,北京 100097)
【目的】由葡萄座腔菌属()真菌引起的溃疡病是葡萄生产上的重要病害之一,在国内多个葡萄产区发生,严重威胁葡萄的产量及品质。本研究对葡萄溃疡病菌()中一个假定外泌蛋白LtGH61A进行功能分析,为进一步解析葡萄溃疡病菌的致病机理及病害防控提供理论依据。【方法】通过SignalP 4.0预测LtGH61A蛋白的信号肽;氨基酸序列同源比对结合基因功能注释,预测LtGH61A蛋白的功能;通过酵母互补试验分析LtGH61A蛋白的外泌特性;采用实时荧光定量PCR(qRT-PCR)分析在病原菌营养菌丝及侵染寄主不同阶段的表达量;借助RNA干涉(RNAi)对进行表达抑制;通过葡萄枝干离体接种试验,分析LtGH61A蛋白对葡萄溃疡病菌致病力的影响。通过比较菌落直径,分析LtGH61A蛋白对葡萄溃疡病菌菌丝生长速率的影响。【结果】信号肽预测表明LtGH61A蛋白N端具有一个长度为18个氨基酸的信号肽;基因功能注释推定的编码产物属于糖苷水解酶61(GH61)家族,能酶解纤维素类物质;互补蔗糖酶外泌缺陷型酵母YTK12结果表明,LtGH61A蛋白的信号肽具有外泌活性,能够引导酵母YTK12蔗糖酶的外泌;与营养菌丝阶段相比,的表达量在病原菌侵染阶段显著升高,并且在接种后48 h高达营养菌丝阶段的19倍;通过RNAi试验及qRT-PCR验证,获得了2个表达量明显降低的阳性转化子,分别命名为RNAi-LtGH61A1和RNAi-LtGH61A2;葡萄枝干离体接种试验结果显示,与野生型CSS-01s相比,RNAi-LtGH61A1和RNAi-LtGH61A2转化子在葡萄枝干形成的病斑长度显著变短,约为野生型CSS-01s的55%,表明LtGH61A影响葡萄溃疡病菌的致病力;菌落直径比较显示,与野生型CSS-01s相比,RNAi-LtGH61A1和RNAi-LtGH61A2转化子的菌落直径变小,约为野生型85%,表明LtGH61A影响葡萄溃疡病菌的菌丝生长速率。【结论】LtGH61A影响葡萄溃疡病菌的致病力及生长速率;LtGH61A蛋白能够分泌至胞外;在病原菌侵染阶段的表达量显著升高,推测其通过发挥自身酶活功能,破坏寄主植物组织,从而促进病原菌的侵染。
葡萄溃疡病菌;外泌蛋白;致病力;表达模式;实时荧光定量PCR; RNA干涉
0 引言
【研究意义】葡萄是世界范围内四大水果之一,据联合国粮食及农业组织的统计数据显示,2017年世界葡萄总产量约7 428万吨,我国葡萄的总产量约1 316万吨,占世界葡萄总产量的18%(http://www.fao.org/ statistics/zh/)。由葡萄座腔菌属()真菌引起的葡萄溃疡病是我国乃至世界葡萄产区的重要病害之一。近年来,该病害在我国多个葡萄产区流行,并且有逐年加重的趋势,危害严重时,产量损失高达80%,甚至绝产[1-2]。世界范围内,已有超过12个国家报道了葡萄溃疡病的发生及危害,包括中国、意大利、美国、法国、西班牙及澳大利亚等葡萄产量大国[2]。目前生产上针对该病害并无高效的防控措施,主要采用改善环境条件、葡萄种植管理及杀菌剂相结合的综合防控措施[2]。因此,探究葡萄溃疡病菌致病关键因子的作用机理,对于全面解析葡萄溃疡病的发生机理,促进我国葡萄产业的发展,建立都市型现代农业具有重要意义。【前人研究进展】据统计,世界范围内已报道的造成葡萄溃疡病的病原菌多达20种[3],其中在国内已鉴定到的葡萄溃疡病菌有6种,包括可可毛色二孢()[4]、色二孢属真菌[5]、葡萄座腔菌()[2]、小新壳梭孢()[3]、[6]和[7],其中可可毛色二孢是致病力最强的优势种。由可可毛色二孢引起的葡萄溃疡病于1972年首次在埃及报道[8],在国内由笔者研究室的科研人员首次报道[4]。关于葡萄溃疡病的研究主要集中在病原菌的分离鉴定、生物学特性及症状描述[2-15],杀菌剂防治效果、抗性风险评估及作用机理的解析[16-17]、生防菌的作用机制[18]、组学分析[19-21]、病菌外泌毒素的鉴定及致病力分析[22-25]等方面,有关致病基因作用机理的报道较少。糖苷水解酶是一类在真菌中被广泛研究报道的化合物,这些酶类在工业生物能源的再生、自然界多糖类物质的代谢及病原菌的侵染致病中发挥了不同的作用[26-27]。目前,碳水化合物活性酶(CAZy)数据库(http://www.cazy.org)含有超330个家族,近340 000个碳水化合物活性酶的序列信息[28],这些水解酶能以纤维素、木质素或几丁质等不同碳水化合物为底物,发挥活性功能。如嗜热子囊菌()产生的糖苷水解酶61(GH61)家族蛋白TaGH61A能够以微晶纤维素为底物,发挥酶解活性[27];里氏木霉()能够产生2种纤维素水解酶(Cel6A和Cel7A)及至少5种内切葡聚糖酶(Cel5A、Cel7B、Cel12A、Cel45A和Cel61A),并且这些酶可以相互协同作用,水解纤维素[29-30];白曲霉()编码的GH61家族的内切葡聚糖酶AkCel61及截断体rAkCel61ΔCBM对海带多糖及可溶性羧甲基纤维素具有一定的水解能力,但对微晶纤维素、阿拉伯木聚糖和果胶等多糖没有水解能力[31]。水稻白叶枯病菌(Xanthomonasoryzaepv.oryzae)分泌的木聚糖酶XynB能够增强病原菌对水稻的致病力[32]。【本研究切入点】尽管碳水化合物活性酶的酶解活性及功能的多样性在不同真菌中被广泛报道,但是这些酶类在葡萄溃疡病菌中的作用机理并不清楚。笔者研究室在前期工作中完成了葡萄溃疡病菌3个种可可毛色二孢、葡萄座腔菌及小新壳梭孢的全基因组测序、数据拼接及基因功能注释[21]。在致病力最强的优势种可可毛色二孢预测的12 902个蛋白编码基因中,有820个基因的编码产物为碳水化合物活性酶类,其中198个是可可毛色二孢特有的,但是关于这些碳水化合物活性酶的功能未见报道。以可可毛色二孢中一个碳水化合物活性酶为研究对象,氨基酸序列同源性及系统进化树分析表明该蛋白酶属于糖苷水解酶61(GH61)家族,命名为LtGH61A,但是关于该蛋白的外泌特性、生物学功能及其在病原菌侵染寄主不同阶段的基因表达模式并不清晰。【拟解决的关键问题】采用RNAi及病原菌接种研究LtGH61A对可可毛色二孢致病力的影响;通过酵母互补试验分析LtGH61A蛋白的信号肽活性;通过实时荧光定量PCR(qRT-PCR)比较在营养菌丝及病原菌侵染各阶段的表达量差异。明确LtGH61A蛋白的外泌特性及其在可可毛色二孢致病中的作用,为后续深入解析LtGH61A蛋白的作用机理打下基础。
1 材料与方法
试验于2018年11月至2019年6月在北京市农林科学院植物保护环境保护研究所进行。
1.1 材料
供试菌株及植物:可可毛色二孢野生型(WT)菌株CSS-01s由笔者实验室保存,酵母菌株YTK12由中国农业大学孙文献老师馈赠,大肠杆菌感受态细胞Trans1-T1购自北京全式金生物技术有限公司。病原菌接种试验所用葡萄品种为‘夏黑’,顺义香逸葡萄园。真菌转化子置于灭菌的1.5 mL Eppendorf管中,保存于4℃冰箱,质粒载体保存于-20℃冰箱。
供试药剂及仪器:各种限制性内切酶及T4 DNA连接酶,New England Biolabs公司;高保真聚合酶,北京擎科新业生物技术有限公司;氨苄青霉素、硫酸腺嘌呤,北京索莱宝科技有限公司;葡萄糖,国药集团化学试剂有限公司;抗霉素A,Abcam公司,英国;聚乙二醇3350及棉子糖,Sigma-aldrich公司,美国;Trizon试剂,Invitrogen,美国;植物RNA快速提取试剂盒,北京艾德莱生物科技有限公司;反转录试剂盒,北京全式金生物技术有限公司;2×RealStar Green Fast Mixture with ROX II,北京康润诚业生物科技有限公司;酵母提取物、蛋白胨、不含氨基酸的酵母氮源、琼脂,Becton, Dickinson and Company,美国;YeastmakerTMYeast Transformation System 2试剂盒、tryptophan dropout supplement,Clonthch,日本;Applied Biosystems 7500仪器,ABI公司,美国;冷冻高速离心机,HiKOKI,日本。
培养基:60% PEG3350(120 g聚乙二醇3350溶解于ddH2O,定容至120 mL);YPDA培养基(1%酵母提取物、2%蛋白胨、2%葡萄糖、0.003%硫酸腺嘌呤,固体培养基按比例加2%琼脂);CMD-W(0.67%不含氨基酸的酵母氮源、0.075% tryptophan dropout supplement、2%蔗糖、0.1%葡萄糖和2%琼脂);YPRAA培养基(1%酵母提取物、2%蛋白胨、2%棉子糖、2 μg·mL-1抗霉素A、2%琼脂)。
1.2 方法
1.2.1 葡萄枝干的离体接种 选取一年生葡萄感病品种‘夏黑’,在葡萄茎秆上用直径4 mm的打孔器划取大小一致的伤口,然后在生长2 d的可可毛色二孢菌落边缘,用直径4 mm的打孔器打取直径一致的菌饼,并将其接种至葡萄伤口处,25℃、光照和黑暗各12 h交替保湿培养。3 d后观察发病情况,测量统计病斑长度。
1.2.2 葡萄枝干RNA的提取及cDNA的反转录 通过离体接种的方法,将可可毛色二孢菌块接种至葡萄枝干伤口处,然后分别在接种病菌后24、48、72 h,截取葡萄枝干的发病部位,-80℃液氮速冻。采用植物RNA快速提取试剂盒提取RNA,然后反转录为cDNA。获得的cDNA模板用于后续的基因克隆及表达量分析。
1.2.3 可可毛色二孢原生质体的制备 将可可毛色二孢CSS-01s接种至CM固体平板上,生长约24 h;将菌丝转移至液体CM培养基中,28℃、160 r/min摇培24 h;将摇培好的菌丝置于50 mL离心管中,4 000 r/min离心5 min,收集沉淀的菌丝;称量菌丝的质量,按照每克菌丝加入2 mL 2%的蜗牛酶及2%崩溃酶的比例,加入适量的裂解酶,28℃、160 r/min酶解4 h;然后用内置4层滤纸的漏斗过滤酶解完的菌丝,并用0.7 mol·L-1的氯化钠洗脱,4℃、4 000 r/min离心15 min,收集原生质体;收集原生质体沉淀,用5 mL STC溶液悬浮洗涤,4℃、4 000 r/min离心15 min;加入适量的STC溶液,悬浮原生质体,并将其终浓度调整为约1×107个/mL,制备的原生质体用于转化试验。
1.2.4 可可毛色二孢原生质体的转化 将准备好的可可毛色二孢原生质体及RNAi质粒混匀于50 mL离心管中,放置在冰上,10 min;往混合物中滴加2 mL PEG3350溶液,至于冰上15 min;然后加入30 mL STC溶液,上下颠倒混匀,4℃、4 000 r/min离心15 min;离心得到的原生质体沉淀采用LR培养基悬浮,置于28℃培养箱培养;培养约12 h后,转入培养皿,每皿加入约12 mL 固体LR培养基混匀,待其凝固后,上面铺一层10 mL的水琼脂培养基(含1 100 μg·mL-1新霉素);28℃培养2 d左右,将出现的初始转化体转至CM培养基(含1 100 μg·mL-1新霉素)上,连续筛选3次,然后将对新霉素抗性稳定的转化子置于1.5 mL Eppendorf管中,4℃保存。
1.2.5RNAi转化子的验证及其在病原菌侵染不同阶段表达量的检测 根据可可毛色二孢和内参基因的cDNA序列,设计qRT-PCR的引物(表1)。20 μL PCR反应体系:1 μL cDNA、0.4 μL终浓度为0.2 μmol·L-1基因特异性引物、10 μL 2×RealStar Green Fast Mixture(with ROX II),补水至总体系为20 μL。PCR反应程序采用两步法:预变性95℃ 2 min;变性95℃ 15 s,退火延伸60℃ 30 s,40个循环。得到的CT值取平均值,根据2-ΔΔCT值计算不同侵染阶段基因的相对表达量。
1.2.6融合载体的构建及酵母转化 YTK12是一个蔗糖酶外泌缺陷型酵母,该酵母已被广泛用于分析鉴定分泌蛋白的信号肽[33-34]。通过Signal IP 4.0预测LtGh61A蛋白N端包含一个长度为18个氨基酸的信号肽序列LtGh61ASP,将编码LtGh61ASP的核酸序列连接至缺失信号肽序列的蔗糖酶编码基因序列上游,构建融合表达载体。采用YeastmakerTMYeast Transformation System 2试剂盒,将、阳性对照载体及阴性对照载体分别转入酵母YTK12菌株中,在CMD-W培养基上生长3 d左右,筛选转化子。将在CMD-W平板上长出的转化子划线至YPRAA平板上,通过观察酵母转化子在YPRAA平板上的生长状况,检测LtGH61A蛋白的信号肽序列是否具有外泌特性。同时,将转化子划线至CMD-W及YPDA平板上,用作试验对照。
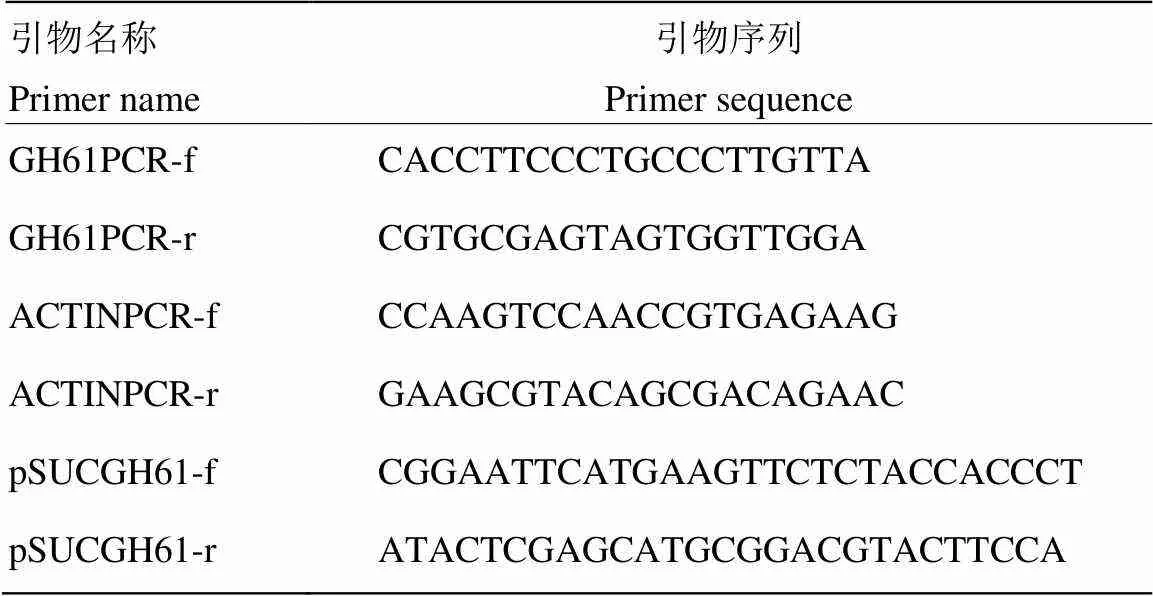
表1 本试验所用引物
1.3 数据分析
试验数据利用Excel 2013进行差异显著性分析,图片应用Excel 2013及Adobe Photoshop CS5软件制作。
2 结果
2.1 LtGH61A蛋白信号肽的鉴定
将与阳性对照载体及阴性对照载体分别转入酵母YTK12菌株后,获得的转化子在YPARR培养基上划线,3 d后的生长结果显示表达和阳性对照的酵母均能够在YPARR培养基上生长,这表明LtGH61A蛋白的信号肽和大豆疫霉()外泌蛋白Avr1b的信号肽均能够引起酵母YTK12蔗糖酶的外泌,进而分解YPRAA培养基中的棉子糖,从而获得自身生长需要的碳源。与此同时,阴性对照的表达产物不能分泌至胞外,因此不能利用YPRAA培养基中的碳源。此外,酵母转化子在YPDA及CMD-W培养基上的生长作为对照(图1)。
2.2 LtGH61A RNAi转化子的验证
将测序正确的RNAi载体转入可可毛色二孢的原生质体,长出的转化子经3轮连续的抗性筛选后,选择2株抗性遗传稳定的转化子,分别命名为RNAi-LtGh61A1和RNAi-LtGH61A2,用于检测表达量。qRT-PCR结果显示,与野生型相比,转化子RNAi-LtGH61A1和RNAi-LtGH61A2中的表达量显著降低,说明在这2株转化子中的表达得到抑制(图2)。
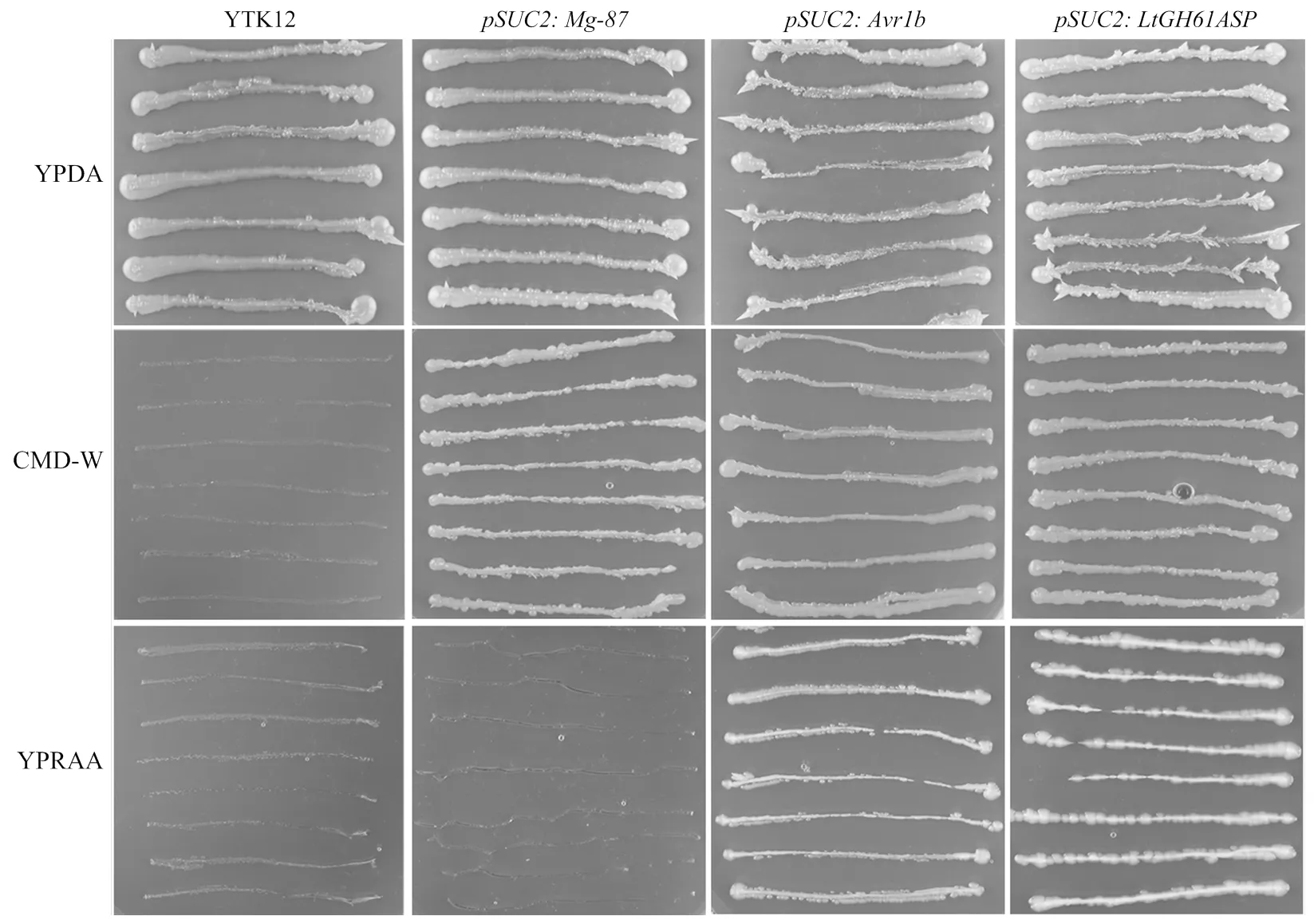
图1 不同酵母转化子在不同培养基上的生长情况
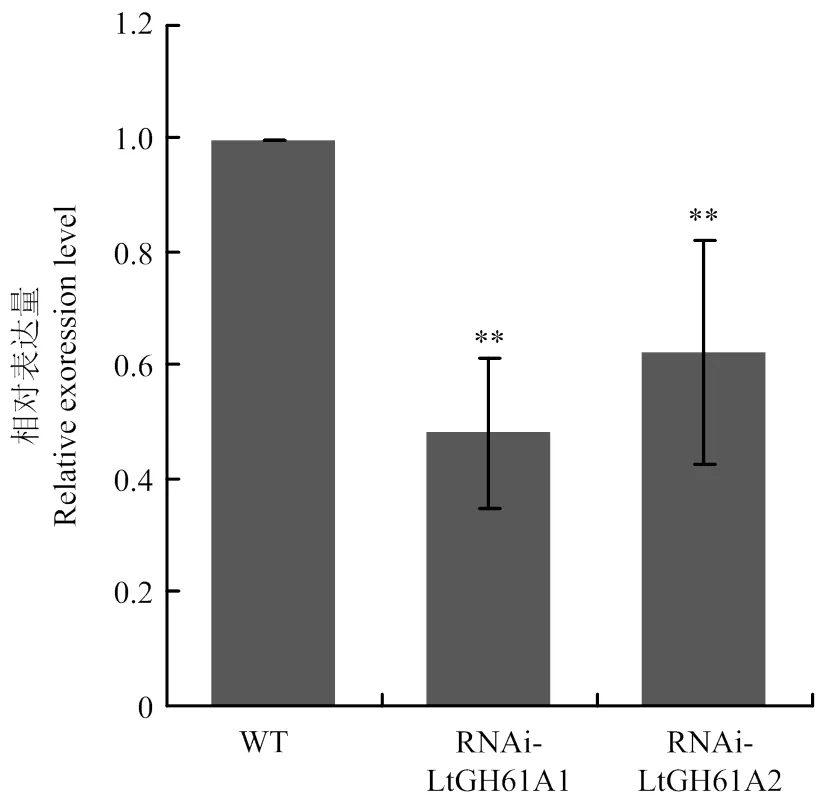
**:P<0.01
2.3 LtGH61A对可可毛色二孢生长及致病力的影响
为了观察对可可毛色二孢生长速率的影响,将直径为4 mm的野生型CSS-01s,RNAi转化子RNAi-LtGH61A1和RNAi-LtGH61A2分别点接至CM培养基平板中央,生长2 d后拍照,比较野生型和RNAi转化子菌丝生长速率的差异。测量结果表明,与野生型CSS-01s相比,RNAi转化子RNAi-LtGH61A1和RNAi-LtGH61A2的菌丝生长速率明显降低,菌落直径为野生型的85%左右(图3-A、3-B)。
为了分析对可可毛色二孢菌致病力的影响,将野生型CSS-01s,RNAi转化子RNAi-LtGH61A1和RNAi-LtGH61A2分别接种葡萄枝干,比较野生型和RNAi转化子在葡萄枝干上引起的病斑长度差异。结果表明,与野生型CSS-01s相比,RNAi转化子RNAi-LtGH61A1和RNAi-LtGH61A2侵染葡萄枝干形成病斑的长度显著变短,约为野生型的55%(图3-C、3-D),对葡萄枝干的致病力明显减弱,进一步证实影响可可毛色二孢的致病力。
2.4 LtGH61A在病原菌侵染寄主不同阶段的表达量
为了明确在病原菌营养菌丝及侵染过程中的表达模式,通过qRT-PCR检测在不同阶段的表达量。结果表明,与营养菌丝阶段相比,在病原菌侵染阶段的表达量明显升高(图4)。说明LtGH61A作为一个重要的致病因子,在病菌侵染致病阶段发挥了更加重要的作用。
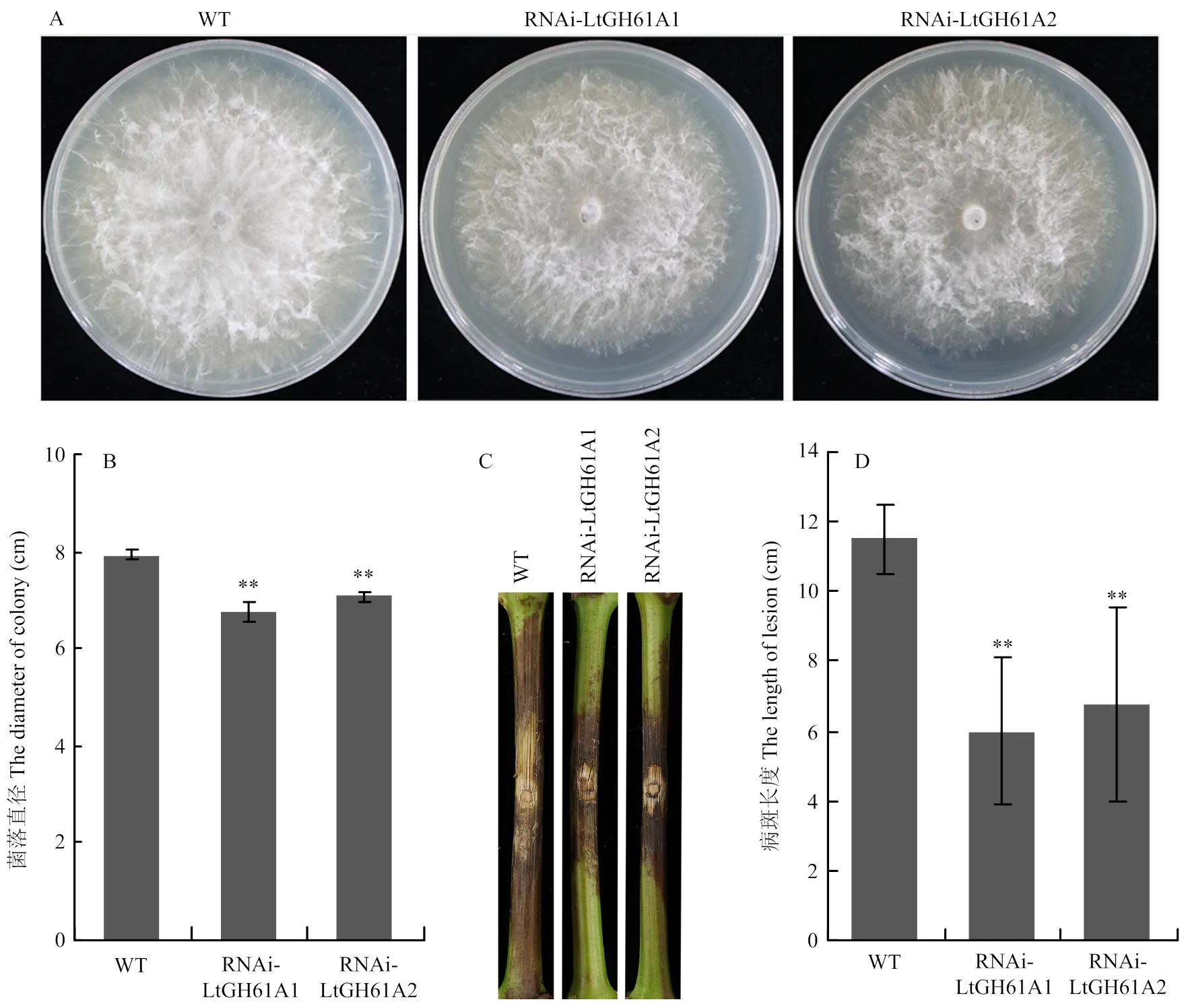
A:菌落形态The colony morphology;B:菌落直径比较 Statistical analysis of the colony diameter;C:在葡萄枝干上形成的病斑The lesion on grape shoot;D:病斑长度统计Statistical analysis of the lesion length。**:P<0.01
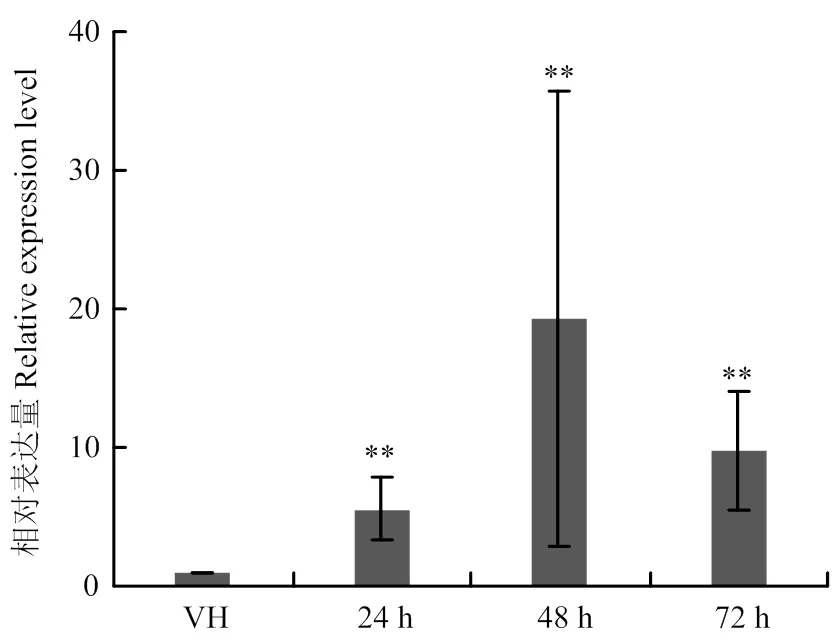
VH:营养菌丝vegetative hyphae;24—72 h:接种后24、48、72 h 24, 48 and 72 h after inoculation。**:P<0.01
3 讨论
葡萄溃疡病菌作为重要的木本植物病原真菌,近年来由于其危害的严重性及侵染寄主的广泛性,该病原菌日渐受到人们的关注,但是目前该病原菌的致病机制并不清晰。笔者研究室先后在国内率先分离鉴定了6个种的葡萄溃疡病菌,完成了其中3个种可可毛色二孢、葡萄座腔菌及小新壳梭孢的全基因组及转录组测序及数据拼接,并分析预测了优势种可可毛色二孢中近800个碳水化合物活性酶,包括糖苷水解酶GHS、糖基转移酶GTS、糖水化合物酯酶类CES、碳水化合物结合模块CBMS和辅助模块酶类AAS等,其中大量的碳水化合物活性酶编码基因在病原菌侵染阶段上调表达,但是其作用机制仍不清晰[21]。本研究以其中一个碳水化合物活性酶LtGH61A为研究对象,RNAi结合病原菌接种结果表明,的下调表达导致可可毛色二孢的致病力明显减弱,这与前期超表达该基因能增强可可毛色二孢的致病力这一结果一致[21];此外,的下调表达导致可可毛色二孢的菌丝生长速率减慢(图3-A、3-B),由此说明LtGH61A是可可毛色二孢菌无性发育及侵染致病的重要影响因子,这为后续深入解析LtGH61A作用的分子机理打下了基础。
LtGH61A蛋白包括231个氨基酸,经SignalP 4.0预测其N端包含一个长度为18个氨基酸的信号肽,酵母YTK12是一个蔗糖酶外泌缺陷型酵母,该体系已被广泛应用于稻曲病菌()[34]、葡萄霜霉菌()[35]、条锈病菌()[36]、大豆疫霉[37]等病原菌外泌蛋白信号肽的鉴定。本研究应用该酵母体系,发现LtGH61A蛋白的信号肽同样能够引导酵母蔗糖酶的外泌,导致酵母互补转化子能够在以棉子糖为碳源的培养基YPRAA上生长,这表明YTK12酵母体系同样能够应用于葡萄溃疡病菌外泌蛋白信号肽的鉴定。
与Pfam数据库比对显示,LtGH61A具有一个Glyco_hydro_61结构域,属于糖苷水解酶61(GH61)家族,能够以纤维素为底物发挥其酶活功能。关于GH61家族蛋白酶的功能在不同真菌中已有研究报道,如嗜热子囊菌产生的糖苷水解酶TaGH61A能够以微晶纤维素为底物,发挥酶解活性[27]。白曲霉编码的内切葡聚糖酶AkCel61对海带多糖及可溶性羧甲基纤维素具有一定的水解能力,但是对微晶纤维素、阿拉伯木聚糖和果胶等多糖没有水解能力[31]。这些结果表明不同真菌中产生的GH61家族的糖苷水解酶可能对纤维素类底物具有一定的水解能力,但是对具体的纤维素种类具有一定的选择性。遗憾的是,笔者在试图探究LtGH61A蛋白酶活功能时,未能纯化出LtGH61A蛋白,以分析LtGH61A蛋白酶解能力及底物。此外,木本植物组织中含有大量的纤维素类物质,结合LtGH61A推定的酶解活性及在病原菌侵染过程中显著高表达的特性,推测葡萄溃疡病菌在侵染致病过程中,LtGH61A蛋白被病原菌分泌至胞外,以寄主植物中的组织成分为酶解底物,发挥其酶活功能,以促进自身更好地侵染寄主植物。但是LtGH61A作为一个致病因子,其对可可毛色二孢侵染致病的影响与其酶解活性是否关联也需要进一步分析验证。
4 结论
葡萄溃疡病菌LtGH61A蛋白属于糖苷水解酶61家族,具有外泌特性,其N端具有一个信号肽,能够引导酵母蔗糖酶的外泌。LtGH61A是葡萄溃疡病菌一个重要的致病影响因子,在病原菌侵染阶段表达量升高,并且在侵染后48 h达到高峰。
致谢:中国农业大学孙文献老师馈赠了酵母菌株YTK12及pSUC2载体,在此表示感谢!
[1] 张玮, 李兴红, 郭飞飞, 刘梅, 黄金宝, 燕继晔. 两种葡萄溃疡病菌双重PCR检测方法的建立与应用. 植物保护学报, 2017, 44(4): 636-642.
Zhang W, Li X H, Guo F F, Liu M, Huang J B, Yan J Y. Establishment and application of duplex PCR assay for grape canker pathogensand., 2017, 44(4): 636-642. (in Chinese)
[2] Yan J Y, Xie Y, Yao S W, Wang Z Y, Li X H. Characterization of, the causal agent of grapevine canker in China., 2012, 41(4): 351-357.
[3] Yan J Y, Xie Y, Zhang W, Wang Y, Liu J K, Hyde K D, Seem R C, Zhang G Z, Wang Z Y, Yao S W, Bai X J, Dissanayake A J, Peng Y L, Li X H. Species of Botryosphaeriaceae involved in grapevine dieback in China., 2013, 61(1): 221-236.
[4] Yan J Y, Li X H, Kong F F, Wang Z Y, Gong L Z, He H P. Occurrence of grapevine trunk disease caused byin China., 2011, 95(2): 219.
[5] Yan J Y, Peng Y L, Xie Y, Li X H, Yao S W, Tang M L, Wang Z Y. First report of grapevine trunk disease caused byin China., 2011, 95(5): 616.
[6] Dissanayake A J, Zhang W, Liu M, Chukeatirote E, Yan J Y, Li X H, Hyde K D.causes pedicel and peduncle discolouration of grapes in China., 2015, 10: 21.
[7] Dissanayake A J, Zhang W, Li X H, Zhou Y, Chethana T, Chukeatirote E, Hyde K D, Yan J Y, Zhang G Z, Zhao W S. First report ofassociated with grapevine dieback in China., 2015, 54(2): 414-419.
[8] Elgoorani M A, Elmeleigi M A. Dieback of grapevine byPat. in Egypt., 1972, 11(3): 210-211.
[9] Phillips A J L.and other fungi associated with excoriose and dieback of grapevines in Portugal., 1998, 146(7): 327-332.
[10] Larignon P, Fulchic R, Cere L, Dubos B. Observation on black dead arm in French vineyards., 2001, 40(Suppl.): S336-S342.
[11] Phillips A J L. Botryosphaeria species associated with diseases of grapevines in Portugal., 2002, 41(1): 3-18.
[12] Taylor A, Hardy G E, Wood P, Burgess T. Identification and pathogenicity ofspecies associated with grapevine decline in Western Australia., 2005, 34(2): 187-195.
[13] Urbez-Torres J R. The status of Botryosphaeriaceae species infecting grapevines., 2011, 50(Suppl.): S5-S45.
[14] Van Niekerk J M, Fourie P H, Halleen F, Crous P W.Botryosphaeria spp. as grapevine trunk pathogens., 2006, 45(Suppl.): S43-S54.
[15] Úrbez-Torres J R, Leavitt G M, Guerrero J C, Guevara J, Gubler W D. Identification and pathogenicity ofand, the causal agents of bot canker disease of grapevines in Mexico., 2008, 92(4): 519-529.
[16] Fan K, Wang J, Fu L, Zhang G F, Wu H B, Feng C, Qu J L. Baseline sensitivity and control efficacy of pyraclostrobin againstisolates in China., 2019, 103(7): 1458-1463.
[17] Pan J L, Hao X, Yao H W, Ge k k, MA L, MA W. Matrine inhibits mycelia growth ofby affecting membrane permeability., 2019, 30(3): 1105-1113.
[18] Trotel-Aziz P, Abou-Mansour E, Courteaux B, Rabenoelina F, Clément C, Fontaine F, Aziz A.PTA-271 counteractsdieback in grapevine, triggering immune responses and detoxification of fungal phytotoxins., 2019, 10: 25.
[19] Cobos R, Barreiro C, Mateos R M, Coque J J R. Cytoplasmic- and extracellular-proteome analysis of: a phytopathogenic fungus involved in grapevine decline., 2010, 8: 46.
[20] Paolinelli-Alfonso M, Villalobos-Escobedo J M, Rolshausen P, Herrera-Estrella A, Galindo-Sánchez C, López-Hernández J F, Hernandez-Martinez R.Global transcriptional analysis suggestspathogenicity factors involved in modulation of grapevine defensive response., 2016, 17: 615.
[21] Yan J Y, Zhao W S, Chen Z, Xing Q K, Zhang W, Chethana K W T, Xue M F, Xu J P, Phillips A J L, Wang Y, Liu J H, Liu M, Zhou Y, Jayawardena R S, Manawasinghe I S, Huang J B, Qiao GH, Fu C Y, Guo F F, Dissanayake A J, Peng Y L, Hyde K D, Li X H. Comparative genome and transcriptome analyses reveal adaptations to opportunistic infections in woody plant degrading pathogens of Botryosphaeriaceae., 2018, 25(1): 87-102.
[22] Martos S, Andolfi A, Luque J, Mugnai L, Surico G, Evidente A. Production of phytotoxic metabolites by five species of Botryosphaeriaceae causing decline on grapevines, with special interest in the speciesand., 2008, 121(4): 451-461.
[23] Evidente A, Punzo B, Andolfi A, CIMMINO A, MELCK D, LUQUE J. Lipophilic phytotoxins produced by, a grapevine canker agent., 2010, 49(1): 74-79.
[24] Andolfi A, Mugnai L, Luque J, Surico G, Cimmino A, Evidente A. Phytotoxins produced by fungi associated with grapevine trunk diseases., 2011, 3(12): 1569-1605.
[25] Abou-Mansour E, Débieux J L, Ramírez-Suero M, Bénard-Gellon M, Magnin-Robert M, Spagnolo A, Chong J, Farine S, Bertsch C, L'Haridon F, Serrano M, Fontaine F, Rego C, Larignon P.Phytotoxic metabolites from, a pathogen ofdieback of grapevine., 2015, 115: 207-215.
[26] Vaaje-Kolstad G, Horn S J, Van Aalten D M F, Synstad B, Eijsink V G H. The non-catalytic chitin-binding protein CBP21 fromis essential for chitin degradation., 2005, 280(31): 28492-28497.
[27] Langston J A, Shaghasi T, Abbate E, Xu F, Vlasenko E, Sweeney M D. Oxidoreductive cellulose depolymerization by the enzymes cellobiose dehydrogenase and glycoside hydrolase 61., 2011, 77(19): 7007-7015.
[28] Lombard V, Golaconda Ramulu H, Drula E, Coutinho P M, Henrissat B.The carbohydrate-active enzymes database (CAZy) in 2013., 2014, 42(Database issue): D490-D495.
[29] Karkehabadi S, Hansson H, Kim S, Piens K, Mitchinson C, Sandgren M. The first structure of a glycoside hydrolase family 61 member, Cel61B from, at 1.6 Å resolution., 2008, 383(1): 144-154.
[30] Salinas A, Vega M, Lienqueo M E, Garcia A, Carmona R, Salazar O. Cloning of novel cellulases from cellulolytic fungi: heterologous expression of a family 5 glycoside hydrolase fromin., 2011, 49(6/7): 485-491.
[31] Koseki T, Mese Y, Fushinobu S, Masaki K, Fujii T, Ito K, Shiono Y, Murayama T, Iefuji H. Biochemical characterization of a glycoside hydrolase family 61 endoglucanase from., 2008, 77(6): 1279-1285.
[32] Rajeshwari R, Jha G, Sonti R V. Role of an-expressed xylanase ofpvin promoting virulence on rice., 2005, 18(8): 830-837.
[33] Jacobs K A, Collins-Racie L A, Colbert M, Duckett M, Golden-Fleet M, Kelleher K, Kriz R, LaVallie E R, Merberg D, Spaulding V, Stover J, Williamson M J, McCoy J M. A genetic selection for isolating cDNAs encoding secreted proteins., 1997, 198(1/2): 289-296.
[34] Fang A, Han Y Q, Zhang N, Zhang M, Liu L J, Li S, Lu F, Sun W X. Identification and characterization of plant cell death- inducing secreted proteins from., 2016, 29(5): 405-416.
[35] 孔祥久, 石洁, 孔繁芳, 王忠跃, 张昊. 葡萄霜霉菌候选效应子RXLR5信号肽的鉴定. 植物保护, 2016, 42(1): 40-44.
Kong X J, Shi J, Kong F F, Wang Z Y, Zhang H. Identification of the signal peptide of candidate effector protein RXLR5 from, 2016, 42(1): 40-44. (in Chinese)
[36] Gu B, Kale S D, Wang Q H, Wang D H, Pan Q N, Cao H, Meng Y L, Kang Z S, Tyler B M, Shan W X. Rust secreted protein Ps87 is conserved in diverse fungal pathogens and contains a RXLR-like motif sufficient for translocation into plant cells., 2011, 6(11): e27217.
[37] Dou D, Kale S D, Wang X, Jiang R H, Bruce N A, Arredondo F D, Zhang X, Tyler B M. RXLR-mediated entry ofeffectorinto soybean cells does not require pathogen-encoded machinery., 2008, 20(7): 1930-1947.
pathogenicity and gene expression pattern of the exocrine protein LtGH61A of grape canker fungus
Peng JunBo, Li XingHong, Zhang Wei, Zhou Ying,HUANG JinBao, Yan JiYe
(Institute of Plant and Environment Protection, Beijing Academy of Agriculture and Forestry Sciences/Beijing Key Laboratory of Environmental Friendly Management of Diseases and Pests of North China Fruits, Beijing 100097)
【Objective】Grape canker disease, caused bygenus fungi, occurs in a wide range of grape-producing areas in China and seriously threatens the yield and quality of grape. The objective of this study is to analyze the function of a hypothetical exocrine protein, LtGH61A, in grape canker fungus, and to lay a foundation for in-depth analysis of the pathogenic mechanism and disease control of grape canker fungus.【Method】The signal peptide of LtGH61A protein was predicted by SignalP 4.0. The function of LtGH61A protein was predicted by the homologous comparison and functional annotation. The exocrine characteristic of LtGH61A protein was analyzed by yeast complementary experiment. The quantitative real-time PCR (qRT-PCR) was used to analyze the expression ofin vegetative hyphae and different infection processes. The expression ofwas inhibited through RNA interference (RNAi). The effect of LtGH61A protein on the pathogenicity ofwas analyzed byinoculation test of grape shoots. The effect of LtGH61A protein on the hyphal growth rate ofwas analyzed by comparing the colony diameter.【Result】Amino acid sequence analysis predicts that the N-terminal of the LtGH61A protein contains a signal peptide with a length of 18 amino acids. The gene function annotation suggests that LtGH61A belongs to glycoside hydrolase family 61 (GH61) and can degrade cellulose as a substrate. Yeast complementary experiments showed that the signal peptide of LtGH61A protein could guide the secretion of invertase of yeast YTK12. Compared with the vegetative hyphae, the expression ofwas increased significantly at the infectious stages, and the mRNA accumulation ofat 48 h post inoculation was 19 times of that in the vegetative hyphae. Moreover, RNAi lines were constructed forand two lines RNAi-LtGH61A1 and RNAi-LtGH61A2 were confirmed by qRT-PCR. The results ofinoculation test of wild-type and RNAi transformants on wounded grape shoots showed that the lesion length caused by both RNAi-LtGH61A1 and RNAi-LtGH61A2 was significantly shorter than that of wild type (WT) CSS-01s, which was about 55% of WT, indicating that LtGH61A affected the pathogenicity of. The colony diameter comparison showed that compared with WT, the colony diameter of RNAi-LtGH61A1 and RNAi-LtGH61A2 transformants became smaller, about 85% of WT, indicating that LtGH61A affected the hyphal growth rate of.【Conclusion】LtGH61A affects the pathogenicity and hyphal growth of grape canker pathogen. LtGH61A protein can be secreted outside the cell. The expression level ofduring infectious stages is significantly increased, suggesting that LtGH61A can destroy the host plant tissue by exerting its own enzyme activity function, thus promoting pathogen infection.
grape canker fungus; exocrine protein; pathogenicity; expression pattern; qRT-PCR; RNA interference (RNAi)
2019-06-24;
2019-07-18
北京市青年拔尖个人项目(2016000021223ZK29)、北京市农林科学院院储备项目(KJCX20170412)
彭军波,E-mail:pjb169961@163.com。通信作者燕继晔,E-mail:jiyeyan@vip.163.com
(责任编辑 岳梅)

