安罗替尼用于二线治疗EGFR T790M阴性晚期非小细胞肺癌的疗效和安全性分析
林贵南 彭杰文
[摘要] 目的 探讨安罗替尼在一线EGFR-TKI耐药后T790M阴性的晚期非小细胞肺癌中的疗效与安全性。 方法 回顾性收集2018年1月~2019年12月本中心一线EGFR-TKI耐药且EGFR T790M阴性的晚期非小细胞肺癌病例,比较安罗替尼组和全身化疗组的近期疗效、生存情况及不良反应。 结果 22例患者接受安罗替尼治疗,PR 14例,SD 4例,PD 4例;而35例接受全身化疗,其中PR 11例,SD 8例,PD 16例。安罗替尼组的ORR(63.6% vs. 31.4%,P=0.017)和DCR(81.8% vs. 54.3%,P=0.034)明显高于全身化疗组,安罗替尼组的中位PFS为5.3个月(4.1,6.5),而全身化疗组仅为3.1个月(2.8,3.4),差异有统计学意义(P=0.001)。安罗替尼常见毒副反应有乏力、高血压、蛋白尿等,绝大部分为轻中度。 结论 在一线EGFR-TKI耐药后EGFR T790M阴性的晚期非小细胞肺癌患者中,安罗替尼比全身化疗更加有效,且毒副反应可耐受。
[关键词] 非小细胞肺癌;安罗替尼;EGFR T790M阴性;EGFR-TKI耐药
[中图分类号] R734.2 [文献标识码] B [文章编号] 1673-9701(2020)31-0088-04
[Abstract] Objective To investigate the efficacy and safety of anlotinib in advanced non-small cell lung cancer with negative T790M after first-line EGFR-TKI resistance. Methods The first-line cases of advanced non-small cell lung cancer with EGFR-TKI resistance and negative EGFR T790M admitted to our center from January 2018 to December 2019 were collected retrospectively, and the short-term efficacy, survival and adverse reactions(ADRs)were compared between the anlotinib group and the systemic chemotherapy group. Results A total of 22 patients were treated with anlotinib, of which 14 cases got PR, 4 cases got SD and 4 cases got PD. While 35 cases were given systemic chemotherapy, of which 11 cases got PR, 8 cases got SD and 16 cases got PD. ORR(63.6% vs. 31.4%, P=0.017) and DCR(81.8% vs. 54.3%, P=0.034) in the anlotinib group were significantly higher than those in the systemic chemotherapy group. The median PFS in the anlotinib group was 5.3 months(4.1, 6.5), and the median PFS in the systemic chemotherapy group was only 3.1 months(2.8, 3.4), with the significant difference(P=0.001). The common ADRs of anlotinib included fatigue, hypertension and proteinuria, most of which were mild to moderate. Conclusion In patients with advanced non-small cell lung cancer with negative EGFR T790M after first-line EGFR-TKI resistance, anlotinib is more effective than systemic chemotherapy, and its toxic side effects can be tolerated.
[Key words] Non-small cell lung cancer; Anlotinib; Negative EGFR T790M; EGFR-TKI resistance
在晚期非鱗状细胞非小细胞肺癌中,大约有50%患者存在表皮生长因子受体(Epidermal growth factor receptor,EGFR)敏感突变,主要是EGFR19号外显子缺失突变和21号外显子点突变[1]。在合并有EGFR敏感突变的晚期非小细胞肺癌患者中,EGFR酪氨酸激酶抑制剂(Tyrosine kinase inhibitors,TKI),具有高效低毒的优势,成为标准一线治疗方案[2]。然而,第一、二代EGFR-TKI在一线治疗中,中位1年的时间会出现耐药进展,50%~60%患者的耐药是与EGFR T790M突变有关[3]。针对继发性EGFR T790M突变,开发了第三代EGFR-TKI药物奥希替尼,AURA3研究证实在继发性EGFR T790M阳性患者中,奥希替尼完胜化疗,成为首选推荐方案[4]。但是,对于一线EGFR-TKI耐药后无继发性EGFR T790M突变,仅能接受含铂双药化疗方案,其有效性低,且副作用大,需要寻找更加有效的治疗方案。
安罗替尼属于多靶点酪氨酸激酶抑制剂,作用于血管内皮细胞生长因子受体(Vascular endothelial growth factor receptor,VEGFR)、成纤维细胞生长因子受体(Fibroblast growth factor receptor,FGFR)和血小板衍生生长因子受体(Platelet-derived growth factor receptor,PDGFR)等通路,全面阻断肿瘤血管新生,强力抑制肿瘤细胞增殖[5]。ALTER 0303研究证实,安罗替尼用于晚期非小细胞肺癌三线治疗,中位的无进展生存时间为5.4个月,总生存时间为9.6个月,同时毒副反应可耐受[6]。同时体外实验显示,安罗替尼能通过抑制FGFR1信号通路逆转EGFR-TKI继发性耐药[7]。
由于一线EGFR-TKI耐药后T790M阴性的晚期非小细胞肺癌患者接受全身化疗的效果差,且安罗替尼在难治性晚期非小细胞肺癌中具有高效、低毒,以及有逆转EGFR-TKI继发性耐药的潜能,因此,本研究旨在探讨安罗替尼在一线EGFR-TKI耐药且无继发性EGFR T790M突变的晚期非小细胞肺癌中的疗效与安全性,现报道如下。
1 资料与方法
1.1 临床资料
回顾性收集本中心在2018年1月~2019年12月期间收治的晚期非小细胞肺癌病例。纳入标准[8]:(1)经病理组织学或细胞学确诊的非鳞状细胞非小细胞肺癌;(2)影像学检查确定临床分期为Ⅳ期;(3)年龄18~75岁;(4)美国东部肿瘤协作组体力状态(Eastern cooperative oncology group performance status,ECOG PS)评分为0~2分;(5)合并有EGFR19号外显子缺失突变或21号外显子点突变;(6)一线治疗方案为第一或二代EGFR-TKI,如吉非替尼或厄洛替尼或埃克替尼或阿法替尼;且疗效评估为肿瘤稳定或肿瘤缓解;(7)一线EGFR-TKI出现耐药进展后,基因检测明确EGFR T790M为阴性;(8)二线治疗方案为安罗替尼或含铂的培美曲塞方案化疗;(9)至少有一个可测量病灶(符合实体肿瘤的疗效评价标准1.1 版的要求)。本研究通过医院医学伦理委员会的审批。所有患者在入组前均被告知研究的相关利弊及风险,并签署知情同意书。
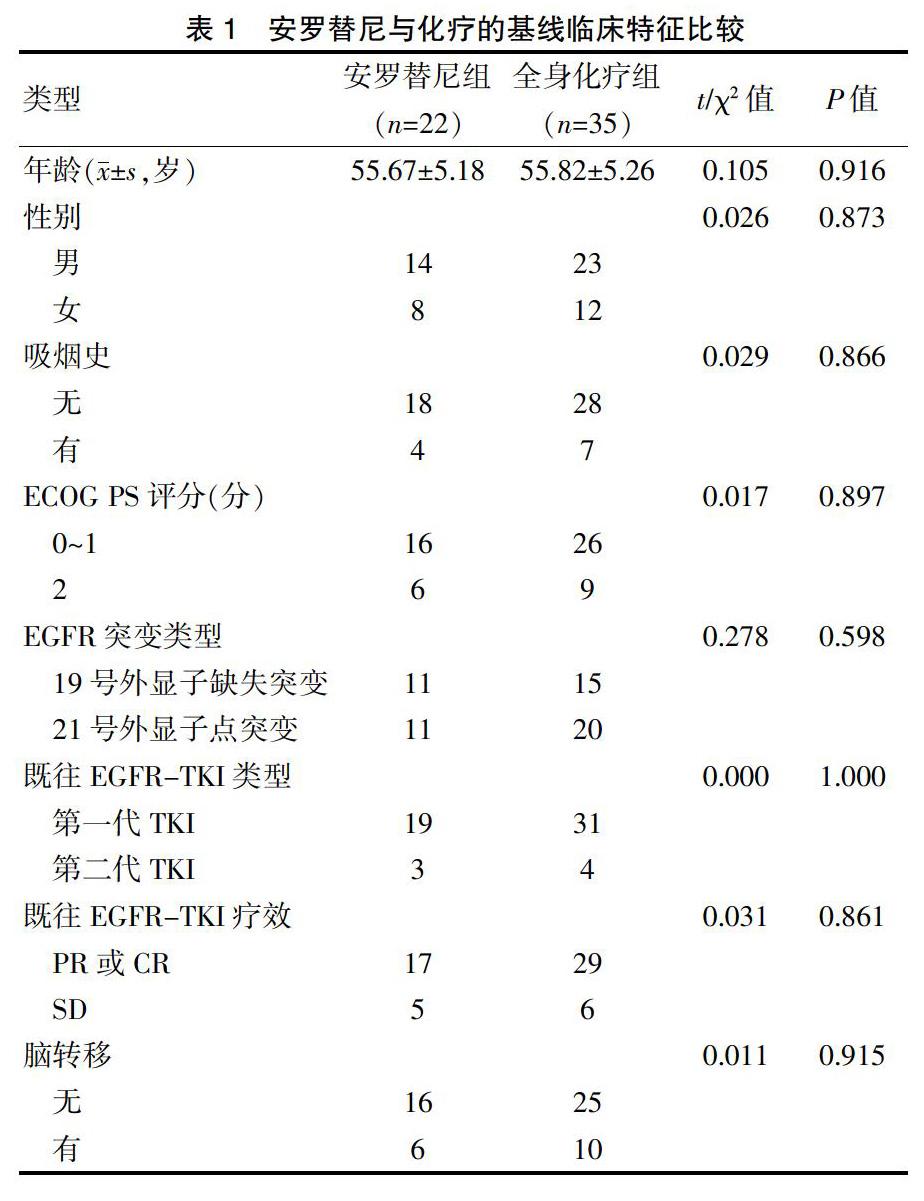
回顾性收集本中心在2018年1月~2019年12月期间收治的晚期非小细胞肺癌病例,共收集符合入选标准病例为58例,其中接受安罗替尼治疗22例(安罗替尼组),接受全身化疗(全身化疗组)35例,随访截止时间为2020年2月29日。两组患者的年龄、性别、吸烟史、ECOG PS评分、EGFR突变类型、既往EGFR-TKI类型、既往EGFR-TKI疗效及脑转移等基线临床特征比较,差异无统计学意义(P>0.05),具有可比性。见表1。
1.2 方法
盐酸安罗替尼胶囊(正大天晴药物集团股份有限公司,批准文号:国药准字H20180003,10 mg/粒)用法:10 mg/(次·d),连续服用14 d,休息7 d,21 d为一个疗程,直到毒副反应不能耐受或出现疾病进展。化疗方案:顺铂(齐鲁制药有限公司,批准文号:国药准字H37021362,20 mg/支)用法:25 mg/m2,静脉滴注,第1~3天;注射用培美曲塞二钠(礼来制药,批准文号:国药准字H20080529,500 mg/支)用法:500 mg/m2,静脉滴注,第1天,每21天为一个疗程,最多4~6个疗程,获得疾病稳定或肿瘤缓解时,改为培美曲塞二钠单药维持,500 mg/m2,静脉滴注,第1天,每21天为一个疗程,直到疾病进展或出现不能耐受毒副反应。
1.3 观察指标及评价标准
采用实体肿瘤的疗效评价标准[9]1.1 版评价肿瘤客观疗效,分为完全缓解(Complete response,CR)、部分緩解(Partial response,PR)、疾病稳定(Stable disease,SD)及疾病进展(Progressive disease,PD)。客观缓解率(Object response rate,ORR)定义为CR和PR病例数在可评价疗效患者中的百分比;疾病控制率(Disease control rate,DCR)定义为CR、PR和SD病例数在可评价疗效患者中的百分比。无进展生存(Progression-free survival,PFS)定义为患者从首次化疗或安罗替尼治疗至任何有记录的影像学肿瘤进展或死亡的时间,当最后一次随访时未发生疾病进展或死亡,或死亡发生于疾病进展之前,则记为删失事件。按照美国国立癌症研究所常见毒性分级标准4.03版评价药物的安全性。
1.4 统计学方法
采用SPSS 19.0统计学软件进行数据分析,计量资料以均数±标准差(x±s)表示,组间比较采用 t检验,计数资料以[n(%)]表示,采用χ2检验,采用Kaplan-Meier进行生存分析,以Log-rank检验分析两组的无进展生存时间差异,P<0.05为差异有统计学意义。
2 结果
2.1 两组疗效比较
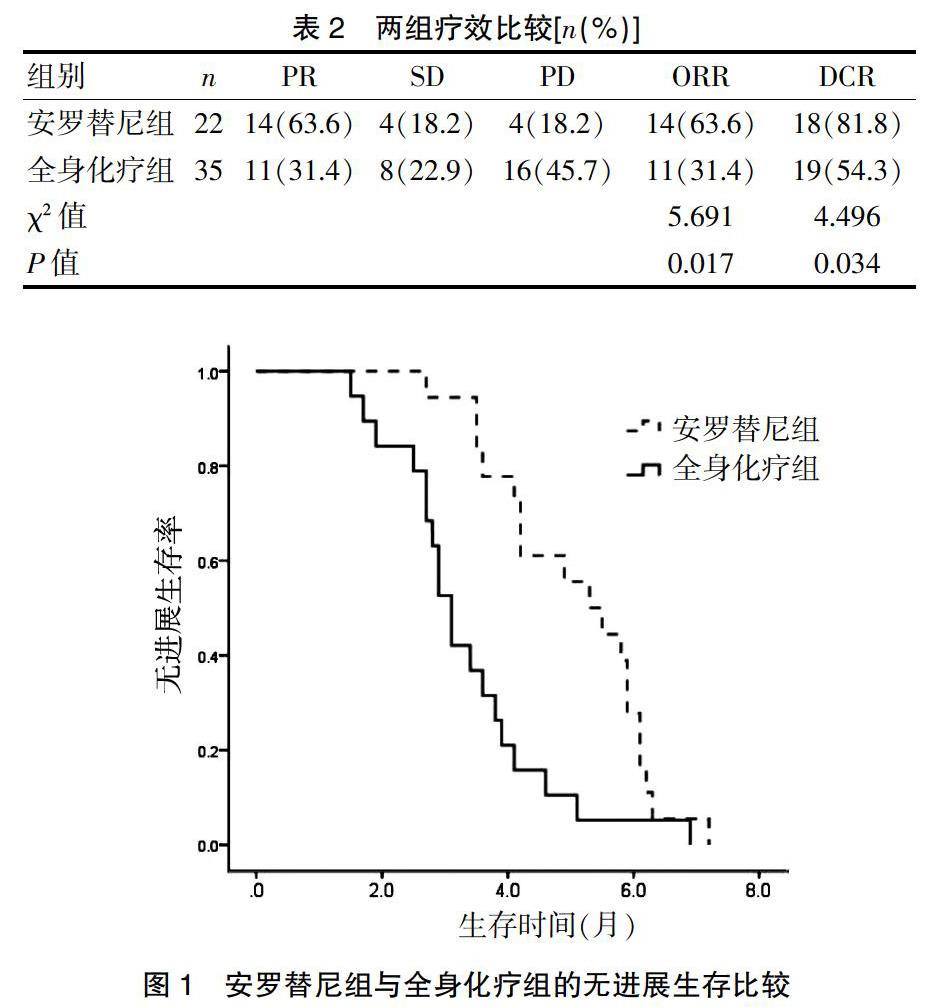
安罗替尼组22例患者,其中PR 14例,SD 4例,PD 4例;全身化疗组35例患者,其中PR 11例,SD 8例,PD 16例。安罗替尼组的ORR明显高于全身化疗组(63.6% vs. 31.4%,P=0.017),同样在DCR方面,安罗替尼组明显高于全身化疗组(81.8% vs. 54.3%,P=0.034);安罗替尼组的中位PFS为5.3个月(4.1,6.5),而全身化疗组仅为3.1个月(2.8,3.4),组间比较差异有统计学意义(P=0.001)。见表2、图1。
2.2 两组的毒副反应比较
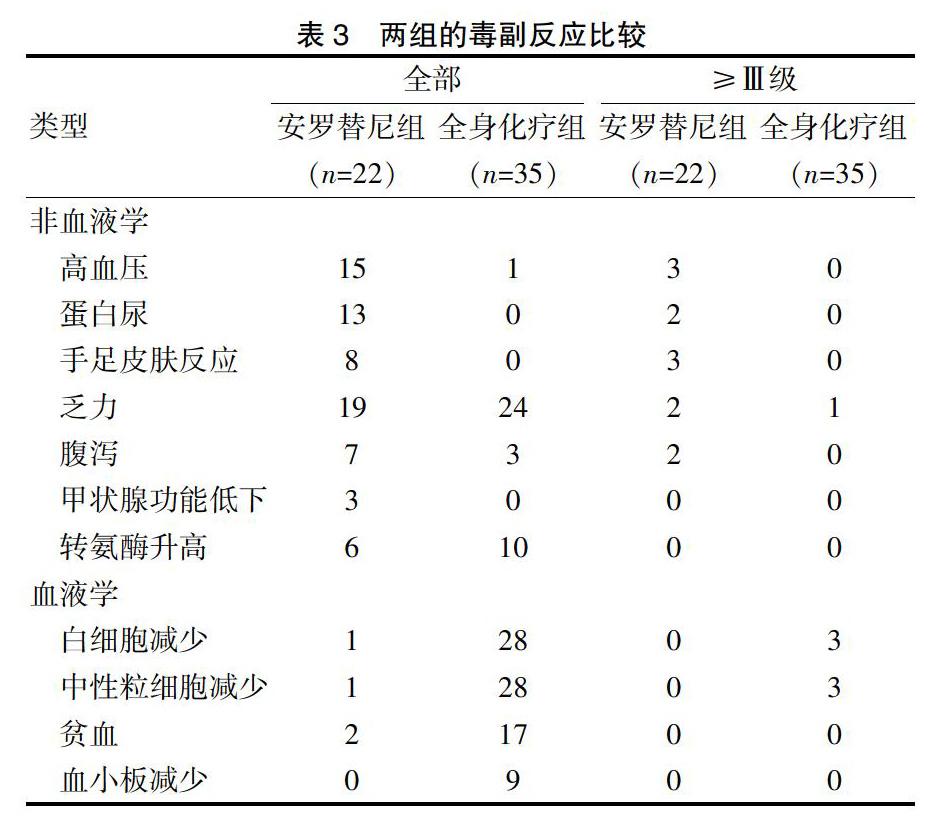
安罗替尼组的主要毒副反应为非血液学方面,如高血压、蛋白尿、乏力等,绝大数为Ⅰ~Ⅱ级,可耐受;而在血液学方面的毒副反应发生率低。相反,全身化疗组的最主要毒副反应是血液学方面,但多为Ⅰ~Ⅱ级。见表3。
3 讨论
晚期非小细胞肺癌患者采用单纯的含铂双药化疗方案治疗,中位生存时间为11个月;而对于存在EGFR敏感突变的晚期非小细胞肺癌患者接受EGFR-TKI靶向治疗,中位生存时间为28个月,生存时间明显延长,开启了肺癌精准治疗。但是,对于EGFR突变阳性的晚期非小细胞肺癌患者,一线使用EGFR-TKI靶向治疗,中位的无进展生存时间仅为10~13个月,大约50%的耐药患者出现新的基因突变,即EGFR T790M。奥希替尼作为第三代EGFR-TKI,能克服继发性T790M突变,AURA 3研究显示奥希替尼在继发性T790M突变阳性的晚期非小细胞肺癌患者中,中位PFS为10.1个月[10]。然而,仍有一半的EGFR-TKI耐药的晚期非小细胞肺癌未见继发T790M突变,后线治疗仅能接受含铂双药化疗,其中位PFS为4.4个月,ORR为30%,预后差[11]。对于驱动基因阴性的晚期非小细胞肺癌患者,纳武单抗、帕博利珠单抗取代多西他赛成为了二线标准治疗方案[12]。然而在EGFR突变阳性的晚期非小细胞肺癌中,二线接受免疫检查点抑制剂治疗,相对于化疗,没有生存优势(HR=1.11,P=0.005),原因可能与此类患者的PD-L1表达低、肿瘤突变负荷低有关[13-14]。因此,需要寻找更加有效的药物去治疗EGFR-TKI耐药且T790M突变阴性的晚期非小细胞肺癌。
安罗替尼属于多靶点酪氨酸激酶抑制剂,作用于VEGFR1-3、FGFR1-3、PDGFR αβ、EGFR和干细胞因子受体等通路,能抑制肿瘤血管形成和肿瘤细胞生长[5,15]。基础研究显示,联合抑制VEGF和EGFR信号通路,可以降低EGFR-TKI耐药并提高其抗肿瘤活性[16]。同时,安罗替尼能通过抑制FGFR1信号通路逆转EGFR-TKI继发性耐药[7]。ALTER 0303研究证实在晚期非小细胞肺癌患者中,三线安罗替尼的疗效明显优于安慰剂组,具有更高的ORR(10.0% vs. 0%,P=0.028)和更长的PFS(5.4 vs. 1.4个月,P<0.0001)[6]。
本研究结果显示,一线EGFR-TKI耐药且T790M阴性的晚期非鳞状细胞非小细胞肺癌患者中,单纯化疗安罗替尼组的ORR明显高于全身化疗组(63.6% vs. 31.4%,P=0.017),同样在DCR方面,安罗替尼组明显高于全身化疗组(81.8% vs. 54.3%,P=0.034);相对于全身化疗组,安罗替尼组具有更长的中位PFS(5.3个月 vs. 3.1个月,P=0.001)。虽然安罗替尼的有效性优于全身化疗,但是,其中位PFS仅为5.3个月,对临床管理这类患者提出了挑战。可以通过EGFR敏感突变阳性的晚期非小细胞肺癌一线治疗方案演变中借鉴经验[1,17]。晚期软组织肉瘤中安罗替尼联合化疗获得较好的疗效且耐受性可,为两者联合提高了一定的研究基础[18]。因此,安罗替尼联合化疗也许是未来肺癌治疗的研究方向。
安罗替尼的毒副反应主要集中在非血液学方面,如高血压、蛋白尿、乏力等,ALTER 0303研究中僅9%患者因副反应需要降低剂量,同时推荐治疗方案为用药2周、停药1周,降低药物长期暴露时间。因此,安罗替尼具有很好的安全性[6]。
综上所述,安罗替尼在EGFR-TKI耐药且T790M突变阴性的晚期非小细胞肺癌患者中具有一定的疗效,且副反应可耐受;但由于本研究属于回顾性,且样本量偏少,仍需要前瞻性大型临床试验进一步验证。
[参考文献]
[1] Mok TS,Wu YL,Thongprasert S,et al. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma[J]. N Engl J Med,2009,361:947-957.
[2] Tan DS,Yom SS,Tsao MS,et al. The International Association for the study of lung cancer consensus statement on optimizing management of EGFR mutation-positive non-small cell lung cancer:Status in 2016[J]. J Thorac Oncol,2016,11:946-963.
[3] Yu HA,Arcila ME,Rekhtman N,et al. Analysis of tumor specimens at the time of acquired resistance to EGFR-TKI therapy in 155 patients with EGFR-mutant lung cancers[J].Clin Cancer Res,2013,19:2240-2247.
[4] Mok TS,Wu Y,Ahn M,et al. Osimertinib or platinum-pemetrexed in EGFR T790M-positive lung cancer[J]. N Engl J Med,2017,7(376):629-640.
[5] Sun Y,Niu W,Du F,et al.Safety,pharmacokinetics,and antitumor properties of anlotinib,an oral multi-target tyrosine kinase inhibitor,in patients with advanced refractory solid tumors[J]. J Hematol Oncol,2016,9(1):105.
[6] Han B,Li K,Wang Q,et al. Effect of anlotinib as a third-line or further treatment on overall survival of patients with advanced non-small cell lung cancer:The ALTER 0303 phase 3 randomized clinical trial[J].JAMA Oncol,2018,4(11):1569-1575.
[7] Lian Z,Du W,Zhang Y,et al. Anlotinib can overcome acquired resistance to EGFR-TKIs via FGFR1 signaling in non-small cell lung cancer[J]. Thorac Cancer,2020 May 20.
[8] Schiller JH,Harrington DP,Belani CP,et al. Comparison of four chemotherapy regimens for advanced non-small-cell lung cancer[J]. The New England Journal of Medicine,2002,346(2):92-98.
[9] Maemondo M,Inoue A,Kobayashi K,et al. Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR[J]. The New England Journal of Medicine,2010,362(25):2380-2388.
[10] Herbst RS,Baas P,Kim DW,et al. Pembrolizumab versus docetaxel for previously treated,PD-L1-positive,advanced non-small-cell lung cancer (KEYNOTE-010): A randomised controlled trial[J]. Lancet,2016,387(10027):1540-1550.
[11] Borghaei H,Paz-Ares L,Horn L,et al.Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer[J]. N Engl J Med,2015,373(17):1627-1639.
[12] Lee CK,Man J,Lord S,et al. Clinical and molecular characteristics associated with survival among patients treated with checkpoint inhibitors for advanced non-small cell lung carcinoma:A systematic review and meta-analysis[J]. JAMA Oncol,2018,4(2):210-216.
[13] Spigel DR,Schrock AB,Fabrizio D,et al.Total mutation burden (TMB) in lung cancer (LC) and relationship with response to PD-1/PD-L1 targeted therapies[J]. J Clin Oncol,2016,34(15 suppl):9017.
[14] Passiglia F,Bronte G,Bazan V,et al. PD-L1 expression as predictive biomarker in patients with NSCLC:A pooled analysis[J]. Oncotarget,2016,7(15):19 738-19 747.
[15] Lin B,Song X,Yang D,et al. Anlotinib inhibits angiogenesis via suppressing the activation of VEGFR2,PDGFRβ and FGFR1[J]. Gene,2018,654:77-86.
[16] Tabernero J. The role of VEGF and EGFR inhibition:Implications for combining anti-VEGF and anti-EGFR agents[J]. Mol Cancer Res,2007,5:203-220.
[17] Hosomi Y,Morita S,Sugawara S,et al. North-East Japan Study Group. Gefitinib alone versus gefitinib plus chemotherapy for non-small-cell lung cancer with mutated epidermal growth factor receptor:NEJ009 Study[J]. J Clin Oncol,2020,38(2):115-123.
[18] Wang HY, Chu JF,Zhang P,et al. Safety and efficacy of chemotherapy combined with anlotinib plus anlotinib maintenance in Chinese patients with advanced/metastatic soft tissue sarcoma[J]. Onco Targets Ther,2020,13:1561-1568.
(收稿日期:2020-06-08)

