人参总皂苷对D-半乳糖致PC12细胞衰老的改善作用及其机制研究
乔巨慧 赵大庆 刘美辰 睢博文 刘颖 邢欣


摘 要 目的:研究人參总皂苷对D-半乳糖致PC12细胞衰老的改善作用及其机制。方法:将大鼠嗜铬细胞瘤(PC12)细胞用D-半乳糖处理以建立细胞衰老模型。采用CCK-8法筛选D-半乳糖的建模浓度和人参总皂苷的给药浓度。试验设正常对照组、模型组和人参总皂苷低、高浓度组,检测各组细胞衰老情况、细胞凋亡率、细胞周期和细胞中线粒体膜电位(MMP)、三磷酸腺苷(ATP)、活性氧(ROS)水平以及凋亡相关蛋白[B淋巴细胞瘤2(Bcl-2)及其相关蛋X蛋白(Bax)、细胞色素C(Cyt-C)]和氧化损伤相关蛋白[核因子2相关因子2(Nrf2)、血红素氧合酶1(HO-1)]表达水平,另设阳性药物组[5 mmol/L N-乙酰-L-半胱氨酸(NAC)]和阳性对照组[D-半乳糖+5 mmol/L NAC]比较氧化损伤相关蛋白水平。结果:D-半乳糖能显著抑制PC12细胞的存活率,临界浓度为20 mg/mL;人参总皂苷可显著增加D-半乳糖诱导衰老细胞的存活率,半数效应浓度为65 μg/mL,故将后续试验人参总皂苷的低、高浓度设置为55、65 μg/mL。与正常对照组比较,模型组衰老细胞数明显增加,细胞凋亡率和G1期细胞比例均显著增加,S期细胞比例、细胞中MMP、ATP含量和Bcl-2蛋白以及线粒体中Cyt-C蛋白表达水平均显著降低,ROS含量和Bax、Nrf2蛋白及胞浆内Cyt-C蛋白表达均显著升高(P<0.05或P<0.01)。与模型组比较,人参总皂苷低、高浓度组衰老细胞数明显减少,细胞凋亡率和G1期细胞比例均显著降低,S期细胞比例、细胞中MMP、ATP(除低浓度组外)含量和Bcl-2、Nrf2、HO-1蛋白以及线粒体中Cyt-C蛋白表达水平均显著升高,ROS(除低浓度组外)含量和Bax蛋白及胞浆内Cyt-C蛋白表达水平均显著降低;阳性对照组细胞内Nrf2、HO-1蛋白表达水平亦显著升高(P<0.05或P<0.01),但均低于人参总皂苷组。结论:人参总皂苷可改善D-半乳糖诱导的P12细胞衰老,其机制可能与激活Nrf2抗氧化信号途径拮抗D-半乳糖诱导的氧化应激、缓解其所致的线粒体功能障碍有关。
关键词 人参总皂苷;D-半乳糖;PC12细胞;衰老;线粒体;凋亡相关蛋白;氧化损伤相关蛋白
ABSTRACT OBJECTIVE: To study the improvement effects of total ginsenosides on the senescence of PC12 cells induced by D-galactose and its mechanism. METHODS: Rat pheochromocytoma (PC12) cells were treated with D-galactose to establish cell senescence model. CCK-8 method was used to screen the D-galactose modeling concentration and total ginsenosides concentration. Normal control group, model group, total ginsenosides low and high concentration groups were set up. Cell senescence, cell apoptosis rate, apoptotic cycle and mitochondrial membrane potential (MMP), cell adenosine triphosphate (ATP) and reactive oxygen species (ROS) levels in each group were detected. The expression of apoptosis related proteins [B lymphoma 2 (Bcl-2) and its related egg X protein (Bax), cytochrome C (Cyt-C)] and oxidative damage related proteins [nuclear factor 2 related factor 2 (Nrf2),heme oxygenase 1 (HO-1)] were detected. In addition, positive drug group [5 mmol/L N-acetyl-L-cysteine (NAC)] and positive control group [D-galactose+5 mmol/L NAC] were set up to compare the levels of oxidative damage related proteins. RESULTS: D-galactose could significantly inhibit the survival rate of PC12 cells, with a critical concentration of 20 mg/mL. The total ginsenosides could significantly increase the survival rate of D-galactose induced senescent cells with a median effective concentration (EC50) of 65 μg/mL,and then the low and high concentrations of total ginsenosides were set at 55 and 65 μg/mL. Compared with normal control group, the number of aging cells increased, the apoptotic rate and percentage of G1 phase were significantly increased in model group. the percentage of S phase, MMP and ATP contents, the protein expression of Bcl-2 and Cyt-C in mitochondria were decreased significantly, while ROS content, the protein expression of Bax, Nrf2 and Cyt-C protein in endochylema were increased significantly (P<0.05 or P<0.01). Compared with model group, the number of aging cells reduced, the apoptosis rates and percentage of G1 phase were significantly decreased in total ginsenosides low and high concentration groups, the percentage of S phase, the contents of MMP and ATP (except for low concentration group), protein expression of Bcl-2, Nrf2 and HO-1 as well as protein expression of Cyt-C in mitochondria were increased significantly; ROS level (except for low concentration group) and Bax protein as well as protein expression of Cyt-C were decreased significantly. The protein expression of Nrf2 and HO-1 were increased significantly in positive control group (P<0.05 or P<0.01), but it was lower than that of total ginsenosides groups. CONCLUSIONS: Total ginsenosides can improve D-galactose induced senescence of P12 cells,the mechanism of which may be related to activating Nrf2 antioxidant signal pathway to antagonize D-galactose induced oxidative stress and alleviating mitochondrial dysfunction.
KEYWORDS Total ginsenosides; D-galactose; PC12 cells; Senescence; Mitochondria; Apoptosis related protein; Oxidative damage related protein
衰老是神经退行性疾病发生的主要诱因,包括阿尔茨海默病(AD)、帕金森病(PD)在内的多种神经退行性疾病均表现出了典型的年龄依赖性[1]。这提示加速衰老的因子可能参与了神经退行性疾病的发生发展,而延缓衰老可能会减少该类疾病的发生。衰老机制复杂,涉及基因组稳定性下降、表观遗传改变、营养失调、蛋白水解异常、端粒缩小、干细胞耗竭、线粒体功能障碍等多种因素[2-3]。其中,鉴于神经元代谢过程的高需氧量,线粒体功能紊乱可能是神经元衰老的核心因素[4],同时也是引发神经退行性疾病的关键因素[5]。因此,寻找能够有效维系线粒体功能进而延缓衰老的药物,对于防治神经退行性疾病和衰老均具有十分重要的意义。
人参是被学者普遍认可的可以延年益寿的传统中药材之一,其具有大补元气、生津止渴、安神益智、补脾益肺的功效[6-8]。《神农本草经》提到,人参可以“补五脏,安精神,定魂魄,止惊悸,久服轻身延年”[9]。现代药理学研究表明,人参中的皂苷类成分可通过抑制氧化应激而延缓衰老,并对AD、PD等多种神经退行性疾病具有治疗作用[10-12],但其作用机制尚不明确。PC12细胞是常用的神经细胞株,是来源于成年大鼠肾上腺髓质嗜铬细胞瘤的细胞系。本研究利用D-半乳糖诱导PC12细胞损伤模拟衰老模型,拟探索人参总皂苷对该细胞衰老的改善作用及其可能机制,旨在为深入研究人参总皂苷防治神经退行性疾病和衰老提供参考。
1 材料
1.1 仪器
iBright FL 1000型智能凝胶成像系统、FormaTM 3型CO2细胞培养箱、EVOS FL Auto型全自动细胞成像系统(美国Thermo Fisher Scientific公司);Infinite? 200 Pro型全自动酶标仪(上海帝肯贸易有限公司);Flow Sight型多维全景流式细胞仪(德国Merck Millipore公司);Mini Protean型蛋白电泳仪(美国Bio-Rad公司);Seahorse XFp型能量代谢分析仪(美国Agilent公司)。
1.2 药品与试剂
人参总皂苷[上海源叶生物科技有限公司,批号:S25997,纯度:≥80%(以人参皂苷Re计)];D-半乳糖(大连美仑生物科技有限公司,批号:MB1853-1,纯度:≥97%);N-乙酰-L-半胱氨酸(NAC,美国Med Chem Express公司,批号:HY-B0215,纯度:≥97%);灭活胎牛血清和RPMI 1640培养基(美国Hyclone公司);胰蛋白酶和青霉素-链霉素双抗(美国Molecular Research Center公司);细胞周期检测试剂盒、RIPA裂解液、线粒体细胞分离试剂盒、2′,7′-二氯荧光黄双乙酸盐(DCFH-DA)荧光探针溶液、细胞衰老β-半乳糖苷酶染色试剂盒、三磷酸腺苷(ATP)检测试剂盒、BCA蛋白浓度测定试剂盒、罗丹明123染色工作液、细胞核蛋白抽提试剂盒、特超敏ECL化学发光试剂盒、活性氧(ROS)检测试剂盒(上海碧云天生物技术有限公司,批号分别为C1052、P0013K、C3601、S0033-1、C0602、S0026、P0012S、C2007、P0027、P0018AS、S0033S);异硫氰酸荧光素(FITC)-膜联蛋白Ⅴ(Annexin Ⅴ)凋亡检测细胞试剂盒(美国BD Pharmingen公司,批号:556547);十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶配置液(北京索莱宝科技有限公司);CCK-8试剂盒(美国Boster Biological Technology公司,批号:AR1199);兔源B淋巴细胞瘤2(Bcl-2)及其相关X蛋白(Bax)、甘油醛-3-磷酸脱氢酶(GAPDH)多克隆抗体(北京艾斯廷科技有限公司,批号分别为ab196495、ab53154、ab245357);兔源细胞色素C(Cyt-C)、细胞色素C氧化酶Ⅳ(Cox Ⅳ)多克隆抗体(上海爱必信生物科技有限公司,批号分别为abs130083、abs131570);兔源核因子2相关因子2(Nrf2)单克隆抗体(美国Cell Signaling Technology公司,批号:12721S);鼠源血红素氧合酶1(HO-1)、核纤层蛋白B(Lamin B)单克隆抗体(美国Proteintech公司,批号分别为66743-1-Ig、66095-1-Ig);堿性磷酸酶标记的山羊抗兔IgG二抗(美国Sigma公司,批号:A3687);其余试剂均为分析纯,水为超纯水。
1.3 细胞
大鼠PC12细胞株购自中国科学院(上海)细胞库,由长春中医药大学人参科学研究院实验室留种保存。
2 方法与结果
2.1 细胞培养
PC12细胞用含10%灭活胎牛血清的RPMI 1640培养基,在37 ℃、5%CO2培养箱中培养,当细胞融合至80%~90%且生长状态良好时,用胰蛋白酶消化,传代,自第4代起用。
2.2 D-半乳糖对PC12细胞活力的影响
采用CCK-8法检测。取对数生长期的PC12细胞按1.6×108个/L、200 μL/孔接种于96孔板中。试验设空白组、正常对照组和模型组,每组设6个复孔。空白组不含细胞和药物;正常对照组细胞用完全培养液(RPMI 1640培养基+10%胎牛血清+1%青霉素-链霉素双抗)培养;模型组细胞用D-半乳糖终质量浓度分别为5、10、20、30、40 mg/mL的完全培养液分别在37 ℃、5%CO2培养箱中培养24 h后,更换完全培养液继续培养24 h。每孔加入CCK-8工作液20 μL,振荡混匀,继续培养0.5 h后,使用酶标仪于450 nm波长处检测各孔的吸光度(A)值并计算细胞存活率:细胞存活率(%)=(试验组A值-空白组A值)/(正常对照组A值-空白组A值)×100%。试验重复3次。采用GraphPad Prism 6软件进行统计分析;数据以x±s表示,组间比较采用单因素方差分析;P<0.05表示差异有统计学意义(统计方法下同)。结果,当D-半乳糖质量浓度为20 mg/mL及以上时,细胞存活率显著低于正常对照组(P<0.01),详见表1。因此,选取对P12细胞起毒性作用的临界浓度20 mg/mL作为后续试验中D-半乳糖的干预浓度。
2.3 人参总皂苷对PC12衰老细胞活力的影响
采用CCK-8法检测。取对数生长期的PC12细胞按1.6×108个/L、200 μL/孔接种于96孔板中。试验设空白组、正常对照组、模型组和药物组,每组设6个复孔。空白组和正常对照组均按“2.2”项下方法处理培养;模型组和药物组细胞用含20 mg/mL D-半乳糖的完全培养液培养24 h后,药物组细胞再加入人参总皂苷终质量浓度分别为1、2、4、8、16、32、64 μg/mL(给药浓度按预试验设置)的完全培养液继续培养24 h。然后按“2.2”项下“每孔加入CCK-8工作液20 μL”起进行操作,同法检测各孔的A值并计算细胞存活率和半数效应浓度(EC50)。试验重复3次。结果,与正常对照组比较,模型组细胞存活率显著降低(P<0.01)。与模型组比较,人参总皂苷能提高PC12衰老细胞的存活率,并随着给药浓度的增加,细胞存活率也有增加趋势,其中当质量浓度为8 μg/mL及以上时,组间比较差异均有统计学意义(P<0.01),详见表2。人参总皂苷对PC12衰老细胞的EC50为65 μg/mL,为便于试验延续,选择55、65 μg/mL作为后续试验中人参总皂苷的给药浓度。
2.4 人参总皂苷对PC12衰老细胞数的影响
采用β-半乳糖苷酶染色检测。取对数生长期的PC12细胞按4×108个/L、2 mL/孔接种于6孔板中。试验设正常对照组、模型组和药物组,除药物组中人参总皂苷终质量浓度分别为55、65 μg/mL(分别记为人参总皂苷低、高浓度组,下同)外,其余处理、培养条件均与“2.3”项相同。培养24 h后,按照细胞衰老β-半乳糖苷酶染色试剂盒说明书进行染色,在倒置显微镜下观察并对蓝色衰老阳性细胞进行计数。结果,与正常对照组比较,D-半乳糖处理过的P12细胞中衰老细胞数明显增加;经人参总皂苷处理后,各药物组的衰老细胞数均较模型组明显减少,详见图1。
2.5 人参总皂苷对PC12衰老细胞凋亡率的影响
采用流式细胞术检测。取对数生长期的PC12细胞按4×108个/L、2 mL/孔接种于6孔板中。按“2.4”项下方法分组、培养。培养24 h后,加入胰蛋白酶消化,1 000 r/min离心5 min,收集细胞沉淀,再用磷酸盐缓冲液(PBS,pH 7.2)漂洗2次,再按照FITC-Annexin Ⅴ凋亡检测细胞试剂盒说明书进行操作,使用流式细胞仪在激发波长488 nm处检测细胞凋亡情况并计算凋亡率:凋亡率=早期细胞凋亡率+晚期细胞凋亡率。结果,正常对照组、模型组和人参总皂苷低、高浓度组细胞的凋亡率分别为(15.85±1.54)%、(21.33±1.06)%、(12.76±1.89)%、(11.15±2.48)%(n=3)。与正常对照组比较,模型组细胞的凋亡率显著增加(P<0.05);与模型组比较,人参总皂苷低、高浓度组细胞凋亡率均显著降低(P<0.01),详见图2(图中,R2是正常细胞,R3是晚期凋亡细胞,R4是坏死细胞,R5是早期凋亡细胞)。
2.6 人参总皂苷对PC12衰老细胞周期的影响
采用流式细胞术检测。按“2.5”项下方法分组、培养、处理至“PBS漂洗2次”,随后加入4 ℃ 75%乙醇固定过夜,再用4 ℃PBS洗涤2次,1 000 r/min离心5 min,根據细胞周期试剂盒说明书方法配制碘化丙啶(PI)染色试剂,在37 ℃避光温浴30 min后,用流式细胞仪分析细胞周期。试验重复3次。结果,与正常对照组比较,模型组G1细胞比例显著升高,S期细胞比例显著降低(P<0.01),而G2期细胞比例组间比较差异均无统计学意义(P>0.05)。与模型组比较,人参总皂苷低、高浓度组G1期细胞比例显著降低(P<0.01),人参总皂苷高浓度组S期细胞比例显著升高(P<0.05),详见表3。
2.7 线粒体膜电位(MMP)检测
采用流式细胞术检测。按“2.4”项下方法分组、培养。培养24 h后,弃去培养基,细胞用胰蛋白酶消化,1 000 r/min离心5 min,收集沉淀,用PBS轻轻洗涤2次,在避光条件下,每孔加入罗丹明123染色工作液500 μL,使其终浓度为1~2 μmol/L,轻轻混匀,于37 ℃孵育30 min,弃去上清液,用PBS轻轻洗涤2次,用流式细胞仪检测细胞MMP,结果以各组与正常对照组的比值表示。试验重复3次。结果,与正常对照组比较,模型组细胞MMP显著降低(P<0.05);与模型组比较,人参总皂苷低、高浓度组细胞MMP均显著升高(P<0.01),详见图3。
2.8 细胞内ATP含量检测
按“2.4”项下方法分组、培养。培养24 h后,弃去培养基,加入RIPA裂解液200 μL,4 ℃下1 000 r/min离心5 min,取上清液用于后续的检测。根据ATP检测试剂盒说明书步骤进行操作,使用酶标仪检测ATP含量,结果以各组与正常对照组的比值表示。结果,与正常对照组比较,模型组细胞内ATP含量显著降低(P<0.01);与模型组比较,人参总皂苷高浓度组细胞内ATP含量显著升高(P<0.01),详见图4。
2.9 细胞中ROS含量检测
采用DCFH-DA荧光探针法检测。按“2.4”项下方法分组、培养。培养24 h后,弃去培养基,加入胰蛋白酶消化细胞,1 000 r/min离心5 min,用PBS漂洗2次,加入预先用PBS稀释的DCFH-DA荧光探针溶液100 μL,在37 ℃避光条件下孵育30 min,期间每5 min混匀1次,使探针和细胞充分接触;再以1 000 r/min离心5 min,弃去上清液,细胞用PBS漂洗3次,以充分除去未进入细胞的DCFH-DA,免除干扰;最后用PBS 200 μL重悬细胞,使用流式细胞仪在488 nm波长下检测细胞中ROS的含量,结果以各组与正常对照组的检验结果比值表示。试验重复3次。结果,与正常对照组比较,模型组细胞中ROS含量显著升高(P<0.01);与模型组比较,人参总皂苷高浓度组细胞中ROS含量显著降低(P<0.01),详见图5。
2.10 细胞凋亡相关蛋白表达检测
采用Western blotting法检测。按“2.4”项下方法分组、培养。培养24 h后,在冰浴条件下,用RIPA裂解液提取细胞总蛋白。按线粒体细胞分离试剂盒操作说明书提取线粒体蛋白和胞浆蛋白。使用BCA蛋白浓度测定试剂盒测定蛋白浓度,于沸水中加热8 min变性。取适量变性蛋白进行SDS-PAGE,转膜0.5 h,5%脱脂奶粉室温封闭1.5 h,在4 ℃条件下加入Bcl-2、Bax、Cyt-C、Cox Ⅳ、GAPDH一抗(稀释比例为1 ∶ 1 000),4 ℃孵育过夜;用PBST溶液洗涤3次(每次5 min),再加入二抗(稀释比例为1 ∶ 10 000),室温孵育1 h,用PBST溶液洗涤3次(每次5 min)。加入特超敏ECL化学发光试剂显色,于凝胶成像系统上成像,采用J 1.52a Image软件分析,分别以Bcl-2、Bax与内参GAPDH的灰度值比值表示细胞内Bcl-2、Bax蛋白的表达水平,以Cyt-C与GAPDH的灰度值比值表示胞浆内Cyt-C蛋白的表达水平,以Cyt-C与Cox Ⅳ的灰度值比值表示线粒体内Cyt-C蛋白的表达水平。试验重复3次。结果,与正常对照组比较,模型组细胞内Bcl-2和线粒体内Cyt-C蛋白的表达水平均显著降低,细胞内Bax和胞浆内Cyt-C蛋白的表达水平均显著升高(P<0.01)。与模型组比较,人参总皂苷低、高浓度组细胞内Bcl-2和线粒体内Cyt-C蛋白的表达水平均显著升高,细胞内Bax和胞浆内Cyt-C蛋白的表达水平均显著降低(P<0.05或P<0.01),详见图6、表4。
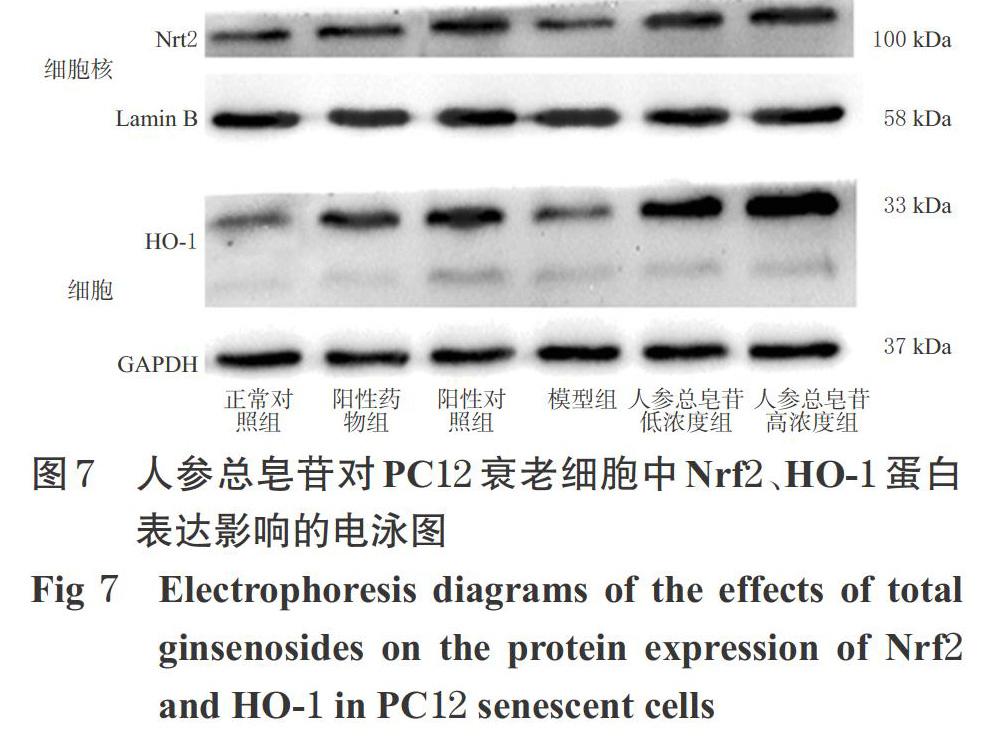
2.11 细胞氧化损伤相关蛋白表达检测
采用Western blotting法检测。按“2.4”项下方法分组、培养。培养24 h后,按“2.10”项下方法提取细胞总蛋白。采用细胞核蛋白抽提试剂盒按说明书提取核蛋白,检测氧化损伤相关蛋白Nrf2、HO-1表达,一抗稀释比例为1 ∶ 1 000,二抗稀释比例为1 ∶ 10 000,另设阳性药物组和阳性对照组进行比较。阳性药物组细胞用含5 mmol/L NAC的完全培养液培养1 h,阳性对照组细胞先用含5 mmol/L NAC的完全培养液培养1 h,再用含20 mg/mL D-半乳糖的完全培养液培养24 h。以Nrf2与Lamin B的灰度值比值表示细胞核内Nrf2蛋白的表达水平,以HO-1与GAPDH的灰度值比值表示细胞内HO-1蛋白的表达水平。试验重复3次。结果,与正常对照组比较,模型组细胞核内Nrf2蛋白的表达水平显著升高(P<0.05)。与模型组比较,阳性对照组和人参总皂苷低、高浓度组细胞核内Nrf2与细胞内HO-1蛋白的表达水平均显著升高(P<0.05或P<0.01),且人参总皂苷低、高浓度组Nrf2蛋白的表达水平略高于阳性对照组(P>0.05),HO-1蛋白的表达水平显著高于阳性对照组(P<0.01),推测人参总皂苷激活Nrf2信号通路可能是由ROS介导的,详见图7、表5。
3 讨论
长期以来,线粒体与细胞衰老调控的关系都是学者研究的热点之一,线粒体数量、结构及其功能的变化都能影响细胞衰老的过程与进程,已研究发现,可靶向作用于线粒体的天然产物活性分子或天然产物提取物在衰老调控及衰老相关疾病的预防和治疗领域具有广阔前景[13]。
D-半乳糖在正常情况下可经肝脏代谢成葡萄糖,但当其浓度较高时,D-半乳糖的积累不仅会导致细胞渗透压变化、细胞肿胀、膜脂损伤、脑神经退化,还可触发ROS的生成,ROS自由基再与氨基酸和蛋白质反应形成高级糖基化终产物,而这一产物在许多年龄相关的退行性疾病中很常见[14-16]。笔者采用D-半乳糖处理PC12细胞,证实了D-半乳糖确实可以促进ROS生成,加速衰老进程,主要表现在细胞存活率降低、衰老细胞数增加,并且将细胞阻滞在G1期。
本研究主要以人参总皂苷的抗氧化以及线粒体功能维系作用为基础,探索其对抗D-半乳糖诱导的神经损伤的改善作用及机制。作为衰老的特征之一,线粒体功能障碍在当前研究中已被证实与衰老进程存在复杂关联,如线粒体能量(MMP和ATP)供应不足可使机体代谢能力下降,进而发生一系列衰老变化,其中MMP的降低是诱导细胞凋亡的早期步骤[17-18]。本研究结果显示,D-半乳糖处理可导致细胞MMP和ATP含量显著降低;而人参总皂苷处理可阻止D-半乳糖导致的MMP降低,与此同时,人参总皂苷处理还可在一定程度上抑制D-半乳糖导致的细胞内ATP含量降低。此外,本研究还采用DCFH-DA荧光探针法检测了D-半乳糖处理后细胞内ROS含量。结果显示,D-半乳糖处理可显著升高细胞内ROS含量,但人参总皂苷处理可显著降低细胞内ROS含量。以上结果共同证明了人参总皂苷对D-半乳糖诱导PC12细胞线粒体功能紊乱具有改善作用。
细胞凋亡是由多种因子或蛋白参与的复杂的病理生理过程,其中抗凋亡蛋白(Bcl-2等)与促凋亡蛋白(如Bax、Cyt-C等)相互作用失衡尤为重要[19]。细胞凋亡的内部途径是以线粒体为核心因子去激活细胞凋亡[20]。本研究结果显示,在线粒体介导的细胞凋亡途径中,会伴随着定位于线粒体外膜上的抗凋亡蛋白Bcl-2表达水平显著下调、促凋亡蛋白Bax表达水平显著上调,进而诱导Cyt-C从线粒体向胞浆的大量释放,诱发细胞凋亡;然而,人参总皂苷可有效抑制这些蛋白的异常表达,从而降低细胞凋亡率。
Nrf2是细胞发生氧化应激反应的关键指标,也是氧化还原反应的敏感转录因子,更是抗氧化防御系统中的重要调节剂,其可调节下游抗氧化蛋白抗氧化酶HO-1、超氧化物歧化酶(SOD)、醌氧化还原酶1(NQO-1)和谷氨酰半胱氨酸连接酶催化亚基(GCLC)的表达而发挥抗氧化作用[21]。ROS在体内动态平衡和细胞信号转导中扮演着重要的角色,ROS的过量产生会导致线粒体功能和结构发生异常及线粒体呼吸链复合物活性降低,进而导致线粒体功能障碍,最终导致线粒体凋亡的发生[22-23]。Nrf2信号通路作为机体調节氧化应激反应的重要通路,主要通过调节抗氧化、抗炎及激活解毒蛋白的表达而发挥作用[24-25]。基于此,本文从Nrf2信号通路着手,拟通过上调机体抗氧化水平来对抗ROS损伤,从而保护神经系统。NAC是一种含巯基的抗氧化剂,具有基于巯基功能的抗氧化特性,能保护机体免受氧化应激损伤,亦可抑制神经细胞凋亡[26]。本研究结果显示,人参总皂苷可通过促进Nrf2蛋白发生核转移,提高其下游抗氧化蛋白HO-1的表达水平来抵抗氧化应激的发生;同时可通过调控细胞内Bcl-2和Bax表达水平抑制线粒体内Cyt-C向胞浆释放,从而减缓细胞凋亡。
综上所述,本研究初步验证了人参总皂苷能够通过激活Nrf2抗氧化信号途径拮抗D-半乳糖诱导的氧化应激、缓解D-半乳糖诱导的细胞线粒体功能障碍,从而抑制线粒体介导的细胞凋亡途径来发挥神经保护作用,提示人参总皂苷在神经退行性疾病的预防和治疗中存在潜在的应用价值。本文不足之处:人参总皂苷给药浓度选择时,考虑到试验周期长,药物浓度会有浮动,所以设置了两个接近的浓度,在后期研究中将予以完善。
参考文献
[ 1 ] 冯岩,孙剑.靶向脑衰老胶质细胞的运动防治PD研究进展[J].生理科学进展,2020,51(4):316-321.
[ 2 ] MILANOVIC M,FAN DNY,BELENKI D,et al. Senescence-associated reprogramming promotes cancer stemness[J]. Nature,2018. DOI:10.1038/nature25167.
[ 3 ] MANZELLA N,SANTIN Y,MAGGIORANI D,et al.Monoamine oxidase-A is a novel driver of stress-induced premature senescence through inhibition of parkin-mediated mitophagy[J]. Aging Cell,2018,17(5):1-14.
[ 4 ] 罗丽,秦正红.线粒体质量控制与神经元衰老及运动的干预作用[J].老年医学与保健,2017,23(6):451-454.
[ 5 ] 罗雅琪.姜黄素类化合物改善D-gal联合三氯化铝所致小鼠大腦β淀粉样蛋白沉积的机理研究[D].泸州:西南医科大学,2018.
[ 6 ] 郑敏,将裕芸,周畅,等.人参皂苷对衰老大鼠学习记忆和脑单胺类神经递质的影响[J].宜春学院学报,2013,35(6):68-71.
[ 7 ] FAN YL,XIA JY,JIA DY,et al. Mechanism of ginsenoside Rg1 renal protection in a mouse model of D-galactose induced subacute damage[J]. Pharm Biol,2016,54(9):1815-1821.
[ 8 ] 杨方园.人参二醇组皂苷对LPS导致的小鼠心肌损伤的保护作用[D].长春:吉林大学,2017.
[ 9 ] 吴普述.神农本草经[M].南宁:广西科学技术出版社,2016:31.
[10] 沈亮,徐江,陈士林,等.人参栽培种植体系及研究策略[J].中国中药杂志,2015,40(17):3367-3373.
[11] 王瑞,董林林,徐江,等.农田栽参模式中人参根腐病原菌鉴定与防治[J].中国中药杂志,2016,41(10):1787-1791.
[12] 陈俞宇,隋华,张莉,等.服用人参导致“上火”的研究综述[J].世界科学技术:中医药现代化,2018,20(4):597- 602.
[13] 王维.益气活血法在肺纤维化疾病中的应用及中药实验研究[D].济南:山东中医药大学,2018.
[14] WU DM,LU J,ZHENG YL,et al. Purple sweet potato color repairs D-galactose-induced spatial learning and memory impairment by regulating the expression of synaptic proteins[J]. Neurobiol Learn Mem,2008,90(1):19-27.
[15] LEI M,HUA XD,XIAO M,et al. Impairments of astrocytes are involved in the D-galactose-induced brain aging[J]. Biochem Biophs Res Commun,2008,369(4):1082-1087.
[16] 周意,栾洁,蒋静娴,等.玛咖多糖对D-半乳糖衰老模型小鼠免疫器官的保护作用[J].中国实验方剂学杂志,2016,22(19):121-125.
[17] 王雪,修成奎,杨静,等.人参-三七-川芎提取物对高糖高脂诱导血管内皮细胞衰老的影响[J].中国实验方剂学杂志,2019,25(1):124-129.
[18] 王强,修成奎,雷燕,等.白藜芦醇延缓心肌微血管内皮细胞衰老的作用机制[J].中国实验方剂学杂志,2018,24(19):145-152.
[19] 李攀登,王永红,肖芸,等.氢醌对人白血病细胞凋亡及相关蛋白Bcl-2、Bax及Caspase-3表达的影响[J].现代预防医学,2018,45(5):878-882.
[20] 梁凯,曹秉振.线粒体调控的细胞凋亡研究进展[J].生物医学工程与临床,2014,18(5):501-505.
[21] 汤井源,蒋旭平,秦志强,等.小鼠邻苯二甲酸二丁酯染毒模型建立及莱菔硫烷保护作用的探索[J].南京医科大学学报(自然科学版),2018,38(5):595-599.
[22] 齐献忠,邢英瀛,秦慧兵.过表达SHC3激活AKT/Nrf2/GSH 通路保护帕金森病氧化应激损伤[J].中国老年学杂志,2019,39(17):4333-4337.
[23] 朱羽婷,朱向阳,周永,等.氧化应激与帕金森病[J].中国实用神经疾病杂志,2019,22(11):1271-1276.
[24] 叶任之,张铃,蔡巧燕,等.基于p38 MAPK/Nrf2/HO-1通路探讨清达颗粒对脂多糖诱导活化的小胶质细胞抗氧化作用研究[J].中西医结合心脑血管病杂志,2020,18(11):1700-1706.
[25] 曹玲娟,龚慧,颜苗,等. Nrf2-ARE信号通路参与肝脏疾病病理机制研究进展[J].中国药理学通报,2015,31(8):1057-1061.
[26] 蔡靓. 3,4-二羟基苯甲酸甲酯抗SH-SY5Y细胞氧化损伤作用作及机制[D].广州:暨南大学,2015.
(收稿日期:2020-09-10 修回日期:2020-11-09)
(编辑:邹丽娟)

