黄芪地上、地下部分对免疫低下模型小鼠保护作用的比较研究
韩宪忠 沈正泽 袁文霄 黄英如 丁家昱
摘 要 目的:比較黄芪地上、地下部分对免疫低下模型小鼠的保护作用差异,为黄芪资源的进一步开发利用提供参考。方法:取240只ICR小鼠平行分为4批,每批60只,雌雄各半。各批小鼠均按体质量及性别随机分为空白组、模型组和黄芪地上、地下部分低、高剂量组(均为3、6 g/kg,以生药量计),每组10 只。空白组和模型组小鼠均灌胃生理盐水,黄芪组小鼠灌胃相应浓度的药物,灌胃体积均10 mL/kg,每日1次,连续给药30 d。除空白组外,其余各组小鼠均自给药第24天起腹腔注射环磷酰胺40 mg/(kg·d),连续注射3 d,建立免疫低下模型。检测各组小鼠的血清免疫球蛋白(IgG、IgM、IgA)、炎症因子[一氧化氮、白细胞介素2(IL-2)、IL-6、肿瘤坏死因子α]和半数溶血值,测定小鼠体质量、胸腺指数、脾指数、吞噬指数、自然杀伤(NK)细胞活性、脾淋巴细胞增殖能力、二硝基氟苯诱导的小鼠迟发型变态反应(以左右两耳的质量差反映)和溶血空斑数。结果:与空白组比较,模型组小鼠血清中免疫球蛋白水平、体质量、胸腺指数、脾指数、吞噬指数、NK细胞活性、脾淋巴细胞增殖能力、溶血空斑数、半数溶血值均显著降低(P<0.05),炎症因子水平、左右耳片质量差显著升高(P<0.05);与模型组比较,黄芪各给药组小鼠的上述指标均显著改善,且均具有一定的剂量依赖性(P<0.05);与黄芪地下部分组比较,黄芪地上部分同剂量组的上述指标的改善更为明显(P<0.05)。结论:黄芪地上、低下部分对免疫低下模型小鼠均具有一定的保护作用,且地上部分的作用优于地下部分。
关键词 黄芪;地上部分;地下部分;免疫力;药效学
ABSTRACT OBJECTIVE: To compare the protective effects model mice between the aboveground and underground parts of Astragalus membranaceus on immunosuppression, and to provide reference for further utilization and development of A. membranaceus. METHODS: A total of 240 ICR mice were divided into 4 batches, 60 mice in each batch, with half male and half female. Each batch of mice were randomly divided into blank group, model group, A. membranaceus aboveground part and undergroud part low-dose and high-dose groups (3, 6 g/kg, by crude drug) according to body weight and sex, with 10 mice in each group. Blank group and model group were given normal saline intragastrically. A. Membranaceus groups were given corresponding concentration of drug intragastrically, 10 mL/kg, once a day, for consecutive 30 days. Except for blank group, other groups were intraperitoneally injected with cyclophosphamide 40 mg/(kg·d) for consecutive 3 days, since 24th day of treatment, to establish immunosuppression model. The levels of serum immunoglobulin (IgG, IgM, IgA), inflammation factors [nitric oxide, interleukin-2 (IL-2), IL-6, tumor necrosis factor-α] and half hemolysis value were detected in each group. Body weight, thymus index, spleen index, phagocytic index, activity of natural killer (NK)cell, splenic lymphocyte proliferation ability, dinitrofluorobenzene-induced delayed metamorphosis reaction in mice (by weight difference between left and right ears) and the number of hemolytic plaque were determined. RESULTS: Compared with blank group, the serum levels of immunoglobulin, body weight, thymus index, spleen index, phagocytic index, NK cell activity, the proliferation ability of splenic lymphocyte, the number of hemdytic plaque and half hemolysis value were decreased significantly in model group (P<0.05), while inflammation factor level as well as weight difference between left and right ears were increased significantly (P<0.05). Compared with model group, above indexes of mice in A. membranaceus groups were improved significantly, in dose-dependent manner (P<0.05). Compared with A. membranaceus undergroud part group, above indexes of A. membranaceus aboveground part group were improved significantly (P<0.05). CONCLUSIONS: Aboveground and underground part of A. membranaceus both have pretective effect on immunosuppression model mice, and the effect of aboveground part of A. membranaceus is stronger than underground part of A. membranaceus.
KEYWORDS Astragalus membranaceus; Aboveground part; Underground part; Immunity; Pharmacodynamics
黄芪是豆科植物蒙古黄芪Astragalus membranaceus(Fisch.)Bge. var. Mongholicus(Bge.)Hsiao或膜荚黄芪Astragalus membranaceus(Fisch.)Bge.的干燥根,富含多糖类、皂苷类、生物碱类和黄酮类等多种化合物[1],具有补气升阳、固表止汗和利水消肿等功效[2-3]。现代药理研究表明,黄芪具有明显的免疫调节、抗肿瘤、抗氧化等药理活性,临床应用广泛,需求量较大[4]。相关研究显示,黄芪地上部分与地下部分的营养成分相似,均含有多糖类、皂苷类、生物碱类和黄酮类化合物[5],并且地上部分中黄酮类、皂苷类和多糖类成分的含量均高于地下部分[6-8],这提示黄芪地上部分也可能具有与地下部分相似的药理活性,具有一定的开发利用价值。鉴于此,本研究以黄芪为考察对象,比较其地上、地下部分增强免疫力的药效学差异,以期为黄芪药用植物的全面开发利用提供参考。
1 材料
1.1 仪器
AU5800全自动生化仪(美国Beckman公司);BB150型CO2培养箱(美国Thermo Fisher Scientific公司);Infinite M200PRO型全自动酶标仪(瑞士Tecan公司);BSA224S型万分之一分析天平(德国Sartorius公司);Stemi 508型倒置显微镜(德国Zeiss公司);BPZ-LC型真空干燥箱(上海一恒科学仪器有限公司)。
1.2 药品与试剂
1年生黄芪于2018年5月采摘自陕西秦岭山区,经重庆医科大学中医药学院王刚教授鉴定为豆科植物蒙古黄芪A. membranaceus(Fisch.)Bge. var. Mongholicus(Bge.)Hsiao的干燥全草,地上部分(株高80 cm,羽状复叶、叶片长8 cm,无花)和地下部分各2 kg。注射用环磷酰胺(江苏恒瑞医药股份有限公司,批号:18061214,规格:0.2 g/瓶);胎牛血清(澳洲Cellmax公司);DMEM培养基、刀豆蛋白试剂、Hanks液、RPMI 1640培养基、青霉素-链霉素双抗、姬姆萨染液(北京普博欣生物科技有限责任公司);一氧化氮(NO)、白细胞介素2(IL-2)、IL-6、肿瘤坏死因子α(TNF-α)和血清免疫球蛋白G(IgG)、IgM、IgA酶联免疫吸附测定(ELISA)试剂盒(南京建成生物工程研究所,批号:20180102、20180402、20180502、20180503、20180310、20180305、20180301);RIPA裂解液(上海雅酶生物科技有限公司);SA缓冲液(上海联硕生物科技有限公司);2%绵羊红细胞悬液(北京博尔西科技有限公司,批号:180601);琼脂培养基(北京伊塔生物科技有限公司,批号:180403);L(+)-乳酸(百奥莱博科技有限公司,批号:18001);豚鼠血清(北京伊塔生物科技有限公司,批号:20180401);都氏试剂(焦作路非凡生物科技有限公司,批号:18024);其余试剂均为分析纯,水为自制蒸馏水。
1.3 动物
SPF级ICR小鼠240只,雌雄各半,体质量18~22 g,购自重庆医科大学实验动物中心,实验动物使用许可证号:SYXK(渝)2018-0003,适应性饲养7 d后进行实验。饲养环境温度为20~22 ℃、相对湿度为30%~70%、明(12 h)/暗(12 h)周期交替。本实验设计遵循3R原则。
1.4 细胞
小鼠淋巴瘤细胞YAC-1由中国医学科学院医药生物技术研究所提供。
2 方法
2.1 药液的制备
将黄芪地上、地下部分分别经40 ℃真空干燥至恒定质量,然后分别加5倍量(mL/g)水进行煎煮,每次煎煮1 h,共3次。分别合并两者的3次水煎液并浓缩为10 g/mL(以生药量计)的药液,备用。
2.2 分组、造模与给药
将240只小鼠分为4批,每批60只,雌雄各半。将4批小鼠分别按照性别和体质量随机分为6组:空白组、模型组和黄芪地上、地下部分的低、高剂量组[剂量均为3、6 g/kg(均以生药量计);黄芪的临床建议用量为9~30 g[3],相当于小鼠的日用量1.8~6 g/kg(以生药量计),笔者结合上述临床用量换算结果和前期预实验结果将黄芪给药组的低、高剂量分别设置为3、6 g/kg],每组10只。空白组和模型组小鼠灌胃生理盐水,给药组小鼠分别灌胃相应浓度的药物,灌胃体积均10 mL/kg;每日1次,连续给药30 d。除空白组外,其余各组小鼠均自给药第24 天起腹腔注射环磷酰胺40 mg/(kg·d),每天1次,连续注射3 d,建立免疫低下模型[9]。若小鼠存在严重脱毛、食欲下降、精神不振、脾脏萎缩、肝脏发白、胸腺受损等情况,表明免疫低下模型建立成功[9]。
2.3 小鼠血清中Ig、炎症因子和溶血素水平检测
末次给药后1 h,取第1批小鼠,自右眼内眦静脉取血约1.0 mL,转移至EP离心管中,以5 000 r/min离心5 min,收集血清,备用。按照相应试剂盒说明书操作,分别检测血清中Ig(IgM、IgG、IgA)和炎症因子(NO、IL-2、IL-6、TNF-α)的水平。另取血清0.1 mL,以生理盐水稀释200倍,然后取稀释后的血清1.0 mL、4%绵羊红细胞悬液0.5 mL、10%豚鼠血清1.0 mL,置于同一试管中,并以等体积生理盐水替代血清作为对照,分别于37 ℃水浴0.5 h,取出后冰浴终止反应。取上清液1.0 mL,加都氏试剂3 mL,采用分光光度法测定各管在540 nm波长处的光密度(OD)值。另取4%绵羊红细胞悬液0.25 mL、都氏液3.75 mL于同一試管中,测定绵羊红细胞悬液的半数溶血值,然后按公式计算样品的半数溶血值(半数溶血值=血清样品的OD值×200/羊红细胞悬液半数溶血时的OD值)[10],以半数溶血值来反映血清溶血素水平。
2.4 小鼠免疫器官脏器指数和吞噬指数检测
取“2.3”项下取血后的小鼠,称定其体质量,并在末次给药后12 h(期间禁食不禁水),经小鼠左眼内眦静脉注入稀释4倍的印度墨汁(0.1 mL/10 g),立即计时。在注入墨汁后的第2、10 min时,分别从小鼠右眼内眦取血约1.0 mL,以5 000 r/min离心5 min,收集血清。取血清20 μL,加入0.1%碳酸钠溶液2 mL,作为待测样品溶液。以0.1%碳酸钠溶液为空白对照进行调零,采用全自动生化仪检测各样品在600 nm波长处的OD值。随后将小鼠安乐处死,于无菌条件下取出其肝、脾和胸腺组织,称定质量,计算其免疫器官(胸腺、脾)脏器指数、吞噬指数:脏器(胸腺、脾)指数=脏器(胸腺、脾)质量(g)/体质量(g)×100%;吞噬指数=[0.125×(lgOD2 min-lgOD10 min)]/3×体质量×(肝质量+脾质量)[11]。
2.5 小鼠脾组织中自然杀伤(NK)细胞活性检测
靶细胞制备:取YAC-1细胞在37 ℃、5%CO2培养箱中培养24 h,然后以1 000 r/min离心5 min,收集细胞沉淀,采用RPMI 1640培养基将其重悬,并调整细胞密度为5×105个/mL。效应细胞制备:取第2批小鼠,在末次给药后12 h(期间禁食不禁水),将其安乐处死,于无菌条件下取出其脾组织,用眼科剪将脾组织剪碎,然后以1 000 r/min离心5 min,收集组织沉淀;采用RIPA裂解液将组织裂解,并以Hanks液将其制成细胞密度为2×107个/mL的脾细胞悬液,在37 ℃、5%CO2培养箱中培养;取生长良好的脾细胞(传代4~6代),用新鲜配制的DMEM培养基调整细胞密度为4×105个/mL,作为效应细胞。效应细胞-靶细胞相互作用:取靶细胞和效应细胞悬液各100 μL,加至96孔培养板中,将细胞分为靶细胞自然释放组(含靶细胞悬液100 μL和效应细胞悬液100 μL)和靶细胞自然释放组(含靶细胞悬液100 μL、效应细胞悬液100 μL和1%的乙基苯基聚乙二醇),并设置无靶细胞悬液和效应细胞悬液(只含1%乙基苯基聚乙二醇)的对照组,每组均设3个复孔。将所有组别培养液均置于37 ℃、5%CO2培养箱中培养4 h后,取出,然后以1 500 r/min离心10 min,每孔吸取上清液100 μL,置于96孔板中,加乳酸基质液100 μL,室温孵育10 min后,每孔加入1 mol/L盐酸溶液30 μL,混匀。采用酶标仪测定各孔在490 nm波长处的OD值,计算NK细胞活性:NK细胞活性=(对照组OD值-靶细胞自然释放组OD值)/(靶细胞自然释放孔OD值-靶细胞自然释放孔OD值)×100%。
2.6 小鼠脾淋巴细胞增殖能力检测
取“2.5”项下细胞密度为 2×107个/mL的小鼠脾细胞悬液,以1 000 r/min离心15 min,收集沉淀,采用RPMI 1640培养基将细胞重悬并调整密度为3×106个/mL。将重悬的细胞悬液加至24孔培养板中(1 mL/孔),每组均设置两孔:其中一孔加入刀豆蛋白试液75 μL,作为刀豆蛋白诱导孔;另一孔加入含青霉素-链霉素双抗(100 U/mL)和10%胎牛血清的RPMI 1640培养基75 μL,作为对照孔。将细胞置于37 ℃、5%CO2培养箱中培养3 d。吸弃上清液,加入不含血清和青霉素-链霉素双抗的RPMI 1640培养基0.7 mL和5 mg/mL四氮唑盐试液50 μL,继续在37 ℃、5%CO2培养箱中培养4 h。取出后,采用酶标仪测定各孔在570 nm波长处的OD值,计算各组细胞刀豆蛋白诱导孔OD值与对照孔OD值的差值,差值越大表示小鼠脾淋巴细胞的增殖能力越强[12]。
2.7 二硝基氟苯诱导的小鼠迟发型变态反应检测
取第3批小鼠,在第22 天给药后1 h,脱去小鼠腹部的毛(面积为3 cm×3 cm),用1%二硝基氟苯溶液均匀涂抹于脱毛部位使其致敏;7 d后,将1%二硝基氟苯溶液均匀涂抹于小鼠右耳(两面)进行攻击;24 h后,将小鼠安乐处死,剪下其左、右两耳,用打孔器在两耳相同位置处打孔取直径为8 mm耳片,称定质量,并计算左、右两耳的质量差异,两耳质量差异越大提示小鼠的迟发型变态反应越明显[13]。
2.8 小鼠脾细胞抗体生成细胞数检测
取第4批小鼠,在第23天给药后1 h,腹腔注射2%绵羊红细胞悬液0.2 mL进行免疫;7 d后,自右眼内眦静脉采用约1.0 mL,转移至EP离心管中,以5 000 r/min离心5 min,分离血清。然后将小鼠安乐处死,无菌取出其脾组织,用眼科剪将脾组织剪碎,以1 000 r/min离心5 min,弃上清液,采用RIPA裂解液将组织裂解,并以Hanks液将其制成细胞密度为 2×107个/mL的脾细胞悬液。以Jerne改良玻片法检测各组脾细胞抗体生成细胞数:将1%琼脂培养基加热溶解,37 ℃水浴保温,然后加入 Hank s液1.0 mL混合,分装至小试管,每管0.5 mL;每管中加入10%绵羊红细胞50 μL、脾细胞悬液25 μL,混匀,倾倒于已薄刷琼脂培养基的玻片上,待琼脂凝固后,在37 ℃、5%CO2培养箱中培养1.5 h,加入SA缓冲液稀释的补体[即1 ∶ 30(V/V)稀释的新鲜豚鼠血清,临用临配]至玻片架凹槽内孵育1.5 h,将玻片对着光亮处,用放大镜观察每个溶血空斑的溶血状况,并记录玻片中的空斑数,计算每百万个脾细胞内含空斑形成细胞的平均数,即以溶血空斑数/106个脾细胞数表示抗体生成细胞数[14]。
2.9 统计学方法
采用SPSS 22.0軟件对数据进行统计分析。计量资料若符合正态分布则以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用SNK检验。P<0.05为差异具有统计学意义。
3 结果
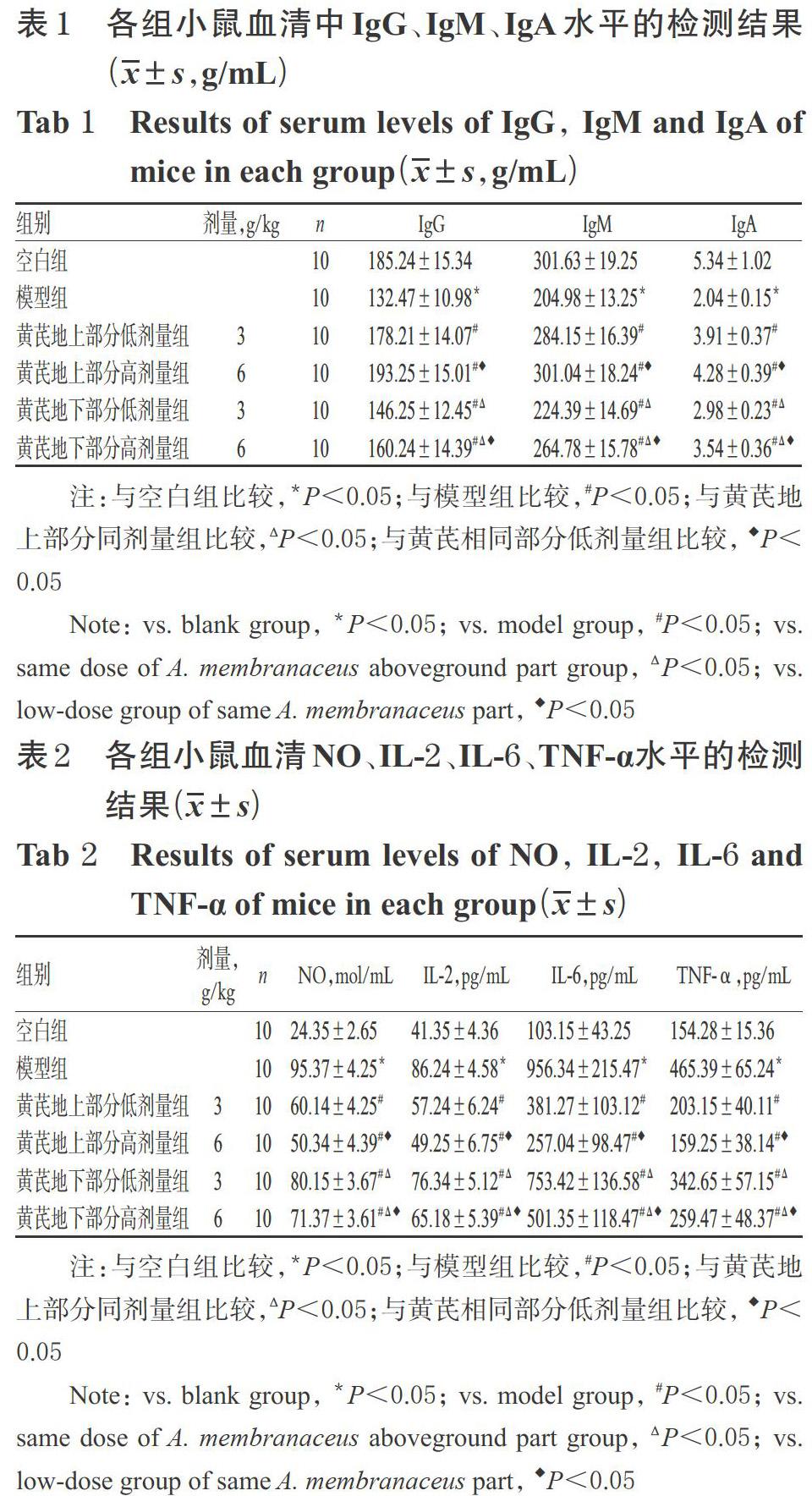
3.1 黄芪地上、地下部分对免疫低下模型小鼠血清中IgG、IgM、IgA水平的影响
与空白组比较,模型组小鼠血清中IgG、IgM、IgA水平均显著降低(P<0.05);与模型组比较,黄芪各给药组小鼠血清中IgG、IgM、IgA水平均显著升高,且均具有一定的剂量依赖性(P<0.05);与黄芪地下部分组比较,黄芪地上部分同剂量组小鼠血清中IgG、IgM、IgA水平均显著升高(P<0.05)。各组小鼠血清中IgG、IgM、IgA水平的检测结果见表1。
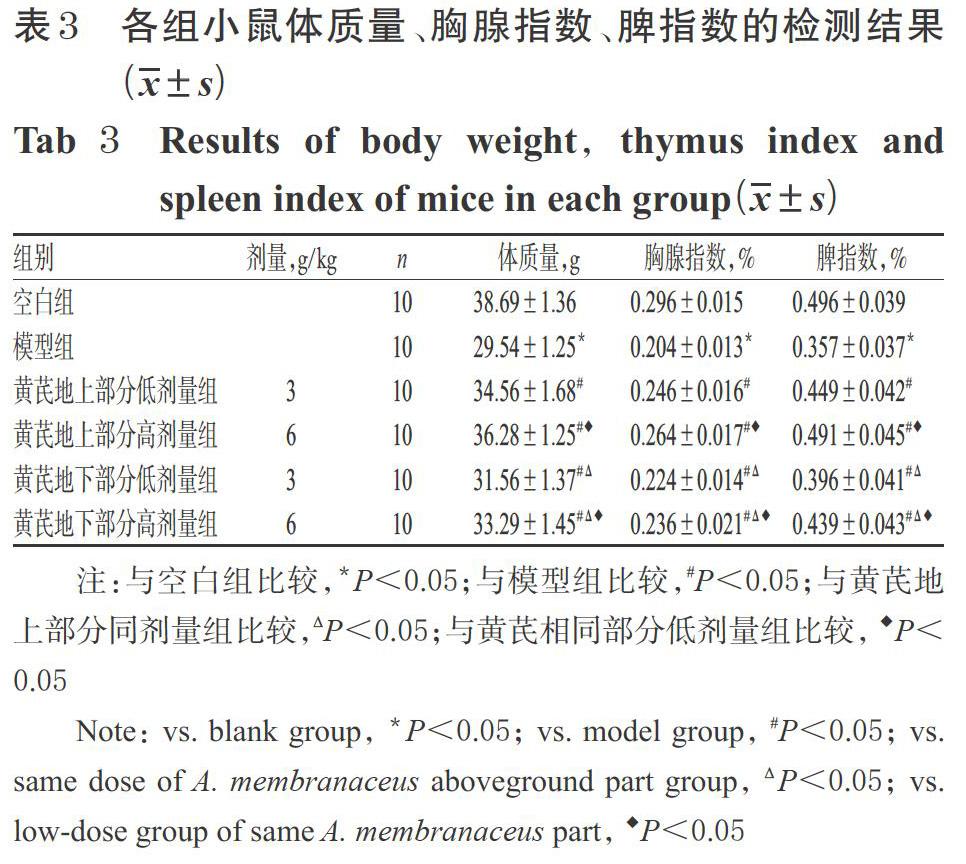
3.2 黄芪地上、地下部分对免疫低下模型小鼠血清中NO、IL-2、IL-6、TNF-α水平的影响
与空白组比较,模型组小鼠血清中NO、IL-2、IL-6、TNF-α水平均显著升高(P<0.05);与模型组比较,黄芪各给药组小鼠血清中NO、IL-2、IL-6、TNF-α水平均显著降低,且均具有一定的剂量依赖性(P<0.05);与黄芪地下部分组比较,黄芪地上部分同剂量组小鼠血清中NO、IL-2、IL-6、TNF-α水平均显著降低(P<0.05)。各组小鼠血清中NO、IL-2、IL-6、TNF-α水平的检测结果见表2。
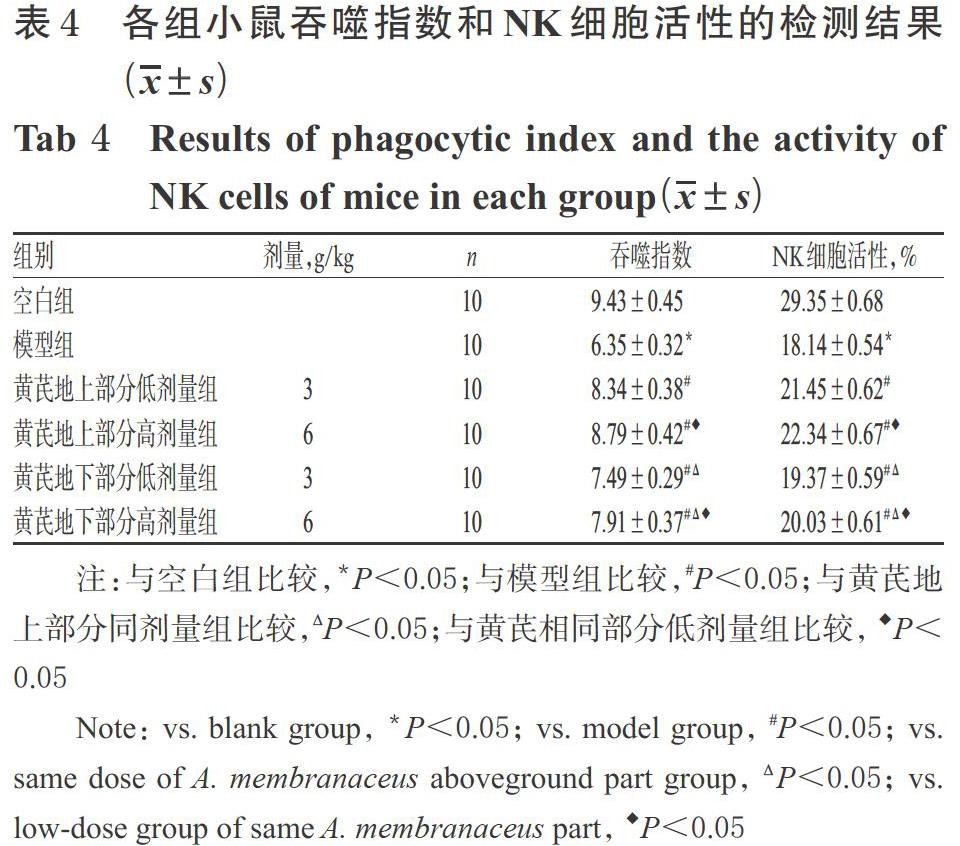
3.3 黄芪地上、地下部分对免疫低下模型小鼠体质量、免疫器官脏器指数的影响
免疫低下模型小鼠存在严重脱毛、食欲下降及精神不振等症状,所有组别小鼠初始体质量比较差异均无统计学意义(P>0.05)。与空白组比较,模型组小鼠体质量和胸腺指数、脾指数均显著降低(P<0.05);与模型组比较,黄芪各给药组小鼠体质量、胸腺指数、脾指数均显著升高,且均具有一定的剂量依赖性(P<0.05);与黄芪地下部分组比较,黄芪地上部分同剂量组小鼠体质量和胸腺指数、脾指数均显著升高(P<0.05)。各组小鼠体质量、胸腺指数、脾指数的检测结果见表3。
3.4 黄芪地上、地下部分对免疫低下模型小鼠吞噬指数和NK细胞活性的影响
与空白组比较,模型组小鼠吞噬指数、NK细胞活性显著降低(P<0.05);与模型组比较,黄芪各给药组小鼠的吞噬指数、NK细胞活性均显著升高,且均具有一定的剂量依赖性(P<0.05);与黄芪地下部分组比较,黄芪地上部分同剂量组小鼠的吞噬指数、NK细胞活性均显著升高(P<0.05)。各组小鼠吞噬指数和NK细胞活性的检测结果见表4。
3.5 黄芪地上、地下部分对免疫低下模型小鼠脾淋巴细胞增殖、左右耳片质量差、溶血空斑数和半数溶血值的影响
与空白组比较,模型组小鼠的脾淋巴细胞增殖能力、溶血空斑数和半数溶血值均显著降低(P<0.05),左右耳片质量差均显著升高(P<0.05);与模型组比较,黄芪各给药组小鼠的脾淋巴细胞增殖能力、溶血空斑数和半数溶血值均显著升高(P<0.05),左右耳片质量差均显著降低(P<0.05),且均具有一定的剂量依赖性(P<0.05);与黄芪地下部分组比较,黄芪地上部分同剂量组小鼠的脾淋巴细胞增殖能力、溶血空斑数和半数溶血值均显著升高(P<0.05),左右耳片质量差均显著降低(P<0.05)。各组小鼠淋巴细胞增殖能力、左右耳片质量差、溶血空斑数和半数溶血值检测结果见表5。
4 讨论
IgG、IgM、IgA是临床常用于评估人体免疫功能的指标。其中,IgG可中和病毒及毒素;IgM为抗原刺激体液免疫应答反应后最早生成的生物抗体,其水平越高,表示机体的免疫能力越强;IgA可抑制致病菌附着,为黏膜提供了屏障作用[15]。胸腺是机体受抗原刺激后发生免疫应答的部位,是细胞发育成熟的场所;脾具有非特异性和特异性免疫功能,含有大量的NK细胞和淋巴细胞。胸腺指数、脾指数、吞噬指数、NK细胞活性、淋巴细胞增殖能力均可较好地反映免疫器官的发育程度和免疫细胞的功能[16]。NO、IL-2、IL-6、TNF-α均是与炎症相关的因子。其中,IL-6、TNF-α是由单核巨噬细胞产生的促炎因子,当机体感染或免疫降低时,其水平增高,严重时可引起组织或器官损伤;IL-2可调控白细胞活性,诱导多种杀伤细胞分化,也可诱导TNF-α产生,阻断或抑制NO表达,抑制炎症反应的级联扩大[17]。溶血空斑数和半数溶血值是衡量机体非特异性免疫功能的重要指标,上述指标在维持机体内环境稳定中具有重要意义[18]。
本研究结果显示,与模型组比较,黄芪各给药组小鼠的Ig(IgG、IgM、IgA)水平、体质量、胸腺指数、脾指数、吞噬指数、NK细胞活性、脾淋巴细胞增殖能力、溶血空斑数和半数溶血值均显著升高,炎症因子(NO、IL-2、IL-6、TNF-α)水平、左右耳片质量差均显著降低,这提示黄芪地上部分和地下部分均可明显增强免疫低下模型小鼠的免疫力,且具有一定的量-效关系。該结果与文献报道类似[19-21]。进一步分析后发现,黄芪地上部分增强免疫力的作用较地下部分更优,该结果与Park YC等[22]的报道相似。对于此结果,笔者分析可能的原因如下:(1)黄芪地下部分和地上部分的有效成分虽然基本一致,但地上部分中黄酮类、皂苷类和多糖类成分的含量均高于地下部分[5-8];(2)采摘时间差异可能与药效差异有关,临床使用的黄芪多是生长4~5年、春季萌芽前或秋季落叶后采挖的根,而本研究的黄芪是1年生,可能会影响药效。
综上,本研究发现黄芪地上、地下部分均具有增强免疫力的作用,且地上部分的作用较地下部分更强,这提示其黄芪地上部分具有进一步研究、开发利用的价值。但本研究仍存在许多不足之处:(1)未考察种植年份与药效的关系,后续有必要动态考察更长年份黄芪地上、地下部分的药效学差异;(2)黄芪药材的质量除受到生长年限的影响外,还与产地、物种、生态环境和种植方式等因素有关,而本研究并未考察上述因素,故后续仍需纳入其他因素考察1年生黄芪地上和地下部分药效差异的可能原因;(3)本研究仅考察和比较了1年生黄芪地上、地下部分的药效,而多年生黄芪地上、地下部分的药效学差异仍需进一步深入研究。
参考文献
[ 1 ] XIE G,PENG W,LI P,et al. A network pharmacology analysis to explore the effect of Astragali Radix-Radix Angelica Sinensis on traumatic brain injury[J]. Biomed Res Int,2018. DOI:10.1155/2018/3951783.
[ 2 ] SHAHZAD M,SHABBIR A,WOJCIKOWSKI K,et al.The antioxidant effects of Radix Astragali (Astragalus membranaceus and related species)in protecting tissues from injury and disease[J]. Curr Drug Targets,2016,17(12):1331-1340.
[ 3 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2015年版.北京:中国医药科技出版社,2015:302-306.
[ 4 ] LI W,SONG K,WANG S,et al. Anti-tumor potential of astragalus polysaccharides on breast cancer cell line mediated by macrophage activation[J]. Mater Sci Eng C Mater Biol Appl,2019,98(5):685-695.
[ 5 ] 谢新然,曲婷丽,许晋芳,等.黄芪地上、地下部分化学成分以及药效学比较[J].光明中医,2016,31(15):2188- 2192.
[ 6 ] 李倩,徐珍,刘亮亮,等.浑源黄芪:地上部分和地下部分的主要有效成分比较研究[J].临床医药实践,2018,27(2):121-124.
[ 7 ] 徐珍,李倩,刘亮亮,等.浑源黄芪地上部分与地下部分中黄酮类成分比较[J].山西中医学院学报,2017,18(6):27-30.
[ 8 ] 常思勤,李元静,山如娇,等.蒙古黄芪地下部分与地上部分药理活性比较[J].天津药学,1990,2(4):20-24.
[ 9 ] LI S,WANG XF,REN LN,et al. Protective effects of γ- irradiated Astragalus polysaccharides on intestinal development and mucosal immune function of immunosuppressed broilers[J]. Poult Sci,2019,98(12):6400-6410.
[10] 雷林生,孙莉莎,杨淑琴.有限稀释微量溶血法测定小鼠血清溶血素的活性[J].中国药理学通报,1999,14(3):3-5.
[11] LI W,HU X, WANG S,et al. Characterization and anti- turner bioactivity of astragalus polysaccharides by immunomodulation[J]. Int J Biol Macromel,2020,145(2):985-997.
[12] LIU H,LI JX,TIAN JL,et al. Selective effects of fenitrothion on murine splenic T-lymphocyte populations and cytokine/granzyme production[J]. J Environ Sci Health B,2018,53(5):319-326.
[13] STRICKLAND FM,SUN Y,DARVILL A,et al. Preservation of the delayed-type hypersensitivity response to alloantigen by xyloglucans or oligogalacturonide does not correlate with the capacity to reject ultraviolet-induced skin tumors in mice[J]. J Invest Dermatol,2001,116(1):62-68.
[14] HNASKO RM,STANKER LH.Hybridoma technology[J].Methods Mol Biol,2015. DOI:10.1007/978-1-4939-2742- 5_2.
[15] PARKER AR,PARK MA,HARDING S,et al. The total IgM,IgA and IgG antibody responses to pneumococcal polysaccharide vaccination(Pneumovax?23)in a healthy adult population and patients diagnosed with primary immunodeficiencies[J]. Vaccine,2019,37(10):1350-1355.
[16] 文涛,王文思,杨鸿武,等.林下山参冻干粉对小鼠的免疫调节作用[J].中国卫生检验杂志,2019,29(18):2181- 2184.
[17] SUSHAMA S,DIXIT N,GAUTAM RK,et al. Cytokine profile(IL-2,IL-6,IL-17,IL-22,and TNF-α)in vitiligo- new insight into pathogenesis of disease[J]. J Cosmet Dermatol,2019,18(1):337-341.
[18] 金伟,雷林.石斛灵芝口服液增强小鼠免疫功能的研究[J].预防医学,2019,31(5):456-459.
[19] 薛剑,白燕.不同粒度黄芪茎叶粉对蛋用公雏鸡生长及免疫功能的影响[J].粮食與饲料工业,2014,43(6):61-63.
[20] LIU M,LI P,ZENG X,et al. Identification and pharmacokinetics of multiple potential bioactive constituents after oral administration of radix astragali on cyclophosphamide-induced immunosuppression in Balb/c mice[J]. Int J Mol Sci,2015,16(3):5047-5071.
[21] QU T,LI Z,ZHAO S,et al. A metabonomic analysis reveals novel regulatory mechanism of Huangqi injection on leucopenia mice[J]. Immunopharmacol Immunotoxicol,2016,38(2):113-123.
[22] PARK YC,KIM MH,KIM JW,et al. Genotoxicity Study of polysaccharide fraction from Astragalus membranaceuss aerial parts[J]. Toxicol Res,2014,30(2):131-138.
(收稿日期:2020-08-18 修回日期:2020-11-21)
(编辑:林 静)

