骨钙素在2型糖尿病合并骨代谢异常患者中的表达水平*
关清华,旷劲松△,程 岚,马小羽
1.辽宁省沈阳市第四人民医院内分泌科,辽宁沈阳 110031;2.中国医科大学附属第一医院老年内分泌科,辽宁沈阳 110001
随着人们生活水平的提高,糖尿病的发病率正逐年升高。2017年的报道显示,我国目前糖尿病的发病率已达10.9%[1]。高血糖不仅损害心、脑、肾、眼睛等重要器官,对骨骼系统也有重要影响。高血糖严重影响骨代谢,可导致成骨细胞功能不全,骨转换率降低,成骨细胞分泌的骨钙素(OC)减少,糖尿病患者骨质疏松及骨折风险明显增加。本研究旨在研究2型糖尿病合并骨代谢异常患者中OC的表达水平,进一步探讨OC在2型糖尿病合并骨代谢异常中的意义。
1 资料与方法
1.1一般资料 选取2017年5月至2018年11月辽宁省沈阳市第四人民医院收治的120例2型糖尿病患者为研究对象。糖尿病的诊断标准符合1999年WHO诊断标准。排除标准:甲状腺、甲状旁腺、肾上腺、性腺及其他内分泌腺引起的骨代谢异常相关疾病;有肝、肾功能异常及恶性肿瘤病史;近1月有严重感染史;近期服用影响骨代谢药物者(双膦酸盐类、维生素D、钙及衍生物、激素、利尿剂、噻唑烷二酮类等);近1年有骨折史;纳入研究时距离闭经不足1年。所有研究对象根据骨密度检查结果分为2型糖尿病合并骨量正常组60例,2型糖尿病合并骨量异常组(骨量减少及骨质疏松者)60例。选择同期体检健康者60例纳入健康对照组。3组间年龄及性别比例比较,差异有统计学意义(P<0.05),见表1,基线资料不齐同,后续研究采用协方差分析以排除年龄及性别对结果的影响。
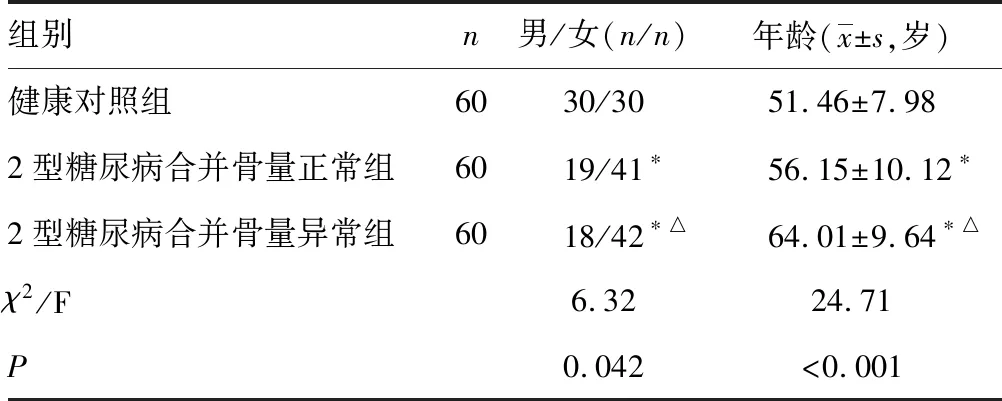
表13组间基本情况的比较
注:与健康对照组比较,*P<0.05 ;与2型糖尿病合并骨量正常组比较,△P<0.05。
1.2方法 采用双能X线骨密度仪检测入选患者股骨颈及腰椎(L1~L4)骨密度。全部受试者均于清晨空腹采集静脉血检测OC、空腹血糖(FPG)、空腹胰岛素(FINS)、糖化血红蛋白(HbA1c)、三酰甘油(TG)、总胆固醇(TC)、血钙(Ca)、血磷(P)、血清碱性磷酸酶(ALP)。应用罗氏全自动电化学发光免疫分析系统采用电化学发光法检测OC,试剂盒购自罗氏诊断产品上海有限公司,产品标准号YZB/GER 5412-2014。同时均常规记录所有研究对象身高、体质量,以及糖尿病患者的糖尿病病史等,并常规计算体质量指数(BMI),进行稳态模型(HOMA)中的胰岛素抵抗指数(HOMA-IR)及胰岛β细胞功能指数(HOMA-β)的计算。HOMA-IR=FPG×FINS/22.5;HOMA-β=20×FINS/(FPG-35)。
2 结 果
2.13组间一般情况比较 2型糖尿病合并骨量异常组体质量、BMI低于健康对照组,差异有统计学意义(P<0.05)。见表2。

表23组间一般资料协方差分析比较
注:与健康对照组比较,*P<0.05;-为无数据。
2.23组间骨代谢指标的比较 与健康对照组比较,2型糖尿病合并骨量异常组及2型糖尿病合并骨量正常组OC水平明显降低,差异有统计学意义(P<0.05)。同时2型糖尿病合并骨量异常组OC水平明显低于2型糖尿病合并骨量正常组,差异有统计学意义(P<0.05)。见表3。
2.33组间其他实验室检测指标的比较 2型糖尿病合并骨量正常组及2型糖尿病合并骨量异常组HbA1c水平高于健康对照组,差异均有统计学意义(P<0.05);同时,2型糖尿病合并骨量异常组HbA1c水平高于2型糖尿病合并骨代谢正常组,差异有统计学意义(P<0.05)。见表4。
2.4相关分析 OC水平与HbA1c及HOMA-IR呈显著负相关(r=-0.67,P=0.004;r=-0.56,P=0.035),与HOMA-β呈显著正相关(r=0.46,P=0.024)。

表33组间骨代谢指标的比较
注:与健康对照组比较,*P<0.05;与2型糖尿病合并骨量正常组比较,△P<0.05。

表43组间其他实验室检测指标的比较
注:与健康对照组比较,*P<0.05;与2型糖尿病合并骨量正常组比较,△P<0.05。
3 讨 论
OC是由成骨细胞特异产生和分泌的一种非胶原骨基质蛋白,又名7-羧基骨蛋白、骨依赖维生素K蛋白和骨谷氨酸蛋白。OC基因首先编码合成骨钙素原,在维生素K依赖羧化酶的作用下其分子结构中的谷氨酸残基羧化成γ-羧基化谷氨酸,具有很强的结合羟基磷灰石的能力。经羧基化而成熟的OC泌出成骨细胞,小部分进入血液循环,大部分沉积在骨基质中,占骨基质非胶原蛋白成分中的25%[2]。在骨溶解及骨吸收时,沉积在骨基质中的OC就会游离出来,释放入血。OC水平的高低可直接反映成骨细胞的活性,是测量骨形成或骨转换的一项特异而敏感的指标。同时,OC还可以促进胰岛素分泌,调节能量代谢,以及改善靶器官胰岛素敏感性[3]。
本研究发现糖尿病患者OC水平较非糖尿病人群低,这可能是由于糖尿病患者体内多伴有胰岛素功能缺陷,导致糖、蛋白质、脂质及微量元素代谢紊乱,使患者体内水、电解质及骨矿化代谢异常。同时,高渗性利尿造成患者体内Ca、P及镁(Mg)大量丢失,从而影响骨代谢,导致骨量减少或骨质疏松[4]。既往有研究发现成骨细胞表达胰岛素受体,在高血糖状态下由于胰岛素分泌及作用缺陷,成骨细胞数量减少,功能也被抑制,从而导致OC合成减少。OC在骨的形成和转换中起重要作用,胰岛素缺乏及高糖状态可能使成骨细胞特异性合成与释放OC的功能受到抑制,导致骨基质成熟与骨转换下降[5]。正是这些机制使2型糖尿病患者更易发生骨代谢异常,严重时发生骨折。本研究同时发现2型糖尿病合并骨量异常组OC水平明显低于2型糖尿病合并骨量正常组(P<0.05)。可见糖尿病患者OC水平的下降在其骨代谢异常发生、发展中起到了重要作用。在糖尿病患者中,胰岛素缺乏和高血糖可引起晚期糖基化终末产物或者晚期糖基化终末产物/晚期糖基化终末产物受体轴失衡,均直接影响成骨细胞活性[6]。可见,高血糖是骨代谢的负性调节因子,可引起成骨细胞的功能失常[7]。高血糖抑制了细胞增殖,使OC分泌减少。血清OC的水平与成骨细胞数量、骨形成速度、新骨形成及老骨的吸收速度有关。高血糖和氧化应激能够负面影响OC的产生;成骨细胞和破骨细胞的活性的失衡通过Wnt信号通路,使骨质量减少,导致骨代谢异常的发生、发展[6]。
相关分析表明,OC水平与HbA1c及HOMA-IR呈显著负相关(P<0.05),与HOMA-β呈显著正相关(P<0.05)。OC水平随着HbA1c及HOMA-IR水平的升高而降低,随着HOMA-β水平的升高而升高。可见,胰岛功能越差,胰岛素抵抗越明显,血糖控制水平越差,OC水平越低,提示高血糖可能影响骨代谢过程,可诱导成骨细胞功能失调而降低骨转换,抑制血清OC水平,这与既往的研究结果一致[8-9]。长期慢性高血糖和高胰岛素血症可能是2型糖尿病患者血清OC水平降低的始发动力。另一方面,在高血糖状态下机体可激活超氧化物歧化酶、葡萄糖氧化酶及蛋白激酶C,进而产生更多的活性氧,而大量活性氧的产生可诱导成骨细胞的凋亡,从而导致OC分泌的减少及骨质疏松的出现[10]。因此,可通过改善胰岛素抵抗,增加胰岛素敏感性,使血糖水平达标,从而延缓OC水平的下降,延缓2型糖尿病患者骨代谢异常的发生、发展。
综上所述,血糖代谢与骨代谢密切相关,2型糖尿病患者易合并骨代谢异常,OC水平的下降可能是其骨代谢异常发生、发展的机制之一,OC可作为2型糖尿病患者骨代谢异常发生、发展的参考因子。未来将进一步探讨如何延缓糖尿病患者体内OC水平的下降,从而延缓糖尿病患者骨代谢异常的发生、发展,OC可能是2型糖尿病合并骨代谢异常药物治疗的新靶点。

