氟西汀对癫痫合并抑郁大鼠海马GFAP、NeuN表达的影响
朱勇 王琴 卢军 黄惠勇 李丰 杨萍
(1湖南省脑科医院神经外科,湖南 长沙 410007;2湖南中医药大学中医诊断学湖南省重点实验室)
目前癫痫-抑郁共病是一种常见的神经精神病学现象,发生率高达23.1%〔1〕。癫痫患者出现过早死亡患者中75.2%合并有抑郁等精神障碍,且自杀风险明显升高〔2〕。因此,探索癫痫合并抑郁症的发病机制,做好防治具有重要意义。氟西汀属于5-羟色胺再摄取抑制剂类抗抑郁药〔3〕,被广泛用于焦虑症、抑郁障碍、强迫症等精神障碍〔4〕;目前已开始被用于癫痫合并抑郁治疗中〔5〕。但有关起效机制探讨甚少,故本研究采用癫痫合并抑郁模型来研究氟西汀对其行为的影响,探索氟西汀对癫痫合并抑郁大鼠模型海马区胶质纤维酸性蛋白(GFAP)、神经元核抗原(NeuN)表达的影响。
1 材料与方法
1.1实验动物及分组 SPF级健康SD雄性大鼠60只,周龄8~10 w,体重180~220 g,由湖南中医药大学动物中心提供,饲养于洁净级环境中,饲养室温度22~25℃,相对湿度50%~70%,换气8~12次/h,光线每隔12 h交替,实验前适应性饲养7 d,自由饮食。随机分为对照组、模型组、氟西汀低、中、高剂量组各12只。
1.2主要试剂及仪器 匹罗卡品(ABCR公司,ab141301),氯化锂(Sigma公司,1001011078),盐酸氟西汀(苏州礼来制药有限公司,201608072)。兔抗鼠GFAP(武汉博士德生物有限公司,PB9082),兔抗鼠NeuN(武汉博士德生物有限公司,BM4354),二抗(北京中杉金桥生物有限公司,pv-9000)。BX43型双目生物摄像显微镜(日本OLYMPUS),荧光定量PCR仪(美国BioRad公司)。
1.3造模 ①参照文献〔6〕进行癫痫造模。氯化锂3 mEq/kg腹腔注射,17.5 h予以阿托品1 mg/kg腹腔注射,30 min后注射匹罗卡品35 mg/kg。10 mg/(kg·次)追加匹罗卡品(注射匹罗卡品后30 min内无惊厥发作),追加4次未出现癫痫持续状态大鼠考虑造模失败,剔除出组。28 d后慢性自发性癫痫形成,癫痫造模成功。②在成功建立癫痫模型后,根据文献诱导慢性不可预见性应激抑郁模型(CMS)〔7〕。CMS方案包括七种不同的应激源,连续14 d应激刺激随机排列如下(每种应激给予3~4次,连续2 d不能出现相同应激):倾斜鼠笼17 h;禁食、禁水20 h;湿笼21 h;禁水17 h;持续光照17 h;电击(30 V电压)足底5 s;夹尾1 min;行为限制2 h;4℃冰水游泳(水深以大鼠的后足尖刚能触及桶底为准)5 min。造模结束后进行行为学测定。
1.4给药方法 氟西汀低、中、高剂量组于造模结束后给予氟西汀干预药(5、7.5、10 mg/kg,1次/d)腹腔注射,对照、模型组同时给予同等量生理盐水,1次/d。药物干预28 d,治疗结束后进行行为学测定。
1.5观察指标
1.5.1行为学检测 ①强迫游泳实验〔8〕:将大鼠放入高为 50 cm、直径为 20 cm 的圆柱形水缸中,水深 40 cm左右,随机选择大鼠,每次观察2只,采用双盲法检测。实验开始后60 s为适应时间,适应结束后记录 5 min内大鼠不动时间。 ②旷场实验〔9〕:将大鼠置于大小为90 cm×90 cm×45 cm(底面等分为25个等边方格)木制箱子的中心方格内,其4只爪子均进入一方格则记录水平运动1次,两前爪腾空或攀附墙壁则记录垂直运动1次,观察大鼠在3 min 内水平运动次数及垂直运动次数。
1.5.2免疫组化 最后一次行为学测定后,每组取6只大鼠,将其麻醉处死,取出大鼠脑组织,进行冠状位切片,厚度约5 μm。经脱蜡、水化后,依次进行抗原修复、内源性过氧化物酶消除、非特异性蛋白封闭、4℃孵育GFAP、NeuN一抗(1∶100)过夜、室温孵育二抗2 h、酶联反应、二氨基联苯胺(DAB)染色、苏木素复染、脱水透明、中性树胶封片,显微镜下观察组织染色情况,细胞呈现棕黄色染色者为阳性。染色强度使用IPP6.0软件分析海马齿状回平均光密度。
1.5.3RT-RCR 最后一次行为学测定后,每组取6只大鼠,将其麻醉处死,在冰上提取出大鼠海马。用Triziol法提取总RNA,用反转录酶将mRNA反转录为cDNA。构建聚合酶体系,Taq酶催化,热循环:95℃预热5 min,40个循环(94℃ 20 s,退火20 s,72℃ 30 s)。将不同浓度标准品的对数值与阈值循环数(Ct)值得出校正曲线;通过2-△△Ct法计算目的基因与内参物(β-actin)Ct值的差值,即目的基因的相对表达水平。GFAP上游引物:5′GACCGCTTTGCTAGCTA 3′,下游引物:5′GGTTTCATCTTGGAGCT 3′;NeuN上游引物:5′CACGGCATGACCCTCTACAC 3′,下游引物:5′ GTCTGTGCTGCTTCATCTGC3′;β-actin上游引物:5′GTCGTACCACTGGCATTGTG 3′,下游引物:5′TCTCAGCTGTGGTGGTGAAG 3′。
1.6统计学方法 采用SPSS24.0软件进行方差分析、LSD-t检验。
2 结 果
2.1各组大鼠行为学变化 造模后,与对照组相比,模型组、氟西汀低、中、高剂量组不动时间明显延长,垂直运动次数、水平运动次数明显下降(P<0.05);干预后,模型组不动时间明显长于对照组,垂直运动次数、水平运动次数明显低于对照组(P<0.01);与模型组相比,氟西汀低、中、高剂量组不动时间明显缩短,垂直运动次数、水平运动次数明显增加(P<0.05);氟西汀高剂量组不动时间缩短,垂直运动次数、水平运动次数增加较氟西汀低、中剂量组更明显(P<0.05)。见表1。
2.2各组大鼠海马齿状回GFAP、NeuN表达 GFAP 染色显示大鼠海马齿状回细胞胞质及突起呈棕黄色。对照组胞质染色较淡;模型组胞质染色呈棕黄色,呈杆状或锥状,突起粗短,且数量增多;氟西汀低、中、高剂量组染色较模型组浅,且数量减少。见图1。NeuN染色显示大鼠海马齿状回细胞质及胞核可以观察到棕黄色或者黄色颗粒。对照组胞质及胞核可见大量棕黄色或者黄色颗粒;模型组胞质及胞核仅可见少量表达;氟西汀低、中、高剂量组阳性表达较模型组有所增加,尤其氟西汀高剂量组表达更为明显。见图2。与对照组相比,模型组GFAP表达明显增加、NeuN表达明显下降(P<0.05);与模型组相比,氟西汀低、中、高剂量组GFAP表达明显下降、NeuN表达明显增加(P<0.05);氟西汀高剂量组GFAP表达下降、NeuN表达增加较氟西汀低、中剂量组更明显(P<0.05)。见表2。
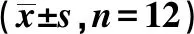
表1 各组大鼠造模后及干预后行为学比较
与对照组比较:1)P<0.05;与模型组比较:2)P<0.05;与氟西汀高剂量组比较:3)P<0.05,下表同

图1 各组海马齿状回GFAP染色(DAB,×200)
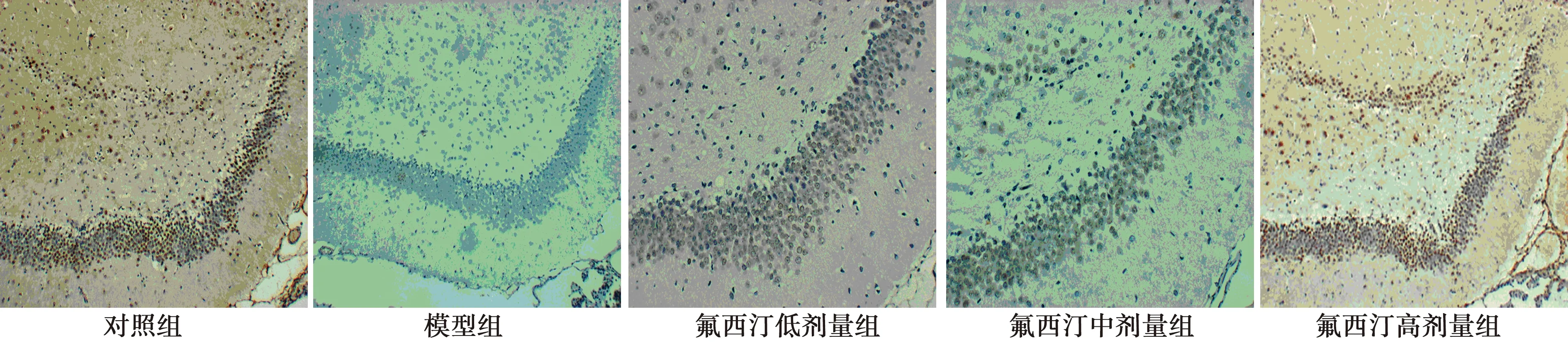
图2 各组海马齿状回NeuN染色(DAB,×200)

表2 各组大鼠海马齿状回GFAP、NeuN表达
2.3各组大鼠海马齿状回GFAP、NeuN mRNA表达水平的比较 模型组GFAP mRNA表达明显高于对照组,NeuN mRNA表达明显低于对照组(P<0.05);氟西汀低、中、高组GFAP mRNA表达均明显低于模型组,NeuN mRNA表达明显高于模型组(P<0.05),尤其是氟西汀高剂量组,与氟西汀低、中剂量组相比有统计学意义(P<0.05)。见表3。

表3 各组大鼠海马齿状回GFAP、NeuN mRNA表达
3 讨 论
癫痫合并抑郁的发生率比普通人群高5~7倍,尤其在长期发作不能控制难治性癫痫患者中抑郁的发生率更高〔10〕。近年来随着神经调控技术发展,癫痫的治疗疗效显著提高,但并发精神障碍仍然是导致癫痫患者生活质量下降的主要原因之一,其中癫痫后抑郁明显增加癫痫患者自杀的风险〔11〕。故对癫痫合并抑郁患者的抗抑郁治疗尤为重要。研究证实对5-羟色胺再摄取抑制剂对癫痫患者较为安全,能明显降低合并抑郁患者抑郁量表评分〔12〕。故本研究采用锂-匹罗卡品癫痫造模+慢性不可预知性应激建立癫痫合并抑郁造模,该模型已广泛用于探索癫痫合并抑郁发病及治疗的动物模型〔13〕。并选用5-羟色胺再摄取抑制剂经典药物氟西汀对癫痫合并抑郁大鼠进行干预。本研究成功地诱发了癫痫大鼠抑郁样行为,而氟西汀能明显改善癫痫合并抑郁大鼠抑郁行为,呈剂量依赖性。
研究证明锂-匹罗卡品大鼠慢性期病理表现为海马神经元大量脱失,神经胶质细胞活化增生;神经元脱失和胶质增生为癫痫复发重要原因〔14〕。星形胶质细胞为神经元运输营养物质和排除代谢产物,具有支持和引导神经元迁移的作用,同时还参与神经元的突触传递活动〔15〕。GFAP是星形胶质细胞活化的标志物,星形胶质细胞反复、长时间的异常高功能状态与癫痫的发展密切相关〔16〕。NeuN是一种可溶性核蛋白,在体外能与DNA 结合,识别神经元特异的核蛋白单克隆抗体的产生,已成为中枢神经系统成熟神经元的常用标志物〔17〕。在大鼠大部分神经元(大脑皮质、基底核等)有明显表达〔18〕。本研究与既往研究一致〔19〕。氟西汀治疗后GFAP表达下降,NeuN表达增加,且呈剂量依赖性,说明氟西汀能通过抑制GFAP表达、增加NeuN表达改善抑郁行为,发挥神经保护作用。

