H5亚型禽流感病毒DAS- ELISA检测方法的建立
黄 璐 林 一 王厚照 王生育 陈美玉
1.中国人民解放军陆军第七十三集团军医院检验科,福建 厦门 361000;2.厦门大学抗癌研究中心,福建 厦门 361005
禽流感是一种人兽共患传染病,属于A类传染病,由A型流感病毒引起,主要威胁养禽业和人类健康安全,人类患者常伴有呼吸道感染,严重患者可危及生命[1]。禽流感病毒(avian influenza virus,AIV)感染是一类重大养禽类疫病,其病毒亚型多,变异度高,宿主广泛,各亚型之间无交叉,导致疫情频繁发生,以H5亚型禽流感病毒(H5 subtype avian influenza virus,AIV- H5)的致病性最高、危害性最严重[2]。AIV- H5不仅常导致养禽业经济损失严重,还可跨越宿主屏障直接感染人,从而危及人类安全[3]。因此,对AIV- H5的快速检测,在控制养禽业疫情及保障人类健康方面至关重要。
目前,检测AIV有琼脂糖扩散试验、免疫荧光试验、实时定量RT- PCR等多种检测方法[4]。然而,上述方法均存在实验周期长,所需仪器复杂等不同类型的缺点,不能满足基层快速准确诊断的需求。因此,研发快速、简便、准确的AIV- H5检测方法具有重要意义。已有研究利用酶联免疫吸附法(enzymelinked immunosorbent assay, ELISA)检测H5、H7亚型的禽流感病毒相关的检测试剂盒,但是禽流感病毒在进化和传播过程中易发生频繁且不可预测的突变,变异重组的病毒可能具有新的抗原性和致病性,可逃逸人群中已形成的免疫屏障,引起季节性或大规模的流感暴发[5]。目前,已有的检测方法尚不能有效地识别不断出现的新毒株,因此探讨更有效的广谱的检测方法具有重要意义。本研究拟通过混合多种AIV- H5免疫动物,制备通用的单克隆抗体(monoclonal antibodies, McAb),在此基础上酶标抗体,筛选配对单抗,建立抗AIV- H5双抗体夹心ELISA方法(DAS- ELISA),检测方法体系,制作标准曲线,旨在为禽流感疫情防控提供一种高效检测手段,并为H5亚型禽流感病毒监测、后续研究提供有效工具。
1 材料与方法
1.1 材料
SPF级BALB/c小鼠由厦门大学实验动物中心提供;小鼠骨髓瘤细胞SP2/0细胞由本实验室保存;A/Environment/Yunnan/01455/2015(H5N1)、A/Chicken/Hebei/3/2013(H5N2)、A/Duck/Jiangsu/S1665/2015(H5N3)、A/Environment/Jiangxi/10645/2014(H5N8)禽流感病毒及其他病毒的扩增与灭活由深圳出入境检验检疫局完成。弗氏佐剂、弗氏不完全佐剂、PEG、HAT、HT、HRP和rProtein A均为Sigma公司(USA)产品;胎牛血清和DMEM培养基为Gibco公司(USA)产品;其他试剂为国产试剂。
1.2 方法
1.2.1抗原制备 将种毒稀释1×106倍后接种9~11日龄SPF鸡胚,37℃孵育48 h,收集尿囊液,利用β- 丙内酯灭活尿囊液,通过28 000 r/min超速离心2 h浓缩纯化病毒。沉淀的病毒使用适量的PBS进行稀释,浓度调整到1 mg/mL作为母液,分装保存于-80℃冰箱备用,避免反复冻融。
1.2.2动物免疫 选择6~7周龄的雌性BALB/c小鼠作为免疫动物,动物免疫及饲养于厦门大学实验动物中心的ABSL- 2动物生物安全实验室中进行(实验室备案编号:20142149012)。具体操作流程如下:将H5N1病毒与弗氏完全佐剂乳化均匀,经皮下多点注射进行动物初免,将H5N2、H5N3病毒分别与弗氏不完全佐剂乳化均匀,在第15天和第30天分别进行二免和三免。尾静脉采血,用间接ELISA法测定血清效价,选取效价高的小鼠用于后续细胞融合。细胞融合前第3天,用H5N8病毒对小鼠进行脾脏注射加强免疫。
1.2.3细胞融合和杂交瘤细胞株筛选 将免疫小鼠的脾细胞与SP2/0骨髓瘤细胞在PEG2000的作用下进行细胞融合后,加入HAT培养基及饲养细胞,种植于96孔中,在37℃、5%CO2及饱和湿度下培养。在融合后第3天用HT选择培养液换液,待克隆孔长至1/3~1/2时,开始进行杂交瘤细胞株筛选。筛选程序如下:首先以H5N1为包被抗原对克隆孔的培养上清进行大规模初次筛选,初筛获得的阳性孔继而用H5N2、H5N3和H5N8为包被抗原进行再次筛选。4次筛选均为阳性的克隆,进行下一步的“剔除筛选”,即以H9N2、H7N9为包被抗原进行筛选,剔除筛选过程中保留阴性反应的克隆孔。以上综合筛选获得的克隆株用有限稀释法进行3次亚克隆,最终获得稳定分泌抗H5亚型禽流感病毒抗体(anti- AIV- H5 McAb)的杂交瘤细胞,进行再扩大培养、冻存。
1.2.4腹水抗体的制备与纯化 取8~10周龄的雌性BALB/c小鼠,腹腔注射石蜡油(0.5 mL/只),致敏1周后腹腔注射杂交瘤细胞(1×106个/只)。待小鼠腹腔明显膨大后收集腹水,12 000 r/min离心5 min,吸取上清液即为小鼠腹水单克隆抗体。通过rProteinA纯化腹水抗体,用超滤管浓缩纯化的抗体,用紫外吸收法测定抗体浓度。
1.2.5Anti- AIV- H5抗体的鉴定 采用SDS- PAGE鉴定抗体纯度,抗体亚类鉴定试剂盒测定McAb的Ig亚类,间接ELISA法测定抗体效价,并与H9和H7亚型(H9N2和H7N9)进行交叉反应试验,检测抗体的特异性。
1.2.6单克隆抗体的酶标记 采用改良的过碘酸钠法,以辣根过氧酶标记已纯化的抗体。具体方法如下:取10 mg HRP溶解于2 mL蒸馏水,加入0.4 mL新配的0.1 M NaIO4溶液,室温下避光搅拌20 min。利用1 mM pH 4.4的醋酸钠缓冲液,在4℃环境下透析过夜。将溶液pH调到9.0~9.5时立即加入5 mg anti- AIV- H5抗体,室温避光轻轻搅拌2 h。然后,加入0.2 mL新配的4 mg/mL NaBH4液,混匀,置4℃ 2 h。接着,于0.15 M pH 7.4 PBS中4℃透析过夜,即可获得HRP标记的抗体溶液。检测并调整抗体溶液浓度,分装,-20℃保存。直接ELISA检测标记的抗体的效价。以1∶1的比例加入甘油,分装后储存于-20℃备用。
1.2.7DAS- ELISA体系抗体组合及工作浓度确定 棋盘滴定法[6]用于筛选捕获抗体、检测抗体的最佳组合及最佳工作浓度。具体方法如下:①以2.5、5、10、20 μg/mL,100 μL/well将 3C9、6F5于37℃分别包被于酶标板上1 h,作为捕获抗体;②用5%BSA于37℃封闭1 h;③加入0.2 μg/mL,100μL/well的病毒液于37℃反应1 h;④分别以HRP- 3C9和HRP- 6F5作为检测抗体,从起始稀释浓度1∶2 000做倍比稀释,OPD显色,H2SO4终止,测OD490nm。依据反应线性及P/N值,确定最佳抗体组合、包被抗体及检测抗体工作稀释浓度。
1.2.8DAS- ELISA体系最佳工作条件的确定 根据抗体最佳工作浓度,在不同反应条件下,采用棋盘法筛选适宜的条件。包被条件:包被液设有0.01、0.05、0.1mol/L碳酸盐缓冲液,包被时间设有4℃12 h、37℃2 h和37℃ 2 h+4℃ 12 h。封闭条件:封闭液设有2%明胶、5%BSA、5%马血清和5%脱脂奶粉,作用时间设有37℃1 h、37℃2 h、4℃12 h。酶标二抗条件:稀释度从1∶2 000做倍比稀释到1∶10 000,作用时间37℃ 30 min、1 h、1.5 h、2 h。以上各组实验,组成方阵进行ELISA试验,根据OD490nm值以及S/N值的分析确定最佳条件。
1.2.9DAS- ELISA体系检测AIV- H5标准曲线的建立 根据已建立好的DAS- ELISA体系,对AIV- H5病毒液从1 200 ng开始做2倍系列稀释,设阴性对照和空白对照孔进行检测,反应完毕后测定OD490nm值。以病毒稀释浓度为横坐标,OD490nm值为纵坐标绘制曲线图。
1.2.10DAS- ELISA体系检测AIV- H5特异性试验 在优化的条件下,使用AIV- H5的DAS- ELISA系统检测AIV- H5病毒及相应的21~27稀释液,同时设有多种对照组,即交叉实验对照组:灭活后的人的其他亚型禽流感病毒(如AIV- H2、AIV- H7、AIV- H9和AIV- H13),灭活后的症状相似的其他禽类病毒如新城疫病毒(newcastle disease virus, NDV)、传染性支气管炎病毒(infectious bronchitis virus, IBV)、产蛋下降综合征病毒(egg drop syndrome virus, EDSV);阳性对照组:AIV- H5阳性免疫小鼠血清和阳性杂交瘤细胞上清;阴性对照:SP2/0细胞上清、未免疫的小鼠血清和SPF鸡胚尿囊液原液。根据结果分析评价DAS- ELISA系统的特异性。
1.2.11DAS- ELISA体系检测AIV- H5敏感性试验 同时用已建立的AIV- H5的DAS- ELISA系统和商品化的人禽流感(H5N1)ELISA试剂盒对AIV- H5病毒鸡胚尿囊液及SPF鸡胚尿囊液倍比系列稀释液进行检测。敏感度以检测结果为阳性的最大稀释倍数表示。
1.2.12阴阳性临界值的确定 用AIV- H5标准抗原和其他亚型病毒,以PBS制成待检阴性抗原,然后按已建立的DAS- ELISA系统进行检测。在符合正态分布的前提下计算OD值的平均数(X)和标准差(SD),按公式计算出阴、阳性抗原的临界值=X+3×SD。当OD值大于临界值时,可以99.9%的可信度判定为阳性。
1.2.13临床样本检测 用已建立的AIV- H5的DAS- ELISA系统对来自疫区的30份灭活后的禽类鸡棉拭子样品进行检测,并与商品化ELISA试剂盒相比较,对系统的敏感性、特异性和实用性进行评价。
2 结 果
2.1 杂交瘤细胞株筛选与anti- AIV- H5抗体制备
免疫小鼠尾静脉采血,间接ELISA法测定血清效价,以P/N≥2.1的血清稀释度判定有效血清效价。结果3只免疫鼠血清抗体效价均达1∶32 000以上(图1),均可用于后续的细胞融合。
利用ELISA筛选多重筛选融合后的阳性杂交瘤细胞,有限稀释法克隆纯化,直到获得McAb的杂交瘤细胞株,分别命名为3C9和6F5。ELISA检测杂交瘤细胞培养液上清的效价都可达1∶103以上。杂交瘤细胞腹腔注射小鼠,制备腹水抗体,经检测效价均达到1∶107。
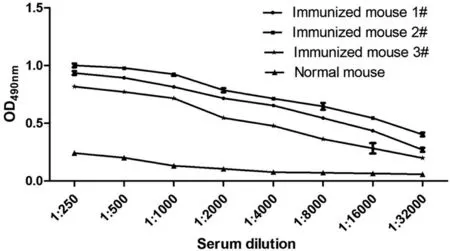
图1 免疫小鼠血清稀释倍数抗体效价测定
2.2 抗体的纯化及抗体亚类分析
利用rProtein A柱纯化腹水抗体,通过SDS- PAGE检测抗体纯度。蛋白凝胶结果(图2)显示的2条蛋白带分别为重链(相对分子量55 000)、轻链(相对分子量25 000),电泳纯度可达95%。经超滤管浓缩后,测量纯化抗体浓度约为2 mg/mL。抗体亚类试剂盒测定结果显示3C9和6F5重链均为IgG2a,轻链均为κ链。ELISA检测纯化抗体效价3C9和6F5分别为1∶107和1∶108,辣根过氧化酶标记抗体后效价皆为1∶106。
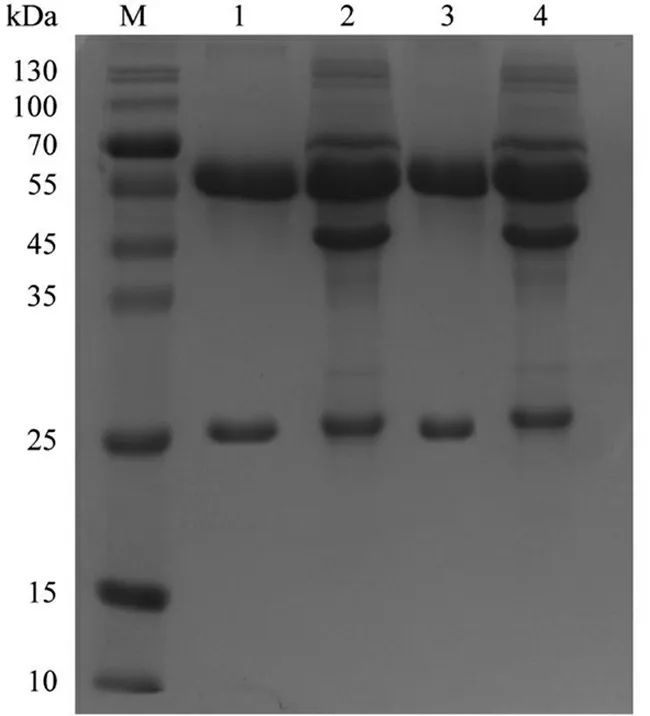
M.蛋白质分子量标准; 1.纯化抗体(3C9); 2.腹水抗体(3C9); 3.纯化抗体(6F5);4.腹水抗体(6F5)。
2.3 捕获抗体、检测抗体的组合
分别用浓度梯度的3C9和6F5包被酶标板,梯度稀释的HRP- 3C9、HRP- 6F5做检测抗体。结果表明(图3)当包被抗体浓度为10 μg/mL时,抗原抗体反应呈线性,且2个包被浓度线性接近。以6F5包被,以HRP- 3C9检测,曲线斜率较好,检测抗体HRP- 3C9稀释度为1∶8 000时,P/N值较高。确定最佳抗体组合为包被抗体6F5、检测抗体HRP- 3C9。
2.4 DAS- ELISA检测条件的优化
经试验,以OD490nm值和P/N值为标准,确定最适包被条件为0.05 mol/L碳酸盐缓冲液37℃包被1 h;最适封闭条件为5%马血清37℃封闭1 h;酶标抗体的最适工作条件为1∶8 000反应1 h。
将AIV- H5病毒标准液做DAS- ELISA检测,重复3次,以OD490 nm值为纵坐标,病毒液稀释度的对数为横坐标,做标准曲线,曲线在18~1 200 ng/mL范围内趋近直线,线性关系佳,R2=0.9944(图4)。
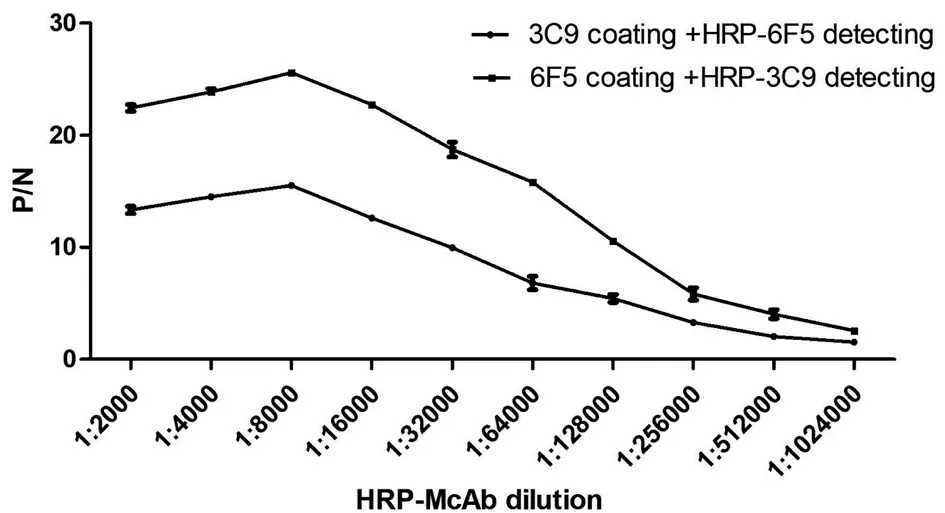
图3 DAS- ELISA单克隆抗体组合的确定

图4 DAS- ELISA标准曲线
2.5 DAS- ELISA检测AIV- H5的特异性和敏感性
DAS- ELISA系统特异性测定见表1,结果显示AIV- H5实验组和阳性对照组为阳性反应;其他亚型人禽流感 AIV- H2、AIV- H7、AIV- H9、AIV- H13和其他禽类病毒NDV、IBV、EDSV交叉反应实验组为阴性反应;SP2/0细胞上清、未免疫的小鼠血清和SPF鸡胚尿囊液阴性对照组也为阴性反应,说明该DAS- ELISA系统无法检测其他病毒,对AIV- H5病毒检测具有特异性。
以AIV- H5鸡胚尿囊液原液及其1/21~1/27稀释液为样本,利用DAS- ELISA系统进行检测,结果均为阳性,商品化人禽流感(H5N1)ELISA试剂盒阳性反应滴度到1/25;以SPF鸡胚尿囊液原液及其1/21~1/28稀释液为对照样本,检测结果均为阴性。表明该DAS- ELISA系统检测对AIV- H5鸡胚尿囊液的灵敏度可达到1/27,且比商品化ELISA试剂盒高4倍。
制备的待检阴性抗原经检验为阴性后,利用DAS- ELISA系统进行检测,结果见图5,20份样本的OD值介于0.037和0.220之间,平均数(X)和标准差(SD)分别为0.110和0.052。根据公式计算阴性样品临界值=X+3×SD即0.266。当OD值>0.266时,可在99.9%的可信度上判定为阳性结果,并可作为检测结果的判定标准。
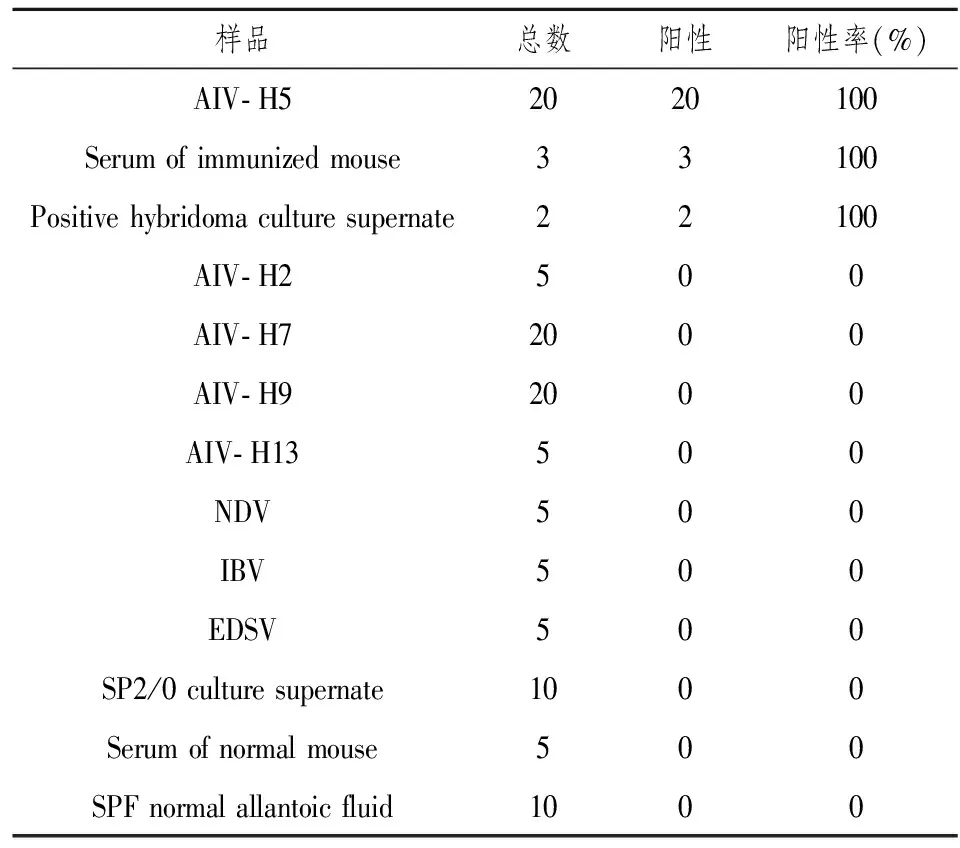
表1 DAS- ELISA系统特异性检测
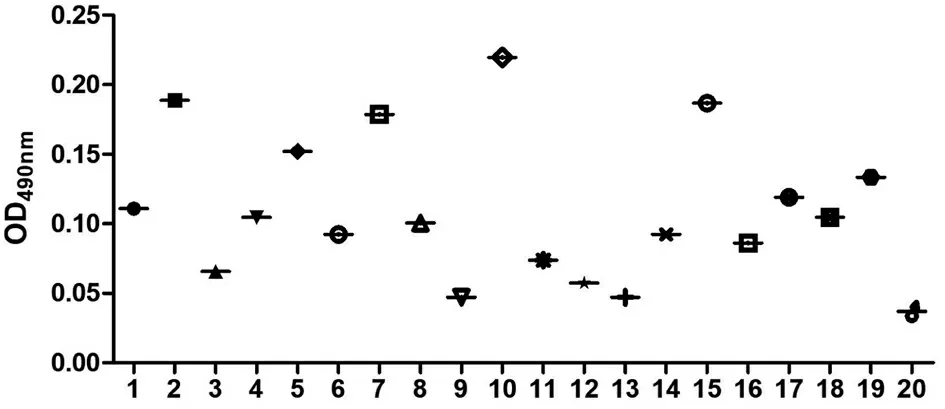
图5 DAS- ELISA系统对20份阴性样品的检测结果
2.6 临床样本的检测
检测来自疫区的禽类鸡的临床棉拭子样本30份,结果显示10份为阴性,20份为阳性。同时,使用武汉赛培生物科技有限公司提供的H5N1 ELISA试剂盒做平行检测,结果与本研究DAS- ELISA检测系统的检测结果相一致,证实该DAS- ELISA系统可应用于AIV- H5病毒感染检测。
3 讨 论
禽流感病毒表面的抗原蛋白与流感病毒的致病性密切相关[7]。根据蛋白表达和存在位置不同可分为8个病毒的组成成分(HA、NA、NP、M1、M2、PB1、PB2和PA),2个非结构蛋白(NS1和NS2)[8]。其中,HA为血凝素,NA为神经氨酸,决定了流感病毒的抗原性。与NA相比较,HA基因的突变率较高。当前研究大多数针对HA蛋白,采用基因克隆、蛋白重组等手段,来制备相应的抗体,但是该方法获取的抗体可能无法识别天然的抗原。本研究使用全病毒作为抗原并通过多重筛选,获得能够识别天然病毒的抗体,使抗体更具有应用性。
随着HA基因的不断进化和变异,HA和NA亚型组合愈加丰富,以H5亚型为例,在自然界中可分离到H5N1、H5N2、H5N3、H5N5、H5N6、H5N7、H5N8和H5N9等[9- 10]。禽流感病毒一般仅感染禽类,如果病毒在复制过程中发生基因重配,致使其结构发生改变,则获得感染人的能力,从而使得人被感染禽流感。当前能直接感染人的禽流感病毒亚型主要有:H5N1、H7NK H7N2>H7N3、H7N7、H9N2和H7N9等,其中H5N1的致死率最高。低致病性AIV如H5N3感染宿主后不表现出明显的临床症状,对养禽业和人类健康的威胁很容易被忽视,并且可能通过各种机制发生改变而成为高致病性AIV。已有研究证实,多种亚型的低致病性AIV具有同时结合禽型受体和人型受体的能力[11- 12]。但是,当前研究广泛的抗体均相对单一,难以覆盖所有的毒株。本研究在抗原免疫阶段首次联用多种AIV- H5毒株进行动物免疫,利用杂交瘤技术获取配对的针对AIV- H5的McAb,具有反应活性高、对AIV- H5覆盖性好的优点。即获得可同时识别多种AIV- H5的单克隆抗体anti- AIV- H5 McAb,包含高致病性和低致病性的AIV- H5。
魏泉德等[13]的病毒分离鉴定法是现行最经典的AIV诊断方法,诊断结果准确,但该方法操作复杂,耗时费力,费用昂贵,难以在AIV疫情爆发时实现快速诊断。血清学诊断技术中的常规方法(琼脂扩散试验、血凝和血凝抑制试验)鉴定病毒,操作简单易行,但是整体敏感性较差。荧光抗体技术用于病毒鉴定快速简便、费用低,但是容易出现假阳性[14]。RT- PCR等分子生物学诊断技术快捷、简便、灵敏,但所需的仪器昂贵[15]。以上各种方法均不适于现场适时诊断AIV感染样品,在现实应用过程容易受到限制。然而,ELISA具有特异性、敏感性、快速性和简易性等优点。其中,抗体的亲和力和纯度是DAS- ELISA检测方法建立的成败因素,本研究通过rProteinA纯化腹水抗体,获取高纯度的McAb,用于构建性能良好的双抗体夹心ELISA(DAS- ELISA)检测系统。
本研究建立的DAS- ELISA检测系统,在保留ELISA的特异性、敏感性的基础上,又可缩短诊断时间,结果不需要特殊仪器分析、甚至肉眼判定即可,为AIV- H5的检测以及防疫提供了一种方便、快捷、准确的方法。

