巨杉健康和感病叶片表面微生物组成和多样性比较
岳雪华, 范深厚, 杜雪柯, 胡嘉琪, 张 扬, 李媛媛,3
(1.华东师范大学生态与环境科学学院,上海 200241;2.湖北省利川市林业科学研究所, 湖北 利川 445400;3.上海市崇明生态研究院,上海 200062)
人类活动引发的生境破坏、环境污染等问题导致了疾病传播概率增加、感染范围扩大,成为威胁生物多样性的主要因素之一[1].由于受到各种病原菌的侵害,植物个体容易死亡、种群衰退、农作物减产,进而对植物群落结构和功能产生不利影响[2].例如栗疫病菌(Cryphonectriaparasitica)是栗树的致病真菌,1904年在美国纽约首次发现,不到50年里几乎摧毁了美国全境超过30亿株的美洲栗(Castaneaamericana),最终导致该物种灭绝[3,4].3种兼性厌氧的欧式杆菌Erwiniacarotovorasubsp.carotovora、Erwinia.carotovorasubsp.atroseptica和Erwinia.chrysanthemi会导致土豆软腐病,该类细菌通过产生大量导致细胞壁降解的酶侵蚀植物,致使软腐病泛滥[5].半知菌亚门的灰梨孢(Pyriculariagrisea)侵染水稻导致稻瘟病,在我国乃至全世界都广泛流行,该病菌使水稻减产约10%~15%[6].由细菌、真菌等微生物引起的许多植物病害,不仅对植物生长不利,而且也对社会造成巨大经济损失.
近年来,随着高通量测序技术的发展,环境微生物群落分析愈加成熟,该技术通过获得大量DNA序列以鉴定传统培养方法难以发现或低丰度的微生物种类,更加准确、全面地反映环境微生物群落结构,对植物病害的预防和防治有重要指导意义.应用高通量测序真菌ITS区域,对患叶斑病的枇杷(Eriobotryajaponica)叶片进行真菌群落的组成和多样性分析,发现Epicoccumnigrum是枇杷叶斑病的主要致病菌[7].高通量测序细菌16s rRNA区域发现感病土豆植株中芽孢杆菌属(Bacillus)在根际细菌中占优势,相对丰度明显比健康植株高,而溶杆菌属(Lysobacter)在健康植株的土壤中则相对较多[8].
巨杉(Sequoiadendrongiganteum)是杉科(Taxodiaceae)巨杉属(Sequoiadendron)的唯一现存树种,高大乔木,具有重要的系统发育地位,野生个体只分布于美国西部的加利福尼亚州,中国部分地区有引种[9].调查发现,我国同时引自美国的杉科树种中,巨杉成活率较低,引种的巨杉幼树在生长过程中,多数植株中上部有叶片和小枝干燥发黄现象,并最终导致巨杉幼树死亡.我国对其系统发育地位[10]和形态学等方面的研究较多[11],未见其病害的相关研究.本研究探讨巨杉叶片表面微生物的组成和多样性,检验巨杉黄叶现象是否与菌群有关,采用高通量测序技术比较健康和感病叶片表面的微生物群落的种类和多样性,比较细菌和真菌组成差异,鉴别出与巨杉感病相关的可能致病菌,以期对防治病原菌侵染提供依据.
1 材料与方法
1.1 巨杉叶片表面微生物收集
2016年8月于湖北省利川市林业科学研究所采集引种的巨杉叶片,共3株幼树,高度约50 cm,种植于林业科学研究所野外试验样地内.每个植株的中上部都有黄色感病叶片,下半部分多为绿色健康叶片,分别采集每株的健康叶片(编号为G)和感病叶片(编号为Y),及时保存于-72 ℃,以便提取叶片表面微生物总DNA,供后续试验分析.
将巨杉鳞状钻形叶片与小枝相连处剪开,使叶片分散,将3株幼树的健康叶片和感病叶片混合,然后分别各称取40 g,放在灭菌的磷酸盐缓冲液中置于摇床上振荡30 min,随后通过过滤、离心收集叶片表面微生物沉淀[12].
1.2 微生物总DNA提取、检测
采用细菌DNA试剂盒提取叶片表面微生物总DNA,并用1.2%琼脂糖凝胶电泳检测.
1.3 高通量测序
细菌16S rRNA基因V4-V5区测序在Illumina MiSeq平台进行,采用通用引物515F和907R[13],测序片段约400 bp.真菌ITS测序在Roche 454 GS FLX+平台进行,扩增采用引物ITS4和ITS5[14],片段约500 bp.测序由上海派森诺公司完成.
1.4 数据分析
1.4.1 数据整理与筛选 根据index信息提取有效序列,运用Qiime v.1.17[15]过滤,采用uchime_ref[16]去除嵌合体序列,获得优质序列.
1.4.2 OTU聚类及注释 操作分类单元(operational taxonomic units, OTUs)旨在区分不同细菌DNA序列间的差异大小[17],按照相似性将序列分归为不同的分类单元,1个单元为1个OTU,通常以97%相似度计算.采用uclust方法[18]对优质序列按97%相似度聚类,blast方法比对,选择置信度最高的结果,统计样品OTU数量和注释信息,去除丰度值低于测序总量0.001%的OTU.Silva (Release 115 http://www.arb-silva.de)[19]和Unite (Release 5.0 http://unite.ut.ee/index.php)[20]数据库分别为细菌和真菌注释.分类时,用“No Rank”表示没有科学名称的中间等级;用“Unclassified”表示置信度低于阈值的分类级别.
1.4.3 稀释曲线 从样本中随机抽取序列预测不同测序深度下物种丰富度,获得稀释曲线,使用Origin 2017绘制.
1.4.4 OTU维恩图 对OTU数目做样本间维恩图,显示样本特有和共有的OTU数量.
1.4.5 Alpha多样性指数 使用Chao1/Ace指数估计群落的物种丰富度,数值越大表明丰富度越高;使用Simpson′s Index of Diversity(1-D)和Shannon指数反映群落丰富度和均匀度,数值越大多样性越高.采用mothur软件计算4种生物多样性指数[21].
1.4.6 系统发育树 用GraPhlAn软件[22]绘制基于物种和丰富度信息的结构图,结果不仅可表示各物种进化关系,同时各节点大小反映物种丰富度情况.
1.4.7 群落物种组成及丰富度差异分析 在门和属分类水平上绘物种分布直方图.
2 结果与分析
2.1 序列筛选和OTU聚类
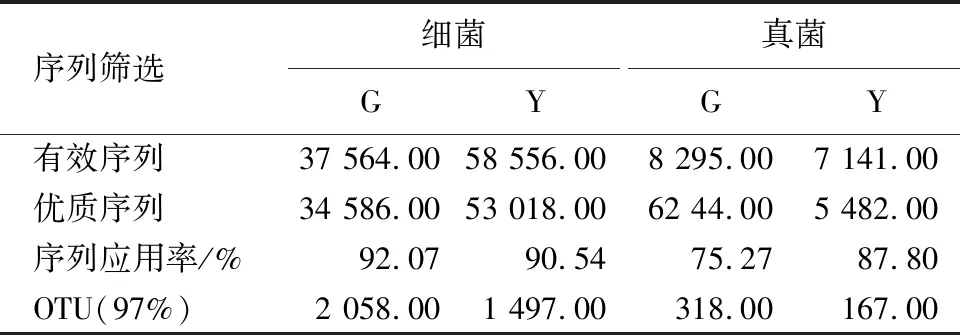
表1 序列筛选及OTU聚类结果1)Table 1 Result of trimmed sequences and OTU analysis
1)G:健康叶片;Y:感病叶片.
通过高通量测序得到健康叶片(G样品)表面的细菌和真菌有效序列分别为37 564和8 295条,筛选后得到的优质序列为34 586和6 244条,序列应用率为92.07%和75.27%(表1).感病叶片(Y样品)表面的细菌和真菌有效序列分别为58 556和7 141条,筛选后得到的优质序列为53 018和5 482条,序列应用率达到90.54%和87.80%.两样品细菌的序列应用率都高于90%,真菌的序列应用率也达到75%以上.
OTU聚类中G样品细菌和真菌的OTU数分别为2 058和318个,Y样品分别为1 497和167个.G样品细菌和真菌OTU数约为Y样品的1.4倍和1.9倍,表明健康叶片表面细菌和真菌的物种丰富度较高.
2.2 稀释曲线
在相同的测序深度下,无论是细菌还是真菌,健康叶片包含的OTU数量都比感病叶片多(图1),在一定程度上反映健康叶片表面的微生物多样性更高.
2.3 OTU维恩图
两样品的细菌和真菌共有OTU分别为642个(占总发现OTU的22.04%)和100个(占总发现OTU的25.97%),表明健康和感病叶片表面的细菌、真菌共有OUT较少(图2).G样品的细菌特有OTU为1 416个(68.80%),真菌特有OTU为218个(68.55%).Y样品的细菌特有OTU为855个(57.11%),真菌特有OTU为67个(40.12%),健康叶片表面细菌和真菌的特有OTU数量均多于感病叶片.
2.4 Alpha多样性指数
Chao1和Ace指数预计G样品真菌丰富度几乎为Y样品2倍,Simpson(1-D)和Shannon指数都表明G样品相较Y样品细菌和真菌多样性都略高(表2).
2.5 系统发育进化树

表2 Alpha多样性指数1)Table 2 The Alpha diversity index
1)G:健康叶片;Y:感病叶片.
叶片表面细菌主要为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes).变形菌门细菌种类最多,主要分布在α-变形菌纲(Alphaproteobacteria)和γ-变形菌纲(Gammaproteobacteria).丰富度≥1%的主要分布在5个目中,分别为根瘤菌目(Rhizobiales)、鞘氨醇单胞菌目(Sphingomonadales)、肠杆菌目(Enterobacteriales)、假单胞菌目(Pseudomonadales)、Streptophyta目,4个科包括肠杆菌科(Enterobacteriaceae)、鞘氨醇单胞菌科(Sphingomonadaceae)、假单胞菌科(Pseudomonadaceae)、甲基杆菌科(Methylobacteriaceae),以及3个属为肠杆菌属(Enterobacter)、甲基杆菌属(Methylobacterium)、假单胞菌属(Pseudomonas).
真菌主要为子囊菌门(Ascomycota)和担子菌门(Basidiomycota),丰富度≥1%的物种主要有4个目分别为Capnodiales目、格孢腔目(Pleosporales)、柔膜菌目(Helotiales)、Sporidiobolales目,2个科包括小球壳科(Mycosphaerellaceae)和核盘菌科(Sclerotiniaceae).图中还可以看出真菌中丰富度较高的主要是子囊菌门中的Uwebraunia属、葡萄孢属(Botrytis),担子菌门中的Tilletiopsis属、掷孢酵母属(Sporobolomyces).
2.6 群落物种组成及丰富度差异分析
2.6.1 门分类水平 G样品细菌类群的优势菌群是变形菌门,数量占比高达68.90%,随后依次为蓝细菌/叶绿体(Cyanobacteria/Chloroplast,14.30%)、拟杆菌门(9.90%)和放线菌门(2.20%)(图5).Y样品细菌变形菌门也是优势门,占79.90%,此外数量较高的还有放线菌门(10.30%)、拟杆菌门(6.80%)和蓝细菌/叶绿体(Cyanobacteria/Chloroplast,1.40%).感病叶片表面细菌在门水平上的组成与健康叶片相似,然而感病叶片表面放线菌门细菌占细菌总数量的比例比健康叶片高,健康叶片表面的蓝细菌/叶绿体所占比例比感病叶片高.
G样品真菌主要为子囊菌门(71.40%)和担子菌门(27.90%),这两个门的真菌占总数量的99.30%,其余门的真菌及未知真菌共占总数量的0.70%.与G样品类似,Y样品真菌优势门也是子囊菌门(74.40%)和担子菌门(25.50%),两个门占总数量的99.90%.
2.6.2 属分类水平 G和Y样品比例>1%且可分类的细菌主要是变形菌门的肠杆菌属、假单胞菌属和甲基杆菌属,其中肠杆菌属在Y样品表面细菌总数量中所占比例(20.00%)明显比G样品高(6.80%)(图6).放线菌门的短小杆菌属(Curtobacterium)和拟杆菌门的金黄杆菌属(Chryseobacterium)在Y样品表面细菌总数量中所占比例(分别为7.60%和3.10%)比G样品高(分别为0.80%和0.10%),而Hymenobacter属在G样品表面细菌总数量中所占比例(5.70%)比Y样品高(0.90%).其余各属如鞘氨醇单胞菌属(Sphingomonas)、寡养单胞菌属(Stenotrophomonas)、无毛螺旋体属(Spirosoma)和新鞘氨醇杆菌属(Novosphingobium)所占比例差异不明显.
从图6可以看出,G样品表面真菌的优势属是Uwebraunia属(32.30%),占表面真菌总数量的比例明显比Y样品(9.50%)高,Y样品表面真菌的优势属是葡萄孢属(49.60%),该属数量几乎占了感病叶片表面真菌的一半,比例明显比G样品(16.10%)高.其余各属如茎点霉属(Phoma)、Dissoconium属、拟盘多毛孢属(Pestalotiopsis)、掷孢酵母属、Tilletiopsis属、Auriculibuller属、葡萄座腔菌属(Botryosphaeria)所占比例差异不明显.
3 讨论
通过对比健康和感病叶片表面真菌情况表明,群落多样性上,OTU总数在健康叶片上是感病叶片的1.9倍,健康叶片的多样性指数约是感病叶片的2倍,健康叶片能维持较高的真菌多样性.真菌群落组成上,健康叶片表面优势属是Uwebraunia属,含有比例约占总体的三分之一;但感病叶片子囊菌门葡萄孢属(Botrytis)含量很高,占总数量的几乎一半(49.60%),远远多于健康叶片的16.10%.已知葡萄孢属真菌包含20多个菌种,多数可以导致灰霉病,其中灰葡萄孢菌(Botrytis.cinerea)分布广泛,影响最严重[23],可侵染200多种双子叶植物[24],是多种作物如番茄(Lycopersiconesculentum)、草莓(Fragaria×ananassa)病害的常见真菌[25].但之前鉴别葡萄孢属主要依靠寄主范围和形态特征等,在2005年获得该菌株全基因组序列后,认识到灰葡萄孢是复合种,此后又陆续报道了9个该属的新种[26].其中新种卡罗来纳葡萄孢(Bacopa.caroliniana)于2012年在美国南卡罗来纳州黑莓(Rubusfruticosus)的灰霉病中发现,同时也在美国北卡罗来纳州感染灰霉病的草莓果实上发现[27].在本研究中,高通量测序鉴定出感病巨杉叶片表面的该属真菌均为卡罗来纳葡萄孢一种,丰度占测得真菌总量的49.60%,而健康叶片该菌种只占16.10%,推测感病叶片表面高含量的卡罗来纳葡萄孢与巨杉感病密切相关,导致叶片发黄进而整株枯死.
目前防治灰霉病多以化学方法,使用多菌灵(Carbendazim)、环酰菌胺(Fenhexamid)等杀菌剂.生物手段也广泛使用,木霉菌属(Trichoderma)和链霉菌属(Streptomyces)对防治灰霉病具有较好的效果[28],如使用哈茨木霉T39菌株和灰绿链霉菌(Streptomyces.griseovirides)取得了较好效果[29-30].链霉菌由于产生变构霉素(tautomycin)和白肽霉素(albopeptin)等抗真菌物质,能抑制灰霉病.此外,致力于筛选出能抵抗灰霉病菌的拮抗菌研究也越来越多[31-32].
通常认为,变形菌门是不同植物叶际细菌群落的主导类群[33],本研究对于细菌类群的分析表明,变形菌门是优势门,系统发育树显示主要包括α-变形菌纲和γ-变形菌纲.从细菌多样性方面看,与真菌类似,健康叶片表面的细菌多样性比感病叶片高,健康叶片表面能够维持较高的细菌群落多样性.从细菌组成上来看,变形菌门的肠杆菌属、拟杆菌门的金黄杆菌属以及放线菌门的短小杆菌属细菌在感病叶片表面所占比例比健康叶片高.一般肠杆菌属和金黄杆菌属细菌不导致植物病害,但短小杆菌属的萎蔫短小杆菌(Curtobacteriumflaccumfaciens)常常是植物致病菌,陈永芳等[34]研究表明,萎蔫短小杆菌的变种导致落葵(Malabarspinach)和糖甜菜(Betavulgaris)的细菌性叶斑病,但该属是否为本研究巨杉的致病菌需进一步验证.
本研究通过对比分析巨杉健康和感病叶片表面微生物多样性,发现健康叶片表面能够维持更高的细菌和真菌群落多样性,其中葡萄孢属真菌B.caroliniana在感病巨杉叶片中的比例远高于健康叶片.但试验样品测序时未分开建库,可能致结果存有一定片面性.后续若要确定B.caroliniana是否与巨杉感病密切相关,还需要分离菌株进行侵染试验.
致谢:感谢武汉大学李家儒教授在样品采集上提供的帮助.

