哈茨木霉细胞内油脂积累的初步研究
刘秀花,张霁,梁梁,杜风光,冯红,梁峰*
(1.商丘师范学院 生物精炼河南省工程实验室,河南 商丘 476000;2.商丘职业技术学院,河南 商丘 476000;3.车用生物燃料技术国家重点实验室,河南 南阳 473000 )
由于化石燃料资源有限,污染环境,因此使用可再生性的生物柴油是一个最佳的选择[1].生物柴油是再生能源,可以减少石化能源的开采和消耗、从而减少对地球生态环境的过度破坏.生物柴油燃烧所排放的CO2,远低于植物生长过程中所吸收的CO2,因此使用生物柴油,会大大降低CO2的排放和温室气体积累、缓解并从根本上解决因温室气体积累所造成的全球气候变暖这一有害于人类的重大环境问题.我国生产生物柴油的原料主要是过剩的粮食,但是由于我国不适合种田的荒山和荒地巨大,而且人口众多,所以这种方法在目前来说是行不通的,因此寻求其他途径解决油脂来源问题是我国生物柴油发展的必由之路.微生物油脂(Microbial oils)又叫单细胞油脂(SCO),是由酵母菌、细菌、藻类和霉菌等微生物在一定条件下,通过碳水化合物、碳氨化合物和普通油脂为碳源,将其转化并且存在体内的油脂,包括游离脂肪酸,长链脂肪醇和酯类、长链烯烃等[3-4].目前发现的产油微生物主要在酵母、丝状真菌、藻类这3种生物中[5].而且它们的生长周期短,易于大规模生产且基本不受地域气候等外在条件的影响[6].
1 材料与方法
1.1 材料
本试验所用菌株是哈茨木霉(Trichodermaharzianum)CICC 13056,购自中国工业微生物菌种保藏管理中心.由商丘师范学院生物精炼河南省工程实验室保存.菌种活化培养基使用查氏培养基,依照参考文献[7-8]中的查氏培养基稍作更改,产油发酵培养基依照参考文献[9]配制.
1.2 研究方法
1.2.1 哈茨木霉的液体发酵培养
把在查氏培养基上活化好的哈茨木霉菌株制成孢子悬液,把1×108个孢子接入灭好菌的产油液体培养基中,培养条件是28 ℃,180 r/min.从接入菌体以后每培养24 h测残糖量和pH的变化,同时苏丹黑染色观察油滴的变化.
1.2.2 液体发酵中pH的测定与调整
发酵培养基的初始pH是6.0,考虑到如果pH过于偏酸可能会影响到菌体的生长,甚至可能会影响到油脂的积累,所以每培养24 h都要用pH试纸测一下pH的变化,适当用灭过菌的2 mol/L的氢氧化钠调整液体培养基的酸度.
1.2.3 阿贝折射仪测定发酵液残糖量的测定
液体培养基的初始糖度是5.20 g/100 mL,从残糖量中可以看出糖的消耗,所以每培养24 h用糖度计进行残糖量的测定.
1.2.4 苏丹黑B染色显示细胞油滴
油滴经苏丹黑B染色后在显微镜下呈现黑色,通过观察也能看出油滴的大小以及菌体产油的能力.
1.2.5 菌体生物量测定的方法
将滤纸提前称好,把摇瓶培养的菌体用抽滤机进行抽滤收集,做好标记,把抽滤得到的滤饼在电子天平上依次称量得到鲜菌重,记录数据;用抽滤得到的鲜菌体连同滤纸放入烘箱中,60 ℃,烘1 h,即得干菌体,在电子天平上依次称量得到干菌重,记录数据.
1.2.6 微生物油脂提取
热酸解法提取微生物油脂依照参考文献[6]、[10]报道的方法.
2 结果与分析
2.1 不同培养基菌丝体细胞油脂积累特点
如图1所示,A显示的是50 g/L蔗糖浓度的查氏培养基中培养第5天的哈茨木霉的菌丝体的苏丹黑B染色,显微镜观察的油滴积累.B显示的是在产油培养基中在自然pH的培养条件下培养第5天的哈茨木霉的菌丝体的苏丹黑B染色,显微镜观察的油滴积累.C显示的是在产油培养基中维持pH在5.5-6.0的培养条件下培养第5天的哈茨木霉的菌丝体的苏丹黑B染色,显微镜观察的油滴积累(其中产油培养基中含有50 g/L葡萄糖).从图1可以明显看出哈茨木霉在固体查氏培养基中积累的油滴远远小于产油培养基中积累的油滴.
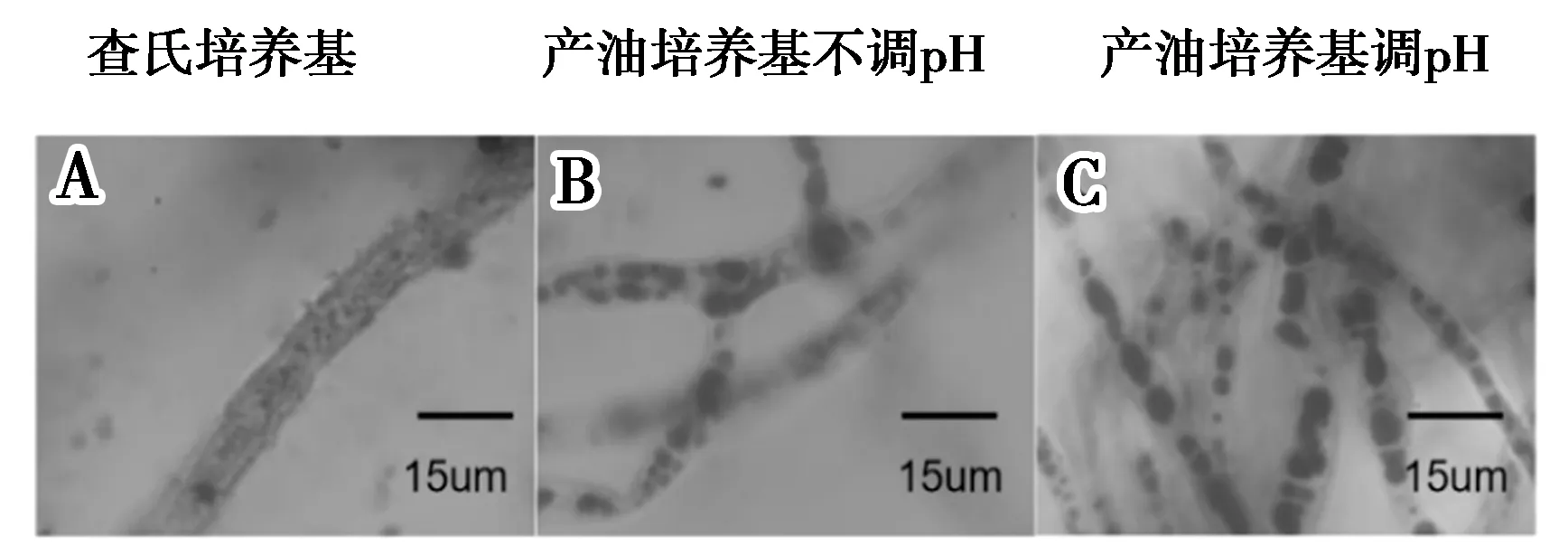
图1 菌丝体细胞油脂积累情况Fig.2 Mycelial cell lipid accumulation

图2 不同时间不同pH菌丝体细胞油滴的苏丹黑染色显微图Fig.2 Sudan black staining of mycelial cell oil droplets at different pH different times
采用产油发酵培养基进行液体摇瓶培养,研究细胞油滴积累过程.由于培养过程中pH会发生变化,本研究设计了对发酵过程pH的调节试验,一组培养基为保持自然pH,一组使培养基的pH保持在5.5-6.0之间.
2.2 液体培养的菌丝体细胞内油脂积累过程
图2显示的是液体培养基在自然pH的条件下培养72 h(A)、96 h(B)、120 h(C)、144 h(D)的染色情况和在维持pH在5.5-6.0的条件下培养72 h(E)、96 h(F)、120 h(G)、144 h(H)的染色情况.A到D,油滴越来越大,也越来越多;E到H,油滴越来越大,也是越来越多.由于在72 h时pH才开始调的,所以E是调pH的ck,所以E看着与不调pH的油滴情况相似.而且从图2可以看出,调pH的积累的油滴比不调pH的积累的油滴要圆.
2.3 pH对菌体生物量的影响
图3所示的是调pH与不调pH的生物量的影响,从图3可以看出调pH的鲜菌重与干菌重均比不调pH的鲜菌重和干菌重要重,因此可以得出调pH的生物量高于不调pH的生物量.
2.4 培养过程pH调节与不调节对油脂产量的影响
如图4显示,调pH的鲜菌体产量和干菌体产量均比不调pH的鲜菌体产量和干菌体产量要高,由此可见,pH对菌体产量是有影响的,从图4也可以看出鲜菌体产量优于干菌体产量,出现这个现象的原因可能是操作不当,也有可能是提鲜菌体产量的方法不适合提干菌体产量,干菌体在一定程度上更难破碎.所以提倡用鲜菌体提油,因为这种方式提油节省能量、人力和时间.
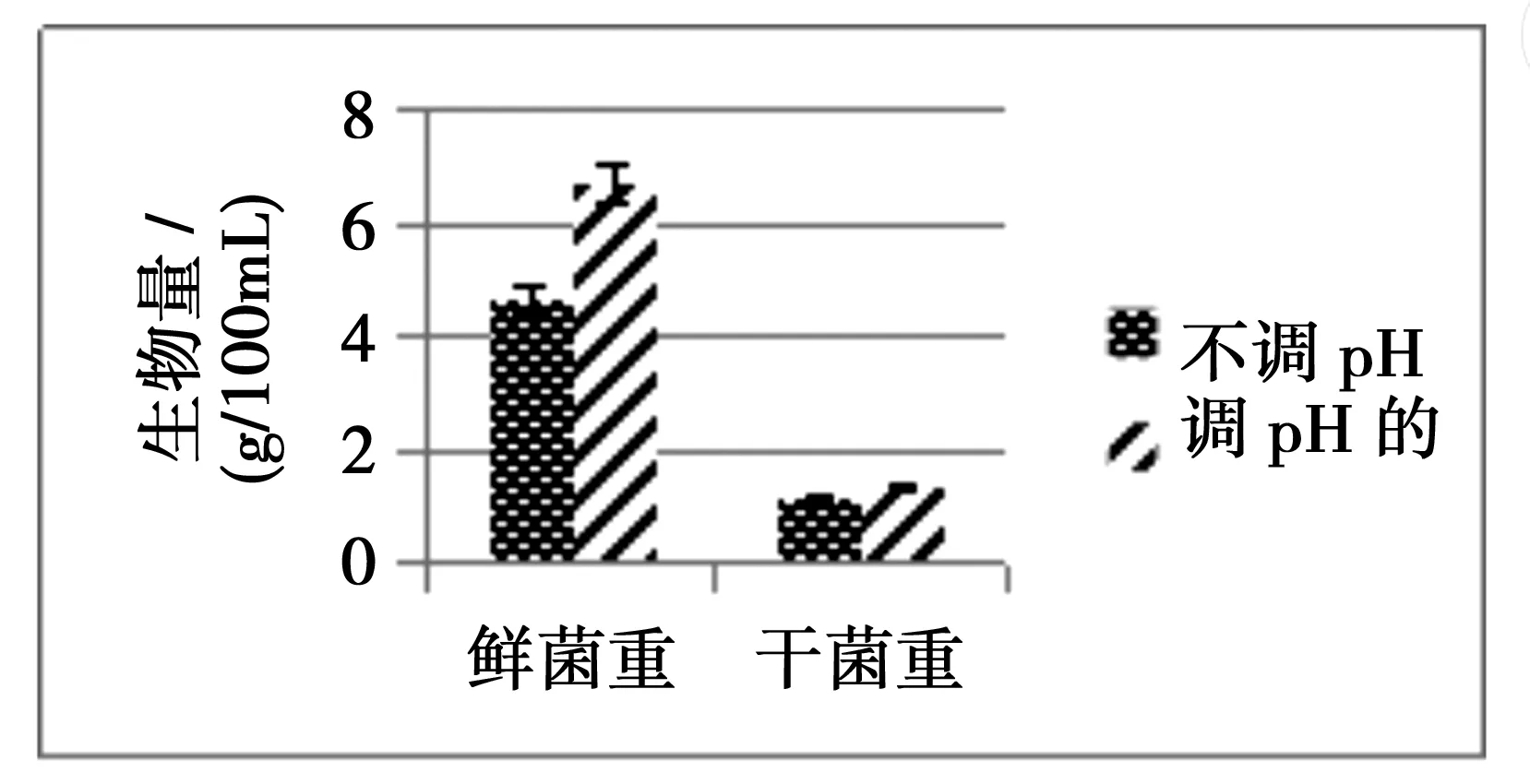
图3 pH对菌体生物量的影响Fig.3 Effect of pH on biomass
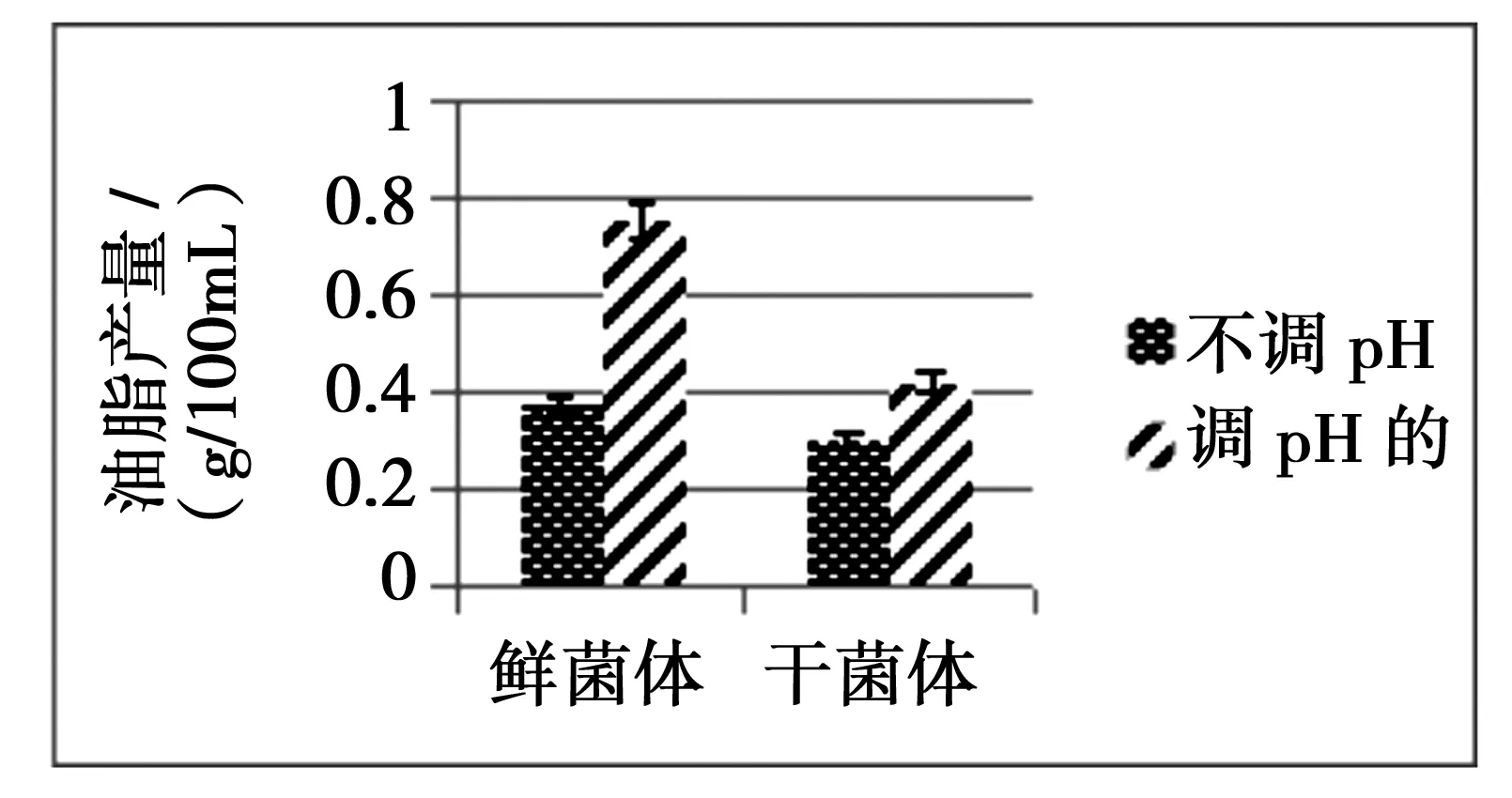
图4 pH对油脂产量的影响Fig.4 Effect of pH on oil yield
3 结 论
通过液体发酵培养哈茨木霉菌株进行苏丹黑B染色,观察菌丝体细胞内油滴的积累情况,可以看出随着培养时间的增多,油滴越来越大,并且调pH的比不调pH的油滴积累的要多,要圆.通过热酸解提取油脂的结果,可以得出哈茨木霉菌株在调pH的培养基上培养,鲜菌体提取油脂产量为7.53 g/L,干菌体产油量为4.19 g/L,结果显示干菌体提取油脂油脂提取率明显低于鲜菌体,说明热酸解法提取哈茨木霉有待研究.总之,本研究结果显示哈茨木霉菌株属于产油微生物,具有很好的产油酯能力,同时,哈茨木霉菌株在液体产油发酵培养基中以及在调pH能够促进它的产油能力.

