甲氨基阿维菌素苯甲酸盐对海洋桡足类日本虎斑猛水蚤的急慢性毒性效应
王晶,庄昀筠,2,陈洪举,2,陈畅,毛雪微,刘光兴,2,*
1. 中国海洋大学环境科学与工程学院,青岛 266100 2. 青岛海洋科学与技术国家实验室,海洋生态与环境科学功能实验室,青岛 266200
有研究表明,阿维菌素通过抑制无脊椎动物的神经传导引起其麻痹和死亡[1-3],以阿维菌素为基础半合成的甲氨基阿维菌素苯甲酸盐(简称甲维盐,emamectin benzoate, EMB)是一种新型的杀虫剂,由于低毒、高效等特点,被广泛用于农业和水产养殖业。甲维盐对于作物害虫如鳞翅目(Lepidoptera)、鞘翅目(Coleoptera)等具有良好的杀灭作用[4-5]。在水产养殖上,甲维盐作为鱼类饲料添加剂用于去除大西洋鲑鱼(Salmosalar)、大麻哈鱼(Oncorhynchusketa)身上的寄生性桡足类,包括鲑疮痂鱼虱(Lepeophtheirussalmonis)、智利鱼虱(Caligusrogercresseyi)等[6-7]。2002—2015年,苏格兰的鲑鱼产量增加1倍,而甲维盐的用量增加了5倍[8]。甲维盐随鱼粪和饲料进入海洋环境后,沉降进入沉积物[9]。在沉积物中,其降解速率大大减缓,并随时间推移逐步扩散进入水体[10-11]。在水/沉积物系统中,甲维盐会长期存在,半衰期可超过120 d[10]。这很可能对其他水生生物造成毒害作用,进而影响种群动态、群落结构及食物网功能。
桡足类是海洋食物链中重要的次级生产者和饵料基础,对于维持海洋生态系统的平衡与稳定具有至关重要的作用[12-13]。海洋桡足类有的营自由生活,也有的营寄生生活。甲维盐既然可以有效杀灭寄生性桡足类,那是否也会影响到营自由生活的桡足类?目前已有的相关研究较少,Willis和Ling[14]评估了甲维盐对4种海洋浮游桡足类的急性和亚致死毒性影响,衣晓燕[15]在个体和分子水平上研究了甲维盐对火腿伪镖水蚤(Pseudodiaptomuspoplesia)的毒性作用。
本研究以营自由生活的桡足类——日本虎斑猛水蚤(TigriopusjaponicusMori)为对象,研究不同浓度甲维盐暴露对其产生的急性毒性效应(包括半数致死浓度、半数效应浓度、摄食率以及各生化指标变化)和慢性毒性效应(包括发育时间、发育率和10 d产卵量),为评估甲维盐对海洋桡足类的潜在影响提供数据支持和科学依据。
1 材料与方法(Materials and methods)
1.1 桡足类的采集与驯化
日本虎斑猛水蚤采自青岛市鲁迅公园潮间带,由中国海洋大学海洋生命学院底栖生物实验室提供。驯养条件为:盐度30,温度20 ℃,光照12 h(L)∶12 h(D)。饵料为三角褐指藻(Phaeodactylumtricomutum)(4.0×104cells·mL-1)、青岛大扁藻(Platymonashelgolandicavar.tsingtaoensis)(4.0×104cells·mL-1)和酵母(2.0×104cells·mL-1)的混合。培养用海水取自青岛沙子口近海,经0.45 μm微孔滤膜过滤,高温高压灭菌后使用。
1.2 甲维盐溶液的配制
称取纯度为99.4%的甲维盐(PESTANAL®Sigma-Aldrich, USA),将其溶于二甲基亚砜(dimethyl sulphoxide, DMSO)(国药集团化学试剂有限公司),配制成20 g·L-1的贮存液,于4 ℃避光保存。
1.3 急性毒性实验
1.3.1 半数致死浓度
实验设定不同甲维盐浓度组(雌性1 000、2 000、4 000、6 000、8 000、10 000和20 000 μg·L-1,雄性100、800、1 000、1 600、2 000、3 000、3 200、4 000、6 400和12 800 μg·L-1),1个海水对照组和1个DMSO溶剂对照组。每组设3个平行,每个平行10只个体,置于100 mL烧杯。饵料为青岛大扁藻,投喂终浓度为1×105cells·mL-1,温度、盐度和光照与驯化条件一致,48 h换水(50%)一次。记录24、48、72和96 h的死亡率。以解剖针轻触桡足类无反应且其体内肠道无蠕动活动,视为死亡。
1.3.2 半数效应浓度
挑选雌性日本虎斑猛水蚤成体,实验浓度组设置为0.5、1、2、3.5和5 μg·L-1,其他设置同半数致死浓度实验。观察24 h桡足类的状态,记录个体效应情况。以桡足类趴在烧杯底超过10 s,仅在解剖针轻触刺激下才活动并且活动能力较弱为产生个体效应。
1.4 摄食实验
挑选挂卵雌性成体,暴露在不同浓度甲维盐溶液(0.5、1、2、3.5和5 μg·L-1)中,作为实验组。另设置1个对照组和1个溶剂对照组。每组3个平行,每个平行放置10只个体于100 mL蓝色丝口瓶。投喂对数生长期的青岛大扁藻,稀释至终浓度1.0×105cells·mL-1。用铝箔包裹瓶身,放于恒温培养箱中,每8 h缓慢颠倒摇晃丝口瓶。培养24 h后,将藻液用鲁哥氏液固定,用Sedgewick-Rafte浮游植物计数框计数。使用Frost公式计算摄食率和滤水率[16]。
1.5 生化指标
将挂卵雌性成体暴露于不同浓度甲维盐(0.5、1、2、3.5和5 μg·L-1)24 h,测定日本虎斑猛水蚤的过氧化氢酶(catalase, CAT)、超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase, GPx)活性以及乙酰胆碱酯酶(acetylcholinesterase, AChE)。另外,实验设置1个对照组和1个溶剂对照组。每个100 mL烧杯放置100只个体,设置3组平行。恒温培养24 h后,随机取80只装入1.5 mL离心管中,加入0.9%的生理盐水,用小杵研磨至未见明显组织块,获得组织匀浆液。将匀浆液在2 500 r·s-1的转速下离心10 min,取上清液,用试剂盒(南京建成生物工程研究所)测定CAT活性、SOD活性、GPx活性和AChE活性,用于测定以上指标所用的组织匀浆液浓度分别为5%、1%、1%和10%。
1.6 慢性毒性实验
在日本虎斑猛水蚤无节幼虫孵化后24 h内,挑选活跃的个体暴露在不同浓度的甲维盐溶液中(0.025、0.05、0.25、0.5和2.5 μg·L-1),作为实验组;同时设置1个对照组和溶剂对照组,每组设3个平行。连续暴露2代标记为F1、F2,将F2挂卵雌性成体放入无毒的海水中孵化,将产出的无节幼体标记为F3,在海水中“恢复”培养。每10只无节幼虫培养在六孔培养板盛有8 mL膜滤海水的小孔中,桡足幼体转移到50 mL烧杯。每48小时更换50%体积的培养液,饵料、温度和盐度等实验条件与急性毒性实验相同。记录个体的存活和发育状况、每阶段发育时间。将每组成功发育个体的发育时间加权平均,作为该组在该阶段的发育时间。将挂卵雌性投入至六孔培养板中,每孔1只,每个平行组取6只,培养10 d,记录产卵次数和每批次产卵量[17]。
1.7 数据处理
回归分析使用Origin 8.5(OriginLab, USA),获得96 h-LC50、24 h-EC50;单因素方差分析(One-Way ANOVA)、双因素方差分析(Two-Way ANOVA)和LSD多重比较检验采用SPSS20.0(IBM, USA),P<0.05为差异显著;Pearson相关性分析采用SPSS20.0(IBM, USA),P<0.05为显著相关。
2 结果(Results)
2.1 半数致死浓度和半数效应浓度
甲维盐对日本虎斑猛水蚤雄性和雌性的96 h半数致死浓度(96 h-LC50)分别为7 156 μg·L-1和3 637 μg·L-1(图1)。其中,雄性在6 400 μg·L-1全部死亡;而雌性在6 000 μg·L-1死亡率仅为10%,在20 000 μg·L-1全部死亡。EMB对雌性个体的24 h半数效应浓度(24 h-EC50)为3.5 μg·L-1(图2)。
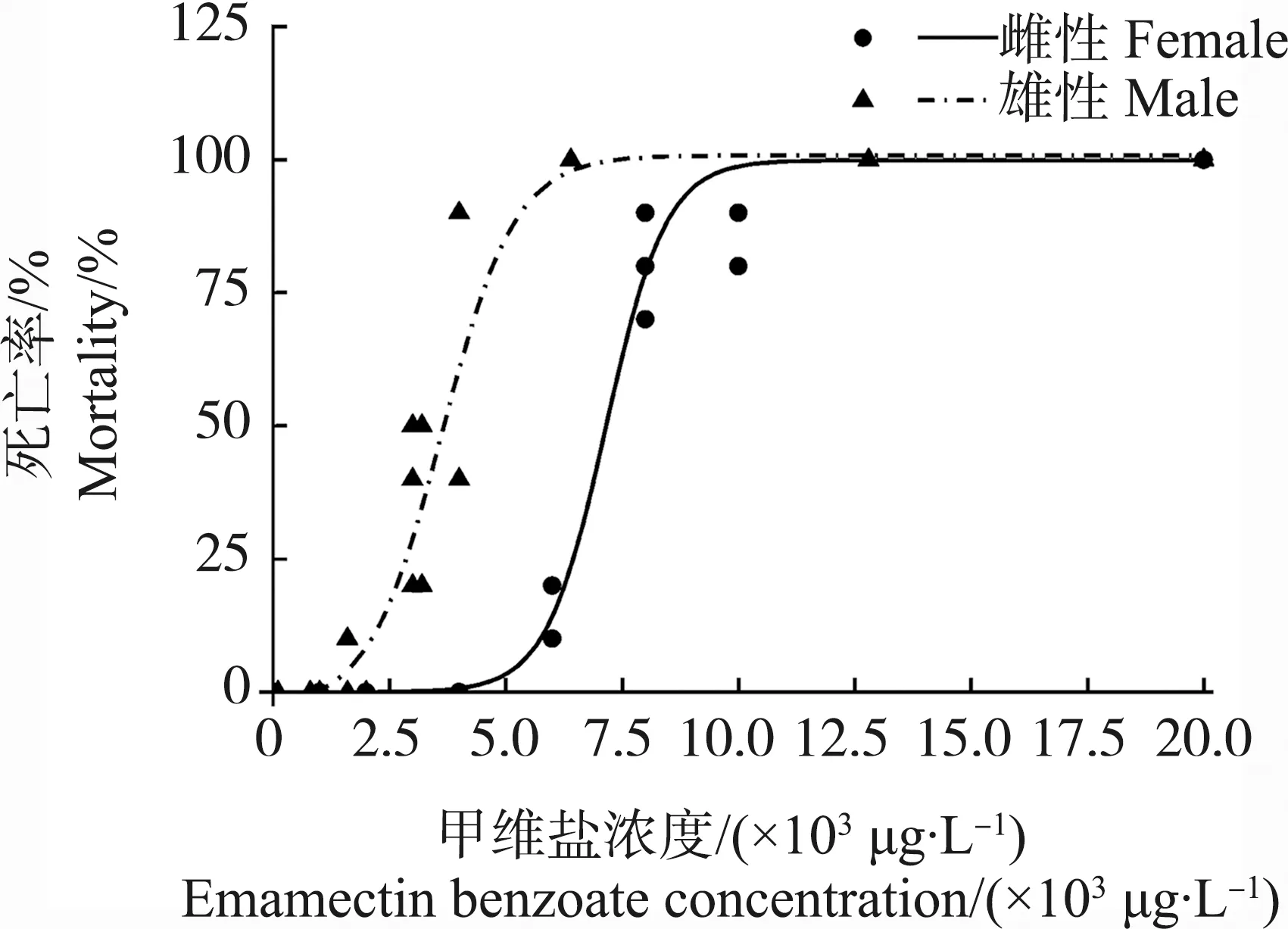
图1 甲维盐对雌雄性日本虎斑猛水蚤96 h的致死剂量响应曲线注:雌性拟合曲线公式为雄性拟合曲线公式为Fig. 1 Susceptibility of female and male T. japonicus to emamectin benzoate (EMB) for 96 h exposureNote: Mortality data were fitted to a dose response curve (variable slope);.The equation for female is r2=0.999, P<0.01; the equation for male is r2=0.937, P<0.01.
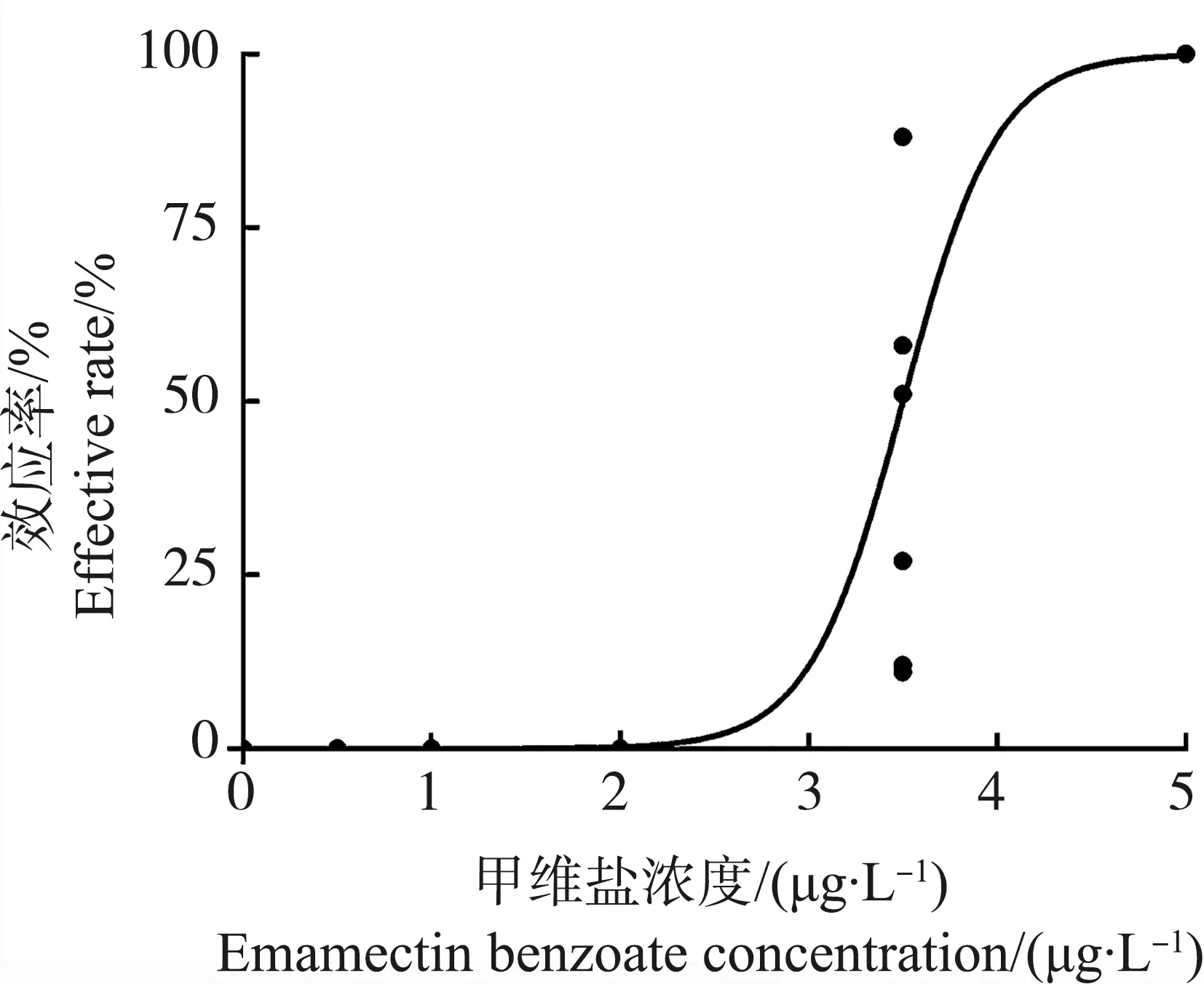
图2 甲维盐对雌性日本虎斑猛水蚤24 h的效应剂量响应曲线注:拟合曲线公式为Fig. 2 Susceptibility of female T. japonicus to EMB for 24 h exposureNote: Effective concentration data were fitted to a dose response curve(variable slope); the equation is r2=0.807, P<0.01.
2.2 对摄食的影响
随着甲维盐浓度升高,日本虎斑猛水蚤摄食率和滤水率均呈现降低的趋势(图3)。0.5 μg·L-1浓度组的摄食率和滤水率与对照组相比无显著差异(P>0.05)。当甲维盐浓度≥1 μg·L-1,实验组与对照组差异显著(P<0.01),均值明显降低。在5 μg·L-1组摄食率和滤水率达到最低,均值低至2 412 cells·(ind·h)-1和0.011 mL·(ind·h)-1,仅为对照组的29%和28%。

图3 甲维盐对日本虎斑猛水蚤摄食率和滤水率的影响注:a、b、c表示不同暴露浓度下的组间差异性,P<0.05;*P<0.05、**P<0.01表示各实验组与对照组的差异性;control代表对照组,solvent代表溶剂对照组;下同。Fig. 3 The effect of EMB on the grazing rate and filtering rate of T. japonicus Note: Different letters indicate a significant difference among EMB treatments at P<0.05; *P<0.05, **P <0.01 denote significant difference from the control; the same below.
2.3 对生化指标的影响
暴露在不同浓度的甲维盐下,日本虎斑猛水蚤体内的抗氧化酶SOD和GPx活性均出现显著的变化(P<0.05) (图4)。在一定浓度范围内,SOD和GPx活性随甲维盐浓度升高而升高,在超过一定浓度后,趋于平稳。其中,SOD活性在1.0~3.5 μg·L-1出现增长趋势,在3.5 μg·L-1最高,达到48.7 U·mg-1prot;GPx活性在0.5~1.0 μg·L-1上升明显,在1 μg·L-1最高,达到118.8 U·mg-1prot。两者分别在3.5~5.0 μg·L-1和1.0~5.0 μg·L-1趋于平缓。二者变化趋势显著正相关(r=0.746、P<0.05)。实验浓度范围内,CAT活性较对照组无显著变化(P>0.05)。
AChE与SOD、GPx具有相似的变化趋势,酶活性随着甲维盐浓度的升高而上升。在甲维盐浓度达到3.5 μg·L-1时,实验组AChE活性与对照组相比显著升高,达到2.4 U·mg-1prot,为对照组的1.4倍。且AChE与SOD、GPx活性的变化趋势呈显著正相关(AChE与SOD,r=0.733、P<0.05;AChE与GPx,r=0.541、P<0.05)。
2.4 对生殖发育的影响
F1和F2日本虎斑猛水蚤无节幼虫变态至桡足幼体CΙ期所需时间均为5~8 d,桡足幼体发育为成体的时间为6~10 d(图5)。在无节幼虫发育时间上,F1中0.05 μg·L-1和0.25 μg·L-1浓度组与对照组差异显著(P<0.05),F2未见实验组与对照组相比有显著性差异(P>0.05);在桡足幼体发育时间上,F1中0.5 μg·L-1浓度组相比对照组显著下降(P<0.05),F2中0.025 μg·L-1浓度组与对照组相比显著降低(P<0.05)。但日本虎斑猛水蚤的发育时间并未呈现随甲维盐浓度变化而规律性变化的趋势。无节幼虫的发育率随甲维盐浓度变化不大,但桡足幼体发育率明显低于无节幼虫,且有随甲维盐浓度升高而降低的趋势(图6)。未发育成功的个体表现出发育停滞的现象。在总发育率上,当甲维盐浓度≥0.05 μg·L-1时,日本虎斑猛水蚤发育率不断降低;当浓度达到0.5 μg·L-1时,发育率相较对照组显著降低(P<0.05);浓度达到2.5 μg·L-1,幼体全部死亡。F3为恢复世代,在发育时间上,无节幼虫变态至桡足幼体CΙ期仅有0.25 μg·L-1浓度组较对照组显著升高(P<0.05);桡足幼体到成体时期各实验组较对照组未显著变化(P>0.05)。F3发育率的变化趋势与F1、F2相同。
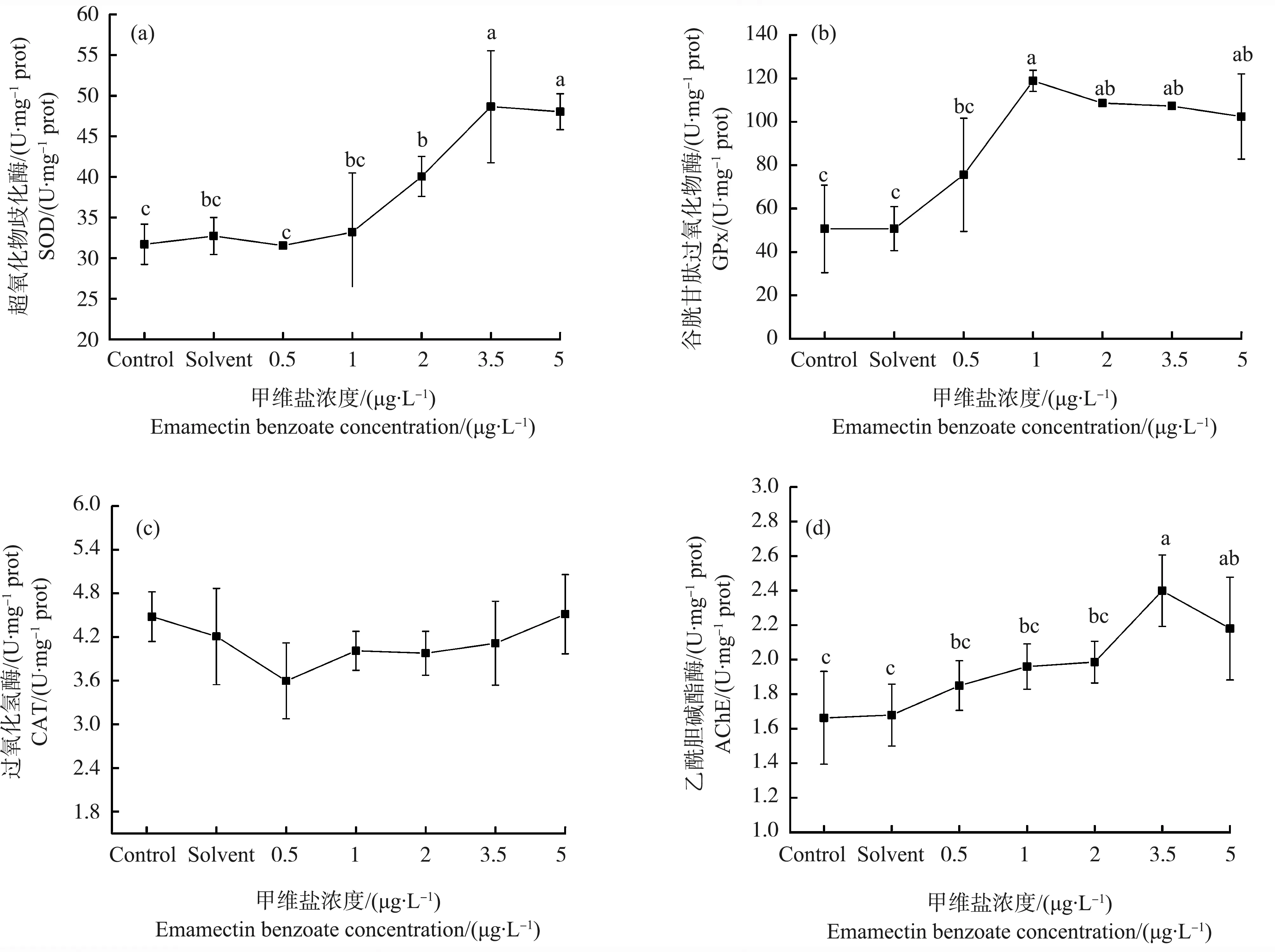
图4 甲维盐对日本虎斑猛水蚤生化指标的影响Fig. 4 The effect of EMB on the activities of the antioxidant enzymes of T. japonicusNote: SOD is superoxide dismutase; GPx is glutathione peroxidase; CAT is catalase; AchE is acetylcholinesterase.

图5 甲维盐对日本虎斑猛水蚤发育时间的影响注:F1、F2为暴露世代,F3为恢复世代。Fig. 5 Effect of EMB on the developmental time of T. japonicusNote: F1 and F2 were exposed to EMB, and F3 was recovered in sea water.
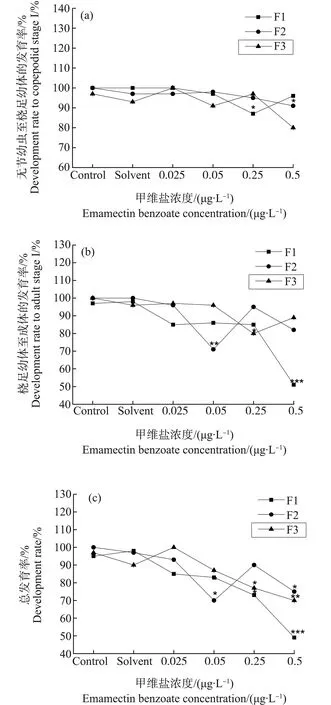
图6 甲维盐对日本虎斑猛水蚤发育率的影响注:***P<0.001表示各实验组与对照组的差异性。Fig. 6 Effect of EMB on the successful development rate of T. japonicusNote: ***P<0.001 denotes significant difference from the control.
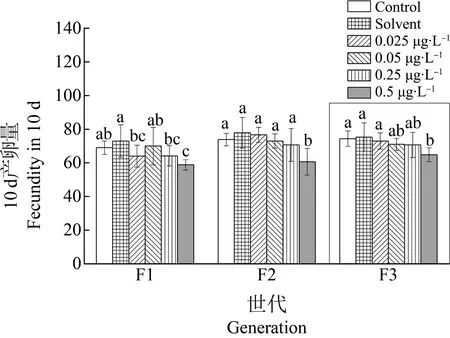
图7 甲维盐对雌性日本虎斑猛水蚤10 d孵化量的影响Fig. 7 Effect of EMB on the 10 day fecundity of female T. japonicus
3个世代雌性个体的10 d产卵次数均为3次,对照组和溶剂对照组产卵量的平均值在69~77个(图7)。当甲维盐浓度达到0.5 μg·L-1时,产卵量平均值在58~64个。F1、F2和恢复世代F3均可见甲维盐浓度达到0.5 μg·L-1时,总产卵量与对照组相比有显著性差异(P<0.05),明显降低。
对F1、F2和F3进行双因素方差分析(表1)可得:在无节幼虫、桡足幼体的发育时间和桡足幼体的发育率上,甲维盐浓度和世代存在交互关系。无节幼虫、桡足幼体的发育时间上,3代之间均有显著性差异(P<0.01);而桡足幼体的发育率上,F2、F3与F1有显著性差异(P<0.05),F2与F3之间没有显著性差异(P>0.05)。在无节幼虫的发育率、总发育率和10 d产卵量上,甲维盐浓度和世代不存在交互关系。其中,无节幼虫的发育率和总发育率对于世代的主效应差异不显著(P>0.05);10 d产卵量对于世代的主效应差异显著(P<0.05),且F2、F3与F1有显著差异(P<0.01),F2与F3之间没有显著性差异(P>0.05)。

表1 日本虎斑猛水蚤的生殖发育受甲维盐浓度和世代影响的显著性检验Table 1 Significance test displaying the effects of EMB treatment and generation on reproductive development of T. japonicus
注:t1、t2表示桡足类无节幼虫、桡足幼体的发育时间,r1、r2和r3表示桡足类无节幼虫、桡足幼体和整个发育过程的发育率,f表示10 d产卵量。
Note: t1, t2 represent the development time of nauplii stage and copepodite stage; r1, r2 and r3 represent the development rate from nauplii to copepodite, from copepodite to adult, and of the complete development process respectively; f represents the 10 day fecundity.
综合各个指标,F3并未表现出恢复迹象。
3 讨论(Discussion)
3.1 急性毒性影响
猛水蚤相比浮游桡足类通常具有较强的抵御环境变化的能力。例如,猛水蚤对硫化锌和束毛藻(Trichodesmiumspp.)毒素的耐受能力显著高于浮游桡足类[18-19]。本研究中甲维盐对日本虎斑猛水蚤雌性个体的96 h-LC50为7 156 μg·L-1,雄性为3 637 μg·L-1。衣晓燕[15]的研究表明,甲维盐对浮游桡足类火腿伪镖水蚤的96 h-LC50为22.9 μg·L-1,远远低于日本虎斑猛水蚤。猛水蚤对甲维盐的耐受能力显著高于浮游种类。甲维盐对寄生性桡足类Lepeophtheirusmugiloidis和雌性智利鱼虱的24 h-EC50比日本虎斑猛水蚤的3.5 μg·L-1高1~2个数量级,分别为34.2 μg·L-1和169.0 μg·L-1[7,20]。猛水蚤对甲维盐的敏感度比寄生性桡足类高。
甲壳动物对污染物的敏感度通常存在性别差异。如在鱼藤酮(rotenone)、多氯联苯(polychlorinated biphenyl Aroclor 1254)和多环芳烃(polycyclic aromatic hydrocarbons)暴露条件下,雄性猛水蚤比雌性敏感[21-23]。本研究也显示,雌性与雄性对甲维盐的耐受性存在差别,并与上述研究中猛水蚤不同性别对于外源污染物的敏感度类似。另外,也有研究表明,甲维盐暴露下,鲑疮痂鱼虱雌性比雄性更加敏感[24-25],不同物种雌雄个体对于甲维盐的敏感性可能存在差异。
3.2 甲维盐对桡足类摄食的影响
在本研究中,随着甲维盐浓度的增加,日本虎斑猛水蚤的摄食率和滤水率降低。暴露于3.5 μg·L-1甲维盐24 h后,日本虎斑猛水蚤出现部分个体趴底,运动能力明显下降的现象,而5 μg·L-1时,所有个体均趴底,无自主活动能力,这会严重影响到其摄食和滤水的效率。Willis和Ling[14]的研究表明,甲维盐暴露条件下,4种浮游桡足类也出现运动能力显著下降,无法摄食。甲维盐可能通过麻痹神经的作用[1-3],使桡足类无法摄食,抑制能量的摄入,影响正常的生命活动,对机体造成危害。
3.3 甲维盐对生化指标的影响
SOD、CAT和GPx是抗氧化防御系统中重要的抗氧化酶,对清除机体内活性氧,保护机体免受氧化损伤发挥着重要作用[26-27]。一般认为,受轻度毒物影响,SOD活性升高;而重度胁迫条件下,SOD活性下降,出现氧化损伤[28-29]。日本虎斑猛水蚤在Hg的胁迫下,SOD和GPx活性会随Hg浓度的升高先上升后下降[30];在三氯生(triclosan)的作用下,SOD活性随浓度的升高而升高[31]。本研究中,随着甲维盐浓度的升高,日本虎斑猛水蚤的SOD和GPx活性上升,并未出现下降。甲维盐激发了日本虎斑猛水蚤体内抗氧化防御系统SOD和GPx的应激反应,出现“毒物兴奋效应”[28],但甲维盐的最高浓度的胁迫也可能未超过日本虎斑猛水蚤防御机制的能力。不同的是,暴露在所有浓度的甲维盐中,日本虎斑猛水蚤CAT活性均未出现显著变化,可能的原因是本研究设置的浓度和测定时间没有达到CAT的诱导阈值,或者超过CAT的反应时间。日本虎斑猛水蚤暴露于最高浓度5 μg·L-124 h后,虽然行动能力下降,但抗氧化还原体系仅部分抗氧化酶被激发解毒,并未超过自身的防御能力。
AChE存在于绝大多数水生生物中,是连接感受器与神经肌肉的重要神经传递物质,通过催化乙酰胆碱,使其水解为乙酸和胆碱,维持神经冲动的正常进行[32-34]。AChE活性无论受到抑制还是诱导都会给生物体带来危害。有研究认为甲维盐会影响AChE的活性。在甲维盐的作用下,小鼠(Rattusnorvegicus)的AChE被显著抑制,活性降低[35]。在本研究中,暴露于甲维盐24 h对AChE活性的影响显著趋于诱导,可能导致桡足类神经冲动传递出现障碍,造成桡足类反应能力下降,行动迟缓,甚至麻痹死亡。
3.4 甲维盐对桡足类生殖发育的影响
日本虎斑猛水蚤的发育时间随甲维盐浓度变化无明显的变化规律,但发育率随甲维盐浓度的升高而降低,在0.5 μg·L-1甲维盐浓度下,F1、F2到成体的发育率都低于80%,F1仅为49%。衣晓燕[15]的研究也表明,随着甲维盐浓度的升高,火腿伪镖水蚤幼体的存活率和发育率呈下降趋势。甲维盐对日本虎斑猛水蚤产卵次数的影响并不明显;但在10 d产卵量上,暴露于0.5 μg·L-1的实验组与对照组相比在F1、F2均出现显著降低(P<0.05)。有研究表明,甲维盐对智利鱼虱的孵化率也有显著影响[36]。甲维盐可能使雌性桡足类为抵御不良状态而降低产卵量,从而抑制桡足类的繁殖能力,并影响桡足类幼体的生长发育,导致种群数量减少,进而影响群落结构和海洋生态系统功能。
甲维盐对桡足类的生存和繁殖力的毒害影响都是不可恢复的[14]。本研究表明,经两代甲维盐暴露后,在海水恢复处理下日本虎斑猛水蚤F3的发育率和孵化能力与F1、F2相比,并未出现恢复迹象。甲维盐对于桡足类的影响可由亲代传递给子代,可能不可恢复。在发育率和产卵量上,F2、F3与F1之间有显著性差异,而F2与F3差异不大,分析原因可能是慢性毒性世代F2相较F1出现一定的抗性,F3延续了这种抗性,尚未恢复正常的繁殖状态。
综上所述,日本虎斑猛水蚤对甲维盐的敏感度比寄生性桡足类高,耐受能力比浮游桡足类高;雄性的耐受能力比雌性低;暴露条件下,日本虎斑猛水蚤的运动能力、摄食率和滤水率受到严重影响,而SOD和GPx活性被激发,AChE被显著诱导,CAT活性无显著变化;并且甲维盐会降低日本虎斑猛水蚤的发育率和产卵能力。甲维盐可能会减小桡足类的种群规模,影响群落结构和食物网功能。如何合理使用甲维盐等农药,既满足农业生产和水产养殖的需要,又尽可能减少对海洋生态环境的影响有待进一步探讨。
——以“不同咖啡因饮料对水蚤心率的影响”为例

