石油水溶性成分对褶皱臂尾轮虫(Brachionus plicatilis)生殖、发育及种群动态的影响
王嘉仪,沙婧婧,张晖,周斌,刘春辰,王悠,*
1. 中国海洋大学海洋生命学院,青岛 266003 2. 海洋生态与环境科学功能实验室,青岛海洋科学与技术试点国家实验室,青岛 266237 3. 国家海洋局北海环境监测中心,青岛 266033 4. 国家海洋局海洋溢油鉴别与损害评估技术重点实验室,青岛 266033
随着世界石油需求不断增长,石油的勘探、开采和运输活动日益频繁,海上油田溢油、油轮溢油事故频发,海洋原油污染对海洋环境与海洋生态系统所造成的破坏成为全球关注的重点。比如,2010年发生的墨西哥湾漏油事件被称作“前所未有的生态灾难”,海鸟、鱼类等动物大规模死亡,原油分散液会影响浮游植物和动物的生物群落,对鱼类的胚胎和心脏发育造成影响,对哺乳动物造成生存威胁,溢油还造成该地沿海沼泽地损失率大幅增加,珊瑚礁表现出受损的状态[1-4];2011年渤海湾“蓬莱19-3油田溢油事故”导致约870 km2海水水质降至劣Ⅳ类海水,海洋生物栖息环境遭到破坏,污染海域的浮游生物种类和多样性降低,海洋生物幼体如鱼卵和仔稚鱼受到损害,底栖生物体内石油烃含量明显升高[5],对渤海海域生态系统的平衡与稳定危害极大。石油的水溶性成分(water-accommodated fraction, WAF)所含的有效毒性成分比分散液和成品油高[6],是引起海洋生物毒性效应的主要组分。
海洋浮游动物是海洋生态系统的重要组成部分,在海洋生态系统的物质循环与能量流动中起到承上启下的关键作用,其种群动态与群落结构变化直接或间接地影响着各营养级的节律、规模以及初级生产力和生物资源的最终归宿,而生殖、发育又是决定该变化的关键过程[7]。目前在国内外尚未见到系统研究石油水溶性成分对浮游动物生殖与发育影响的报道。褶皱臂尾轮虫(Brachionusplicatilis)是我国常见的浮游动物,可以分布在由温带到热带的半咸水和海水水体中,是生态毒理学实验中理想的模式生物。因此,本文选用褶皱臂尾轮虫为受试生物,在实验生态条件下研究石油的水溶性成分(WAF)对其生长、生殖及发育的影响。研究将为评估海洋溢油污染对近海生态系统的潜在威胁与影响提供基础的研究依据。
1 材料与方法(Materials and methods)
1.1 褶皱臂尾轮虫的培养
所用褶皱臂尾轮虫由其休眠卵孵化而得,孵化条件依据本实验室前期建立的孵化体系[8-9]。将褶皱臂尾轮虫休眠卵投置于装有灭菌海水的三角瓶内,于光照培养箱内恒温培养,温度(25±1) ℃,光照周期12 h∶12 h,光照强度60 μmol·(m2·s)-1,期间投喂密度为1.0×106cells·L-1的小球藻(Chlorellasp.)。整个孵化时间大约持续3~7 d。孵化后,挑选活泼健壮的褶皱臂尾轮虫非混交卵雌体,在光照培养箱内培养3代后备用,培养条件同孵化条件。
1.2 WAF的制备及浓度测定
原油取自胜利油田,且置于阴凉处避光保存。原油与过滤灭菌后的海水按体积比1∶9混合,室温下用磁力搅拌机连续搅拌24 h,然后将混合液转移至分液漏斗中静置4 h,分离下层水相即为原油WAF母液,制备过程注意避光。母液置于冰箱(4 ℃)避光保存,每2 d重新制备。WAF母液中石油浓度依据海洋监测规范(GB17378.4—2007)用分光光度法来测定,根据原油标准曲线(图1),通过测定母液在225 nm的OD值换算而成。在本实验条件下,测得原油WAF母液的浓度为5.0 mg·L-1。
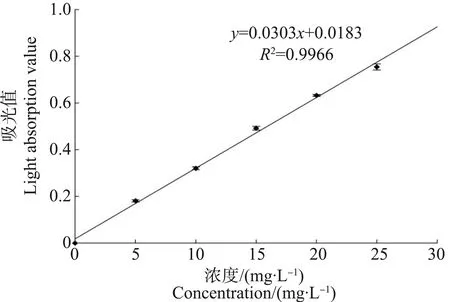
图1 原油标准曲线Fig. 1 The standard curve of crude oil
1.3 WAF对褶皱臂尾轮虫的急性毒性效应
5.0 mg·L-1为本实验条件下得到的WAF最大浓度,设为本实验的浓度上限。在预备实验的基础上设置5个WAF浓度,分别为0.5、1.0、2.0、4.0和5.0 mg·L-1,同时设置空白对照组;每个实验组设3个平行(n=3)。从驯养的轮虫中挑选出活泼健壮的带卵雌体,收集0~2 h所产的幼虫(龄期<2 h)进行实验。实验在24孔加盖培养板中进行,每孔放入10只活泼健壮的轮虫幼体,并注入500 μL不同浓度的WAF、500 μL小球藻饵料。将培养板置于恒温培养箱中培养,温度(25±1) ℃,每24 h更换孔内溶液。在24、48、72和96 h时用解剖镜观察并记录个体死亡数、存活数。采用概率单位法计算种群增长的半数有效抑制浓度(EC50)。
褶皱臂尾轮虫生长抑制及死亡的判断标准依据美国实验材料学会制定的轮虫急性毒性试验标准指南[10],即褶皱臂尾轮虫沉于24孔板底部、肢体及内脏活动比较微弱则为受到抑制;纤毛和体内运动停止、内部组织皱缩、轮盘缩回、肢体及内脏活动完全丧失则视为死亡。
1.4 WAF对褶皱臂尾轮虫生殖与发育的影响
在急性毒性试验的基础上设置3个WAF浓度,分别为1.0、3.0和5.0 mg·L-1,同时设置空白对照组;每个实验组设3个平行(n=3)。其余实验体系的构建依据1.3中所述进行。在实验最初的72 h内,每4小时观察一次,72 h后每隔8 h观察一次,每次观察时间记为x年龄(h),记录该年龄的个体存活数、死亡数、产卵数以及产幼数,并将新生幼体和死亡个体及时移出。实验持续到所有轮虫个体全部死亡为止。
依据收集到的数据,应用动态生命表方法获得每个平行组的特定年龄存活率(lx)和特定年龄繁殖率(mx),其定义如下:(1)特定年龄存活率(lx)为x年龄组开始时存活个体的百分数; (2)特定年龄繁殖率(mx)为x年龄组平均每个个体所产的雌性后代数。
在上述研究的基础上依据下列公式计算种群的各项参数,从而建立轮虫生命表[11-13]。
R0=∑(lxmx)
T=∑(xlxmx)/R0
rm=lnR0/T
E0=(∑lx)/l0
λ=erm
式中:R0、rm、T、E0和λ分别为净生殖率、内禀增长率、世代时间、生命期望和周限增长率,l0为lx(x=0)。
用本实验室构建的方法研究WAF对褶皱臂尾轮虫发育的影响[9,14]。以目标生物生殖期周期长短,以及生殖前期(pre-reproductive phase)、生殖期(reproductive phase)和生殖后期(post-reproductive phase)的时间分配变化作为检测指标开展研究。
1.5 统计分析
以Sigmaplot 12.0作图,SPSS 22.0对数据进行统计方差分析和回归分析,采用ANOVA方法分析WAF暴露组与空白对照组之间的差异,P<0.05、P<0.01表示差异显著。
2 结果(Results)
2.1 急性毒性效应
处理组与对照组中的种群密度随着胁迫时间的延长均呈现出逐渐增加的变化趋势。与对照组相比,低浓度组(0.5和1 mg·L-1)的种群密度在实验周期内均高于对照组,但未达到显著水平(P≥0.05);其他处理组的种群密度均低于对照组,表现出比较明显的生长抑制作用,且浓度越高抑制作用越显著(P<0.05) (图2)。EC50的计算结果显示,胁迫24 h内未出现半数有效抑制现象,48、72和96 h的EC50分别为5.42、4.81和4.39 mg·L-1(表1),说明WAF对种群增长的抑制作用随着胁迫浓度的增高而不断增强。
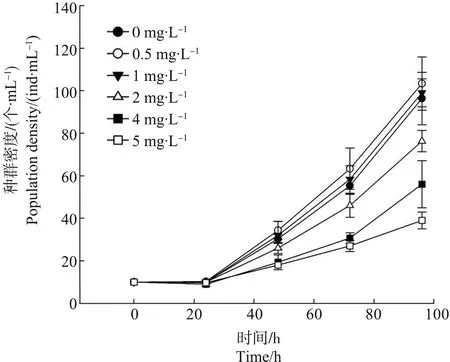
图2 不同浓度的石油水溶性成分(WAF)对褶皱臂尾轮虫种群密度增长的影响Fig. 2 Effects of water-accommodated fraction (WAF) on the population density of B. plicatilis
2.2 WAF对褶皱臂尾轮虫生殖和发育的影响
WAF对褶皱臂尾轮虫的特定年龄存活曲线显示,不同浓度的WAF能显著影响褶皱臂尾轮虫的特定年龄存活率。对照组得到轮虫的特定年龄存活率的一般模式,在140 h后特定年龄存活率开始下降,最长生存时间约为410 h。与对照组相比,低浓度组(1 mg·L-1)的存活率开始下降的时间稍早于对照组,但下降趋势较缓,最长生存时间与对照组基本相同。随着WAF浓度升高,轮虫存活率开始下降的时间提前,曲线走势开始陡峭,最长生存时间逐渐缩短。5 mg·L-1的WAF处理组的存活率在75 h开始下降,最长生存时间为348 h (图3)。

表1 WAF对褶皱臂尾轮虫的急性毒性实验结果Table 1 Results of acute toxicity of WAF on B. plicatilis
WAF对褶皱臂尾轮虫的特定年龄繁殖曲线显示,不同浓度的WAF能影响褶皱臂尾轮虫的特定年龄繁殖率。对照组的正常轮虫雌体一生中有3~5个生殖峰,生殖高峰大多出现在轮虫孵化出生后的74~135 h,繁殖达到最高峰时特定年龄繁殖率达到1.8,直至虫龄约15 d时完全停止繁殖(图4)。与对照组相比,1和3 mg·L-1处理组的特定年龄繁殖率最大值略有下降。高浓度组(5 mg·L-1)的特定年龄繁殖率显著降低,生殖高峰不明显,约在12 d完全停止繁殖,繁殖期缩短。
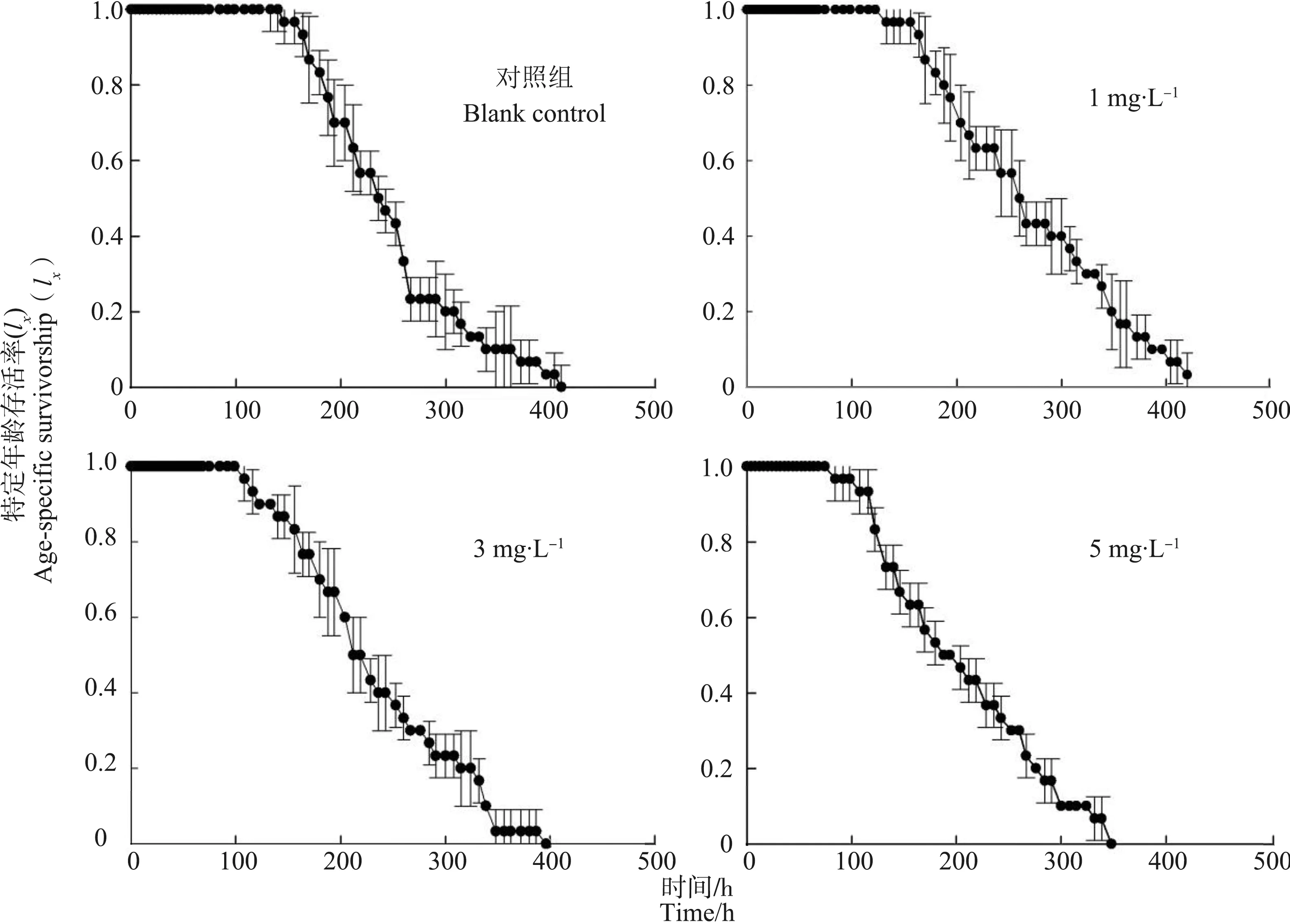
图3 不同浓度WAF作用下的褶皱臂尾轮虫特定年龄存活率(lx)曲线Fig. 3 Age-specific survivorship curves of B. plicatilis in relation to different concentrations of WAF
在上述结果的基础上建立不同浓度WAF胁迫条件下褶皱臂尾轮虫的生命表(表2)。结果显示,随着WAF浓度的升高,净生殖率(R0)、内禀增长率(rm)、周限增长率(λ)和生命期望(E0)均呈现出先升高后降低的变化趋势,最高值均出现在1 mg·L-1浓度组;随着WAF浓度继续升高,R0、rm、λ和E0均逐渐降低,呈现比较显著的浓度-效应变化趋势,至5 mg·L-1时降至最低(P<0.05)。但世代周期(T)逐步延长,至5 mg·L-1时达到最高值(P<0.05)。rm和λ的变化较其他指标更灵敏,可以用以指示或评价WAF胁迫的指示指标。

图4 不同浓度WAF作用下的褶皱臂尾轮虫特定年龄繁殖率(mx)曲线Fig. 4 Age-specific fecundity curves of B. plicatilis in relation to different concentrations of WAF

表2 暴露于不同浓度WAF的褶皱臂尾轮虫的生命表参数Table 2 Demographic parameters of B. plicatilis exposed to different concentrations of WAF
注:R0、T、rm、E0和λ为净生殖率、世代周期、内禀增长率、生命期望和周限增长率。
Note:R0,T,rm,E0andλrepresent net reproductive rate, generation time, intrinsic growth rate, life expectancy and finite rate of increase, respectively.
WAF会对褶皱臂尾轮虫的发育产生影响。如表3所示,1 mg·L-1的WAF胁迫能延长褶皱臂尾轮虫的平均寿命与生殖期,缩短胚胎发育时间;之后随着WAF胁迫浓度的升高,褶皱臂尾轮虫的平均寿命缩短,胚胎发育与生殖前期延长,生殖期与生殖后期缩短。以最高浓度组5 mg·L-1为例,与对照组相比,胚胎发育期与生殖前期延长了39.1%和32.6%,生殖期、生殖后期与平均寿命分别减少了32.4%、35.6%和26.8% (P<0.05)。结果说明,WAF胁迫能延迟褶皱臂尾轮虫个体的发育,导致其进入生殖期的时间滞后、生殖期的时间缩短。
3 讨论(Discussion)
不同浓度WAF的急性毒性胁迫对褶皱臂尾轮虫的种群增长影响不同。一方面,低浓度(0.5和1 mg·L-1)的WAF在96 h内能促进褶皱臂尾轮虫的种群增长,但未达到显著水平(P≥0.05),而较高浓度组的WAF(3和5 mg·L-1)则对种群增长产生较显著的抑制作用,且随着浓度的增大,毒性效应增强。另一方面,在WAF胁迫24 h内未出现种群增长的半数有效抑制现象,之后的EC50呈现出48 h>72 h>96 h的变化情况,说明WAF的毒性与其在生物体内的蓄积时间密切相关,蓄积时间越长毒性越大。石油烃的毒性主要是由低分子烷烃和芳香烃的组成及其含量所决定,其中毒性最大的是微量溶于水的芳香烃类化合物,如萘、蒽、芘和苯并芘。在污染产生的较短时间内,中小分子量的多环芳烃,如萘、菲、芘和苯并芘是对海洋生物危害最大的4种成分[15]。这些污染物通常会使生物体内产生氧化胁迫,影响生长、代谢和繁殖等多个生命过程。例如,苯并芘会抑制三角褐指藻的生长,导致其脂质过氧化损伤明显[16];还会导致栉孔扇贝的精巢和卵巢发育缓慢,滤泡有空隙,出现大量与配子重吸收有关的血细胞,卵母细胞大量退化,精子数量降低[17]。海水中的原油可导致双齿围沙蚕脂质过氧化,诱导体内抗氧化酶超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽巯基转移酶(GST)的活性升高,说明双齿围沙蚕体内启动了消除氧自由基和解毒的一系列生化响应[18]。本课题组的前期研究结果也表明,污染物胁迫及环境变化均会导致生物体内活性氧含量增加,氧化胁迫程度加剧,并且氧化胁迫加剧与生物损伤之间存在明显的正相关性[19-21],因此,推测WAF对褶皱臂尾轮虫种群动态及生长的抑制作用可能与WAF产生的氧化胁迫有关。
另一方面,生殖变化或损伤是影响褶皱臂尾轮虫种群动态变化的根本原因。本研究结果表明,WAF胁迫下褶皱臂尾轮虫的生殖作用受到影响。生殖期的变化说明褶皱臂尾轮虫个体生殖过程受到影响:WAF胁迫能延迟轮虫个体的发育,导致其进入生殖期的时间滞后,生殖期的时间缩短。生殖毒性回应在种群水平上可以表现为生殖率的下降。随着WAF浓度的增加,褶皱臂尾轮虫的特定年龄繁殖率(mx)不断下降,高浓度WAF能够使轮虫的净生殖率(R0)、内禀增长率(rm)、周限增长率(λ)和生命期望(E0)降低,这说明褶皱臂尾轮虫的无性生殖过程受到影响。不少研究表明,石油类污染物能够影响海洋生物的生殖、发育过程。例如,WAF能够延迟斑马鱼胚胎发育和孵化,导致发育停止或畸形[22]。萘会影响轮虫的平均寿命,使其胚胎发育期缩短,净生殖率下降[23];并会导致火腿许水蚤的存活率及产卵率降低,卵囊脱落,进而导致种群衰退[24]。而本课题组前期的研究表明,持久性有机污染物多溴联苯醚(PBDEs)的亚急性胁迫能损伤褶皱臂尾轮虫的卵黄腺,并导致轮虫体内活性氧含量与Ca2+水平增加,使其体内产生氧化损伤[14,19,25],并推测活性氧(ROS)介导的氧化损伤与凋亡是导致其生殖毒性的根本原因。另一方面,PBDEs胁迫会诱导褶皱臂尾轮虫的生殖作用产生策略性响应,从无性生殖向有性生殖转变[9]。笔者期望进一步探讨WAF胁迫下褶皱臂尾轮虫生殖作用的响应机制,聚焦于轮虫的氧化损伤与生殖毒性的关系以及轮虫生殖策略的变化。

表3 暴露于不同浓度WAF的褶皱臂尾轮虫各主要发育时段的历时Table 3 Developmental period duration of B. plicatilis exposed to different concentrations of WAF
本研究在褶皱臂尾轮虫中观察到了WAF的低剂量兴奋效应,随着WAF浓度的升高,净生殖率(R0)、内禀增长率(rm)、周限增长率(λ)和生命期望(E0)均呈现出先升高后降低的变化趋势,最高值均出现在1 mg·L-1浓度组。Sarma等[26]同样在轮虫中发现了低剂量兴奋效应现象,在Cu2+胁迫下,轮虫的种群增长出现低浓度刺激,高浓度抑制的现象。刘星辰和鞠青[27]发现,低浓度WAF对三角褐指藻和小球藻的生长有轻微的促进作用,高浓度的WAF通过影响浮游植物的生理过程和生化组成,降低其细胞密度。低浓度的WAF对轮虫有刺激效应,其原因可能是轮虫体内的自由基含量升高,从而促进其生理生化代谢及繁殖;且低浓度WAF还可促进轮虫饵料藻的生长,进而促进轮虫的生长。
在生命表的变量当中,与繁殖有关的参数通常比存活率对毒物更敏感[28]。有研究发现,在相同污染物胁迫条件下轮虫的存活率和世代时间(T)与对照组相比变化不大,但其净生殖率(R0)和内禀增长率(rm)却受到明显抑制[29];在毒物慢性毒性的胁迫下,观察到在一些轮虫和大型溞(Daphniamagna)种群的净生殖率降低(R0)[30-32]。这些研究结果与本文的结果一致。因此,净生殖率(R0)和内禀增长率(rm)可以用作灵敏指示褶皱臂尾轮虫响应外源胁迫的标志指标。

