短波紫外线照射和60Co-γ辐照处理对大樱桃贮藏品质的影响
田竹希,龙明秀,李咏富,何扬波,梁 倩,石 彬
(贵州省农业科学院现代农业发展研究所,贵州 贵阳 550006)
大樱桃原产于欧洲和西亚等地,为蔷薇科樱桃属落叶乔木果树,成熟期集中在4月下旬至5月中下旬,其作为一种高档精品水果,深受消费者喜爱,对调节鲜果的市场供应有着特殊的作用,素有“春果第一枝”的美誉。由于大樱桃果实皮薄肉软且汁多,因此极易腐烂、不耐贮藏,如不采取有效的贮藏保鲜手段,采后几天内即会出现软化、枯梗、褐变、腐烂和风味变淡等现象,失去商品价值和食用品质损失[1-2]。不耐贮性已成为限制大樱桃产业健康发展的主要障碍。
短波紫外线(short-wave ultraviolet light,UV-C)波长介于200~280 nm范围,是一种无化学污染的物理保鲜方法,可致水果表面微生物DNA损伤[3],诱导不同水果产生抗病性反应[4],可通过控制不同水果腐烂、延迟果实软化等[5-6]作用来提高其食用安全性和保鲜效果。研究表明,经UV-C处理可以诱导产生萜类、酚类、多胺、抗坏血酸和叶酸等具有抗氧化、抗真菌作用的生物活性物质[7-8],能较好地减缓果蔬品质损失,延长货架期。60Co-γ射线辐照是一种典型的冷杀菌保鲜技术,通过利用60Co放射源产生一定剂量的γ射线处理果蔬,使其微生物发生一系列物理、化学反应,同时抑制其呼吸作用、内源乙烯合成和过氧化物酶(peroxidase,POD)活性,从而达到延缓果蔬衰老腐败,延长贮藏时间的目的[9]。已有大量研究表明,60Co-γ射线辐照可以有效保持草莓、葡萄、蓝莓、猕猴桃等水果的食用品质,显著减少病原菌数量,抑制腐败,延长贮藏保鲜期[10-13]。
‘玛瑙红'樱桃是贵州省培育出的大樱桃新品种,果形椭圆,果色鲜红,果肉厚重,是大樱桃中的优良品种。因此本实验以‘玛瑙红'樱桃为试材,研究不同剂量UV-C照射与60Co-γ射线辐照处理对大樱桃果实理化营养指标及果皮超微结构的影响,以期延长大樱桃采后贮藏期,为解决其采后品质劣变问题提供参考依据。
1 材料与方法
1.1 材料与试剂
‘玛瑙红'樱桃采摘于贵阳市乌当区下坝乡岩山村,于冷链下3 h内运回实验室,挑选果型大小一致、无病虫害、无机械损伤、无软烂且带果柄的新鲜果实进行处理。
甲醇、浓盐酸、磷酸、愈创木酚、戊二醛、锇酸、乙醇、醋酸异戊酯、柠檬酸铅等均为国产分析纯;超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)检测试剂盒 苏州科铭生物技术有限公司。
1.2 仪器与设备
60Co-γ辐照源 贵州金农辐照科技有限责任公司;TMS-Pro质构仪 美国FTC公司;紫外-可见分光光度计尤尼柯科学仪器有限公司;SU8010扫描电子显微镜、H7650透射电子显微镜 日本日立公司;EM UC7超薄切片机 德国徕卡公司;PAL-1B1便携式手持式折光仪日本Atago公司;H1850R离心机 湘仪离心机仪器有限公司;低密度聚乙烯(low density polyethylene,LDPE)保鲜袋(30 cm×21 cm,单层膜厚41.2 μm) 义乌市胜昌塑料制品有限公司。
1.3 方法
1.3.1 UV-C处理
以紫外杀菌灯管(253.7 nm,20 W)作为UV-C照射源。用UVC-254型UV-C强度计测得距紫外灯管正下方20 cm处的紫外照射强度为228 μW/cm2,对样品分别进行3 个全程时间梯度的照射处理(600、900、1 200 s),根据全程照射时间确定照射剂量(式(1))分别为1.37、2.05、2.74 kJ/m2,照射时保证果实均匀照射。每个剂量处理重复3 次。照射结束后,及时装入已消毒杀菌的LDPE袋中,每袋质量控制在(250±1)g,于4 ℃冷库贮藏。每5 d取样测定相应指标,每个指标从不同袋中取样重复测定3 次。
照射剂量/(kJ/m2)=照射时间/s×照射强度/(μW/m2)×10-5(1)
1.3.260Co-γ辐照处理
将挑选好的大樱桃果实放入已消毒杀菌的LDPE袋中,每袋质量控制在(250±1)g,设置3 个梯度辐照处理(0.75、1.50、2.25 kGy),每个剂量处理重复3 次,于贵州金农辐照科技有限责任公司进行60Co-γ辐照处理。辐照结束后,于4 ℃冷库贮藏。每5 d取样测定相应指标,每个指标从不同袋中取样重复测定3 次。
1.3.3 对照处理
将挑选好的大樱桃果实放入已消毒杀菌的LDPE袋中,每袋质量控制在(250±1)g,于4 ℃冷库贮藏。每5 d取样测定相应指标,每个指标从不同袋中取样重复测定3 次。
1.3.4 指标测定
1.3.4.1 好果率的测定
以果实无损伤、无软烂、无凹斑、无长霉、具有商品性和可食性为好果判定标准。随机抽取一定数量的大樱桃果实,记录大樱桃总果数和好果数,按式(2)计算好果率。
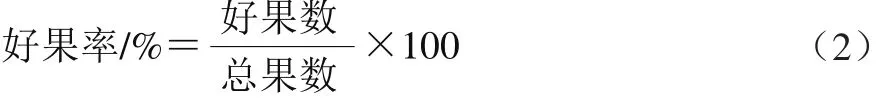
1.3.4.2 质量损失率的测定
每个剂量处理预留3 袋固定作为质量损失率测定的样品,采用称质量法,按式(3)[14]计算不同处理条件下大樱桃的质量损失率。

式中:m为大樱桃初始质量/g,mn为大樱桃第n天时的质量/g。
1.3.4.3 质构特性
采用TMS-Pro质构仪进行测试。测试参数为:水果挤压模式,选择直径为3 cm的不锈钢探头,起始力为0.038 N,形变量为50%,测试速率为60 mm/s,回程距离为21 mm。每个处理分别随机选取30 粒整果带皮测定,结果取平均值。测试指标包括硬度、胶黏性、咀嚼性、弹性。
1.3.4.4 可溶性固形物质量分数的测定
随机选取处理后的大樱桃果实20 个,经打浆后,用4 层纱布过滤浆液,吸取0.3 mL滤液,采用PAL-1B1手持式折光仪测定可溶性固形物质量分数,每个处理重复测定3 次,取其平均值。
1.3.4.5 花青素含量的测定
花青素提取:称取4.0 g果肉组织,加入少许经预冷的1% HCl-甲醇溶液,在冰浴条件下研磨匀浆后,转入20 mL刻度试管中。用1% HCl-甲醇溶液冲洗研钵,一并转移到试管中,定容至刻度,混匀,于4 ℃避光提取2 h,期间摇动数次,然后过滤,收集滤液待测[15]。
测定:以1% HCl-甲醇溶液作空白参比调零,取滤液分别于波长600 nm和530 nm处测定溶液光密度值,重复3 次。花青素含量以每克果肉在波长530 nm和600 nm处的光密度值之差表示,即ΔOD/g。
1.3.4.6 POD与SOD活力的测定
粗酶液制备:称取4 g去皮果肉,加0.4 g聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)于5 mL 0.2 mol/L磷酸缓冲液(pH 6.4)中,冰浴研磨,4 ℃冰冻离心机13 000×g离心30 min,取上清液备用。
POD活力测定:将0.5 mL粗酶提取液加入2 mL体积分数0.3%愈创木酚(用0.2 mol/L、pH 6.4的磷酸缓冲液配制)中,在30 ℃水浴中平衡5 min,然后加入1 mL体积分数0.3% H2O2(用0.2mol/L、pH 6.4的磷酸缓冲液配制)混匀,1 min后扫描1 min内460 nm波长处光密度值变化,重复3 次,酶活力以每克鲜质量样品每分钟OD460nm的变化值表示[16]。
SOD活力测定:参照SOD试剂盒使用说明测定。
1.3.4.7 MDA含量测定
参照MDA试剂盒使用说明测定。
1.3.4.8 果皮细胞超微结构观察
分别对新鲜大樱桃和贮藏至第20天的0.75 kGy、1.37 kJ/m2及对照组果实取样,进行果皮细胞超微结构观察。
前处理:用解剖刀切取赤道面长约4 mm、宽约3 mm的果皮,于2.5%的戊二醛溶液中4 ℃固定过夜。固定结束后,用pH 7.0(0.1 mol/L)的磷酸缓冲液漂洗样品3 次,于1%锇酸溶液中固定样品1~2 h,再用pH 7.0(0.1 mol/L)的磷酸缓冲液漂洗样品3 次,接着用乙醇溶液进行梯度脱水。
扫描电子显微镜观察:前处理样品用体积比为1∶1的乙醇与醋酸异戊酯的混合液浸泡30 min,再于纯醋酸异戊酯中放置过夜。经临界点干燥和金属离子溅射仪镀铂膜后,置于SU-8010扫描电子显微镜下观察,并选取有代表性视野进行拍照。
透射电子显微镜观察:前处理样品用纯丙酮以及Spurr包埋剂与丙酮混合液分别进行渗透处理后,将样品包埋起来,70 ℃加热过夜,即得到包埋好的样品。样品经超薄切片机切片后,于柠檬酸铅溶液和醋酸双氧铀50%乙醇饱和溶液中各染色5~10 min,即可在H-7650透射电子显微镜中观察,并选取有代表性视野进行拍照。
1.4 数据统计分析
所得数据采用Origin 2016软件进行制图,并采用SPSS软件进行Duncan's多重差异显著性分析法,P<0.05表示差异显著。
2 结果与分析
2.1 UV-C与60Co-γ辐照处理对大樱桃好果率的影响
好果率是反映果实耐贮性的重要指标之一。大樱桃采后易受机械损伤和微生物侵染,导致腐败变质。由图1可知,随着贮藏时间的延长,不同处理组的好果率均呈现下降趋势。贮藏0~15 d时,2.25 kGy60Co-γ辐照组好果率迅速下降并显著低于对照组(P<0.05),可能是因为高剂量辐照产生大量自由基,对果实细胞造成一定程度的损伤,为微生物繁殖提供了良好条件[17]。这期间,低剂量1.37 kJ/m2与0.75 kGy处理组效果明显,到第15天时可使好果率维持在50%以上,显著高于对照组45.09%(P<0.05),且0.75 kGy组好果率显著高于UV-C 1.37 kJ/m2处理组(P<0.05)。第20天时,60Co-γ辐照处理组好果率迅速下降,1.37 kJ/m2UV-C处理组依然显著高于其他处理组(P<0.05),但每组好果率均已低于50%。因此,大樱桃贮藏至15 d时能保持较好的好果率,并以0.75 kGy60Co-γ辐照处理的效果最好,可有效延缓果实腐败,15 d后基本已失去商品价值。
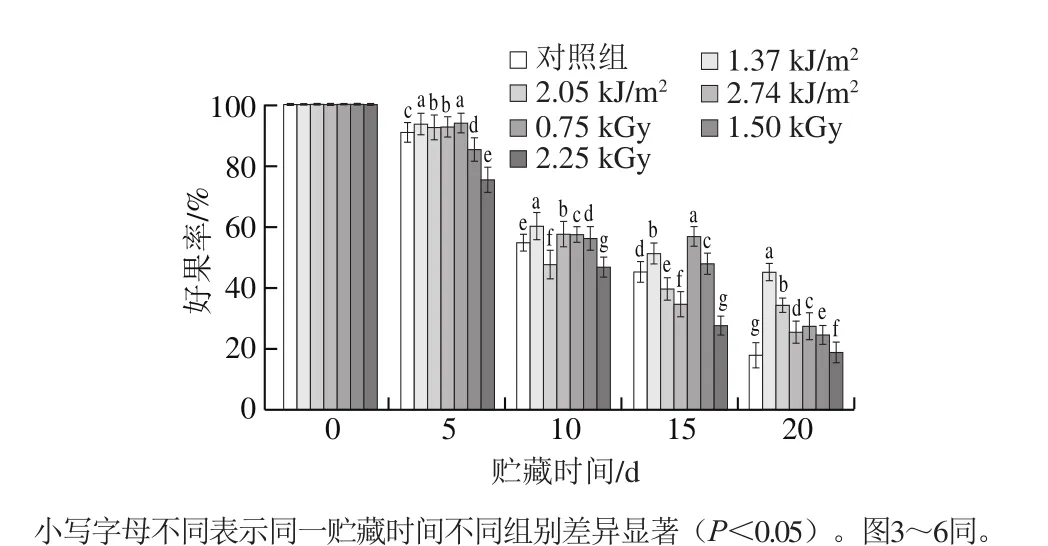
图1 UV-C与60Co-γ辐照处理对大樱桃果实好果率的影响Fig. 1 Effects of UV-C and 60Co-γ irradiation treatments on marketable fruit percentage of cherries
2.2 UV-C与60Co-γ辐照处理对大樱桃质量损失率的影响

表1 UV-C与60Co-γ辐照处理对大樱桃果实质量损失率的影响Table 1 Effects ofUV-C and 60Co-γ irradiation treatments on mass loss percentage of cherry fruit%
由表1可知,0~15 d贮藏期间,UV-C组与60Co-γ辐照组质量损失率均低于对照组(P<0.05),两种处理间差异不显著。随着贮藏时间的延长,各处理组质量损失率逐渐接近,但整体质量损失率不超过0.5%。第15~20天时,UV-C组质量损失率与对照组差异不明显(P<0.05),60Co-γ辐照组质量损失率显著低于UV-C处理和对照组(P<0.05),且辐照剂量与质量损失率呈正相关关系,以0.75 kGy剂量处理的果实质量损失率最低。由此可见,贮藏前期UV-C和60Co-γ辐照均能有效减少大樱桃果实质量损失,贮藏末期60Co-γ辐照的效果优于UV-C。
2.3 UV-C与60Co-γ辐照处理对大樱桃质构参数的影响

表2 UV-C与60Co-γ辐照处理对大樱桃果实硬度、胶黏性、咀嚼性和弹性的影响Table 2 Effects of UV-C and 60Co-γ irradiation treatments on firmness,gumminess, chewiness and springiness of cherry fruit
从表2中可以看出,贮藏前期(0~5 d),对照组和各处理组硬度呈现下降趋势,60Co-γ辐照组下降速率明显高于UV-C组,各处理间差异显著(P<0.05);第5天时,硬度大小表现为:UV-C组>对照组>60Co-γ辐照组(P<0.05)。表明贮藏初期UV-C处理比60Co-γ辐照能更好地保持硬度,这可能与UV-C照射使细胞壁降解酶有关基因FaEXP1、FaEXP2、FaEXP5转录减少有关[18]。贮藏5~10 d时,UV-C组呈现下降趋势,而60Co-γ辐照组和对照组均呈上升趋势;且2.25 kGy组的硬度持续上升至贮藏末期。这种现象在蓝莓保鲜中也曾有报道[9],可能是由于高剂量60Co-γ辐照使果实中多胺类物质含量升高,并产生类似于钙离子的效果,和果胶酸及其他多糖的交联性提高,从而削弱了细胞壁降解酶的降解作用[19]。可见贮藏末期,60Co-γ辐照较UV-C照射能更有效地延缓大樱桃果实硬度下降。
果实胶黏性反映果肉细胞间的黏着作用[20]。贮藏期间,胶黏性明显增大或减少均对果实口感和品质不利,以保持原有水平,变化波动较小为宜。由表2中所示,整个贮藏期间,UV-C组维持胶黏性效果好于60Co-γ辐照组(P<0.05)和对照组,60Co-γ辐照组的胶黏性显著低于UV-C组和对照组,尤其是中高剂量组(1.50、2.25 kGy)始终维持在较低水平。这可能与高剂量辐照加剧果实膜脂过氧化进程有关。
果实咀嚼性综合反映了果实对咀嚼的持续抵抗作用[20]。与胶黏性一样,贮藏期间胶黏性明显增大或减少均对果实口感和品质不利,以保持原有水平、变化波动较小为宜。从表2可以看出,5~20 d时,大樱桃果实咀嚼性变化趋势和胶黏性、硬度相似,对照组、UV-C组、60Co-γ辐照组分别表现为:先上升后减少再回升,先减少后回升,先减少后回升。各组在第20天时均出现回升趋势,可能是组织细胞失水与果实发生轻微木质化的结果。总体而言,0.75 kGy组的果实咀嚼性在贮藏期间波动变化较小,且末期与初始值最接近,维持咀嚼性的效果好于UV-C组(P<0.05)和对照组(P<0.05)。
弹性反映了贮藏过程中果实受外力作用后恢复形变的能力[20]。与胶黏性一样,贮藏期间胶黏性明显增大或减少均对果实口感和品质不利,以保持原有水平,变化波动较小为宜。如表2所示,贮藏过程中各处理组的弹性均呈现不断降低趋势。第5天时,各组弹性大小变化与硬度类似,依次表现为:UV-C组>对照组>60Co-γ辐照组,差异显著(P<0.05)。10~20 d时,各组弹性大小表现为:对照组>UV-C组>60Co-γ辐照组,差异显著(P<0.05)。表明在贮藏初期,UV-C处理能够有效延缓大樱桃果实弹性下降速率;但在长期贮藏过程中,UV-C处理和60Co-γ辐照均不能明显抑制果实弹性降低趋势。
2.4 UV-C与60Co-γ辐照处理对大樱桃可溶性固形物质量分数的影响

图2 UV-C与60Co-γ辐照处理对大樱桃果实可溶性固形物质量分数的影响Fig. 2 Effects of UV-C and 60Co-γ irradiation on soluble solid content of cherry fruit
如图2所示,大樱桃可溶性固形物质量分数随贮藏时间延长呈先升高后降低变化,这是由于大樱桃为非呼吸跃变型果实,贮藏过程中呼吸作用使不可溶性的糖类和蛋白质不断分解溶出,呼吸强度最大时达到固形物分解合成平衡,后随衰老和腐败菌生长可溶性固形物质量分数降低[21]。贮藏期间各组间无显著性差异(P>0.05),说明UV-C与60Co-γ辐照处理对大樱桃果实可溶性固形物质量分数没有显著影响,与焦中高[22]、戚蓉迪[23]等研究结果一致。
2.5 UV-C与60Co-γ辐照处理对大樱桃花青素含量的影响
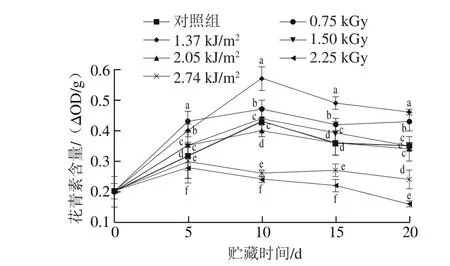
图3 UV-C与60Co-γ辐照处理对大樱桃果实花青素含量的影响Fig. 3 Effects of UV-C and 60Co-γ irradiation treatments on anthocyanin content of cherry fruit
采后花青素含量的增加是大樱桃不断成熟的标志,其在贮藏期间含量的变化可以表征大樱桃营养品质[24],其含量越高表明大樱桃色泽良好、抗氧化能力较高[25]。由图3可知,在0~15 d中,各处理组花青素含量均表现为先快速上升后平缓下降的趋势,对照组和处理组差异显著(P<0.05)。经1.37 kJ/m2UV-C照射和0.75 kGy60Co-γ辐照处理的大樱桃果实花青素含量一直显著高于对照组(P<0.05),并且10~20 d时,1.37 kJ/m2组花青素含量显著高于0.75 kGy组(P<0.05);而高剂量处理(2.74 kJ/m2、2.25 kGy)的果实花青素含量始终显著低于对照组(P<0.05),处于较低水平。表明低剂量的UV-C照射和60Co-γ辐照能够促进大樱桃果实花青素的合成与蓄积,有效抑制花青素含量下降,而高剂量处理则会加剧花青素的降解。这和焦中高等[22]的研究一致,可能是由于高剂量的射线能量与果实中水分子作用产生一定羟自由基导致花青素等色素类物质降解[26]。
2.6 UV-C与60Co-γ辐照处理对大樱桃POD活力的影响

图4 UV-C与60Co-γ辐照处理对大樱桃果实POD活力的影响Fig. 4 Effects of UV-C and 60Co-γ irradiation treatments on POD activity of cherry fruit
如图4所示,在贮藏初期0~10 d内,除2.25 kGy组以外,其他各组POD活力均呈现上升趋势(P<0.05),在第10天时各组POD活力达到峰值,0.75 kGy组活力最大(P<0.05),其次是1.37 kJ/m2组(P<0.05)。第5天和第20天时,1.37 kJ/m2UV-C组和0.75 kGy60Co-γ辐照组的POD活力均显著高于初始值、对照组和其他剂量处理组,但该两者间差异不明显。表明低剂量的UV-C处理和60Co-γ辐照在贮藏前期和末期均能有效提高POD活力,增强果实抗氧化能力。
2.7 UV-C与60Co-γ辐照处理对大樱桃SOD活力的影响

图5 UV-C与60Co-γ辐照处理对大樱桃果实SOD活力的影响Fig. 5 Effects of UV-C and 60Co-γ irradiation treatments on SOD activity of cherry fruit
如图5所示,经UV-C照射和0.75 kGy剂量60Co-γ辐照处理的大樱桃SOD活力变化均呈现先升高后降低的趋势,对照组和高剂量60Co-γ辐照组的SOD活力则先降低后升高,不同剂量处理间差异显著(P<0.05)。第5天时,对照组SOD活力下降至最低值,显著低于各处理组;UV-C组的SOD活力显著高于60Co-γ辐照组。第20天时,0.75 kGy与1.37 kJ/m2处理的果实SOD活力均显著高于对照组,且0.75 kGy组酶活力显著高于1.37 kJ/m2组,与POD活力变化类似。这可能是由于低剂量的辐照激活了SOD酶相关的合成[27]。由此可见,贮藏前期,UV-C照射能显著提高大樱桃果实SOD活力;但在长时间贮藏过程中,0.75 kGy60Co-γ辐照的处理效果更好,能有效保持大樱桃果实SOD活力。
2.8 UV-C与60Co-γ辐照处理对大樱桃MDA含量的影响

图6 UV-C与60Co-γ辐照处理对大樱桃果实MDA含量的影响Fig. 6 Effects of UV-C and 60Co-γ irradiation treatments on MDA content of cherry fruit
MDA是膜脂过氧化的有毒代谢产物,能够破坏细胞膜的完整性,加速果实衰老,因此MDA是评估果实细胞膜损伤程度的重要指标之一。如图6所示,贮藏期间MDA含量呈现出不断升高的趋势,且第5天后各处理组的MDA含量均高于对照组(P<0.05),与王琛等[9]利用60Co-γ辐照处理蓝莓果实的结果相似。60Co-γ辐照组的MDA含量始终高于UV-C处理组(P<0.05),并且MDA含量与60Co-γ辐照剂量呈正相关关系。说明UV-C处理和60Co-γ辐照均不能显著抑制MDA含量上升,其中60Co-γ辐照特别是高剂量处理更易激发大樱桃果实膜脂过氧化进程。
2.9 UV-C与60Co-γ辐照处理对大樱桃果皮超微结构的影响
选取第20天时,1.37 kJ/m2UV-C处理、0.75 kGy60Co-γ辐照处理、对照组以及第0天时新鲜大樱桃果皮进行超微结构分析。由图7可以看出,第0天时新鲜大樱桃果皮表面由大小不等的环状坑结构构成,角质层分布均匀且致密,气孔紧闭。第20天时,各组大樱桃果皮的角质层均开始脱落,在果皮气孔中,出现不同程度的角质层脱落后的颗粒状结构堆积于孔口。各组果皮的结构形态均发生了一定变化,细胞表面的环状坑结构逐渐变得不明显,趋于平缓,表皮组织松散,气孔打开。其中,对照组气孔较多,开口深而大,说明与处理组相比,对照组失水较为严重,与前文分析一致。

图7 大樱桃果皮细胞扫描电子显微镜观察图(×500)Fig. 7 Scanning electron microscopic images of cherry pericarp cells (× 500)
如图8所示,在透射电子显微镜下,第0天时新鲜大樱桃果皮的各细胞器排列整齐,质膜清晰;线粒体结构完整、内脊发达;但细胞内开始出现囊泡,叶绿体被膜断裂,出现空泡化。这可能是由于取样过程中,果皮细胞受损所导致。采后20 d,UV-C处理的大樱桃果皮细胞内,囊泡明显增多并膨胀,线粒体内脊结构数量减少,部分线粒体膜出现絮状降解;叶绿体老化,被膜模糊,基质片层结构崩解。60Co-γ辐照处理的大樱桃果实与UV-C处理类似,线粒体被膜边界不清晰,内脊结构模糊,致密度降低;叶绿体结构解体,严重空泡化;嗜锇颗粒数量较UV-C处理组多且体积大。对照组的细胞结构已经彻底崩溃瓦解,细胞膜被破坏,细胞器严重降解,降解产生的絮状物扩散在整个细胞中。可以看出,与对照组相比,低剂量的UV-C处理和60Co-γ辐照处理均有效地抑制了大樱桃果实细胞内线粒体、叶绿体的解体,较好地维持了细胞结构完整性,显著减轻了大樱桃果实细胞衰老受损程度。

图8 大樱桃果皮细胞透射电子显微镜观察图Fig. 8 Transmission electron microscopic images of cherry pericarp cells
3 讨 论
UV-C和60Co-γ辐照能够通过放射线能量,对果实产生杀菌防腐、抑制生理代谢的作用,但这并不意味着处理剂量越高越好。陈曦等[27]的研究表明,经1.5 kGy辐照的蓝莓在冷藏条件下贮藏70 d,好果率可达87%以上,显著高于2.0 kGy辐照剂量的果实。焦中高等[22]也指出,长时间贮藏条件下,与高剂量(3.6、7.2 kJ/m2)UV-C处理相比,低剂量(0.72、1.44 kJ/m2)UV-C照射能够更好地保持甜樱桃果实中总酚、总黄酮、花色苷含量和抗氧化活性。本实验研究结果表明,和贮藏期间对照组自身采后生理变化情况相比,高剂量的UV-C照射和60Co-γ辐照处理均加速了大樱桃果实的质构劣变和花青素降解,低剂量处理(0.75 kGy、1.37 kJ/m2)可有效延缓大樱桃果实好果率下降、减少果实质量损失,较好保持果实质地特性,促进花青素合成与蓄积,显著抑制POD和SOD的活性下降,但UV-C照射和60Co-γ辐照处理对可溶性固形物质量分数影响不大,且会引起果实贮藏期间MDA含量的增加。60Co-γ辐照特别是高剂量处理对大樱桃果实的胶黏性、弹性和MDA含量产生了一定负面影响。由于60Co-γ辐照对质构特性和感官品质的核心指标硬度具有良好的积极作用,因此对胶黏性和弹性的不利效果并不足以影响到果实的商品品质评价。高剂量辐照导致大樱桃果实MDA含量上升,是由于自由基通过直接或间接作用刺激了果实细胞膜脂过氧化作用所造成,与对蓝莓[28]、葡萄[29]等的研究一致,这种现象普遍存在于水果保鲜中。因此对于水果的辐照保鲜,通常建议采用低剂量辐照,不仅能起到良好的防腐保鲜效果,且能较好地避免过度刺激细胞膜脂过氧化进程。
果实果皮的衰老和破裂可导致真菌菌丝的侵入和生长繁殖、果肉组织结构的破损,是造成果实衰老和迅速腐烂的原因之一,果皮的组织结构与其耐贮性有密切的关系[30]。果皮超微结构的变化是果实发育成熟及衰老过程的重要特征,反映了果实的生理状态,组织细胞的超微结构变化可导致其功能衰弱甚至丧失,加速果实的衰老与腐败变质[31]。通过扫描电子显微镜与透射电子显微镜观察大樱桃果皮超微结构的变化可知,大樱桃经低剂量UV-C和60Co-γ辐照处理后,果皮气孔开口少而浅,并在一定程度上较好地维持了细胞壁、叶绿体、线粒体等细胞结构的完整性。
总体而言,UV-C照射和60Co-γ辐照处理的大樱桃在15 d内的保鲜效果较好,贮藏末期,随着时间的延长,果实各品质指标均出现不同程度的劣变。不同剂量处理对大樱桃果实品质的影响不同,1.37 kJ/m2UV-C处理和0.75 kGy60Co-γ辐照处理的效果优于其他剂量组,能够更好地保持大樱桃果实的贮藏品质。在贮藏前期与末期,1.37 kJ/m2UV-C照射和0.75 kGy60Co-γ辐照所发挥的作用并不相同。贮藏前期,与60Co-γ辐照处理相比,1.37 kJ/m2UV-C照射能更好地保持大樱桃果实硬度,有效延缓果实弹性降低,显著提高果实SOD活力。贮藏末期,0.75 kGy60Co-γ辐照在减少果实质量损失、有效保持果实硬度和SOD活力下降方面显著优于UV-C照射。由此可见,针对于5 d以内的短期贮藏,可采用1.37 kJ/m2UV-C照射,而长期贮藏则以0.75 kGy60Co-γ辐照效果更好。

