沙葱总黄酮水洗组分的体外抗炎活性
王翠芳,王特日格乐,杜红喜,张秀媛,丹 妮,萨如丽,敖长金
(内蒙古农业大学动物科学学院,内蒙古 呼和浩特 010018)
沙葱(Allium mongolicum Regel)属百合目、百合科、葱属类植物根茎组,是一种具有抗寒、抗旱、生命力较顽强的植物[1]。主要分布于我国新疆、甘肃、内蒙古等地区的荒漠草原和沙地。近年来,沙葱及其提取物因具有消除羊肉中的膻味、提高机体免疫力、改善羊肉品质等诸多优点,常被作为天然绿色饲料添加剂应用于养羊业[2]。黄酮广泛存在于植物中,从1938年Kumar等首次在桔皮中发现黄酮类化合物以来,已有4 000余种黄酮类化合物被相继发现,并成为学者们研究的热点[3]。植物来源的黄酮类化合物具有抗氧化、抗炎、抗肿瘤等多种生物活性[4]。本课题组前期研究表明,沙葱黄酮是沙葱重要的活性成分之一,具有抗菌[5]、改善绵羊瘤胃内环境[6]、抗氧化[7]等多种功效。目前,关于沙葱黄酮调节机体免疫及抗氧化方面的相关研究较多,但对其抗炎活性研究甚少。所以,本实验应用脂多糖(lipopolysaccharides,LPS)诱导小鼠腹腔巨噬细胞建立炎症模型,探讨沙葱总黄酮水洗组分对正常及LPS诱导过度激活的小鼠腹腔巨噬细胞炎症反应的保护作用,以期为进一步研究沙葱黄酮抗炎相关分子机制及其在动物生产中的实际应用提供科学依据。
1 材料与方法
1.1 动物、材料与试剂
健康SPF级雄性C57BL/6小鼠,8~10 周龄,体质量(20±2)g,购自内蒙古医科大学实验动物中心(生产许可证号:SCXK(蒙)2015-0001)。小鼠6 只/笼,于(20±1)℃、相对湿度(55±5)%及12 h昼夜交替的动物房中饲养,均自由采食和饮水。
沙葱粉 阿拉善盟浩海生物科技有限公司。
RPMI-1640基础培养基、青链霉素混合液 美国Gibco公司;磷酸盐缓冲液 美国HyClone公司;胎牛血清 上海ExCell Bio公司;LPS(Escherichia coli O55∶B5) 美国Sigma公司;液体硫乙醇酸盐培养基美国BD公司;CCK-8试剂盒 日本同仁化学研究所;NO测定试剂盒 美国Promega公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-1β、IL-6、IL-10酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒美国BioLegend公司;总RNA小量制备试剂盒 美国Axygen公司;SYBR®Premix Ex TaqTMII试剂盒、Prime ScriptTMRT Reagent Kit 日本TaKaRa公司。
1.2 仪器与设备
旋转蒸发仪 德国艾卡(IKA)仪器设备有限公司;Synergy HT型多功能酶标仪 美国Bio-Tek公司;生物安全柜、恒温培养箱、低温高速离心机 美国Thermo Fisher公司;LightCycler®480实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪瑞士罗氏公司。
1.3 方法
1.3.1 沙葱总黄酮水洗组分的制备
沙葱粉于室温保存,依据本课题组前期报道的沙葱总黄酮超声波提取法的最佳提取工艺(体积分数75%乙醇溶液、料液比1∶30、提取温度40 ℃、提取时间15 min)制备沙葱总黄酮,其主要成分有3',4'-环氧基-7-O-5甲氧基黄酮醇、7-O-5,4'-二甲氧基-3'-羟基黄酮、金合欢素、芦丁、异槲皮苷及木犀草素-5'-O-糖葡萄糖-4-羟基苯丙酸,以蒸馏水为流动相,采用聚酰胺柱层析法对沙葱总黄酮进行分离纯化,于真空冷冻干燥得到沙葱总黄酮水洗组分(water eluate of total flavonoids from Allium mongolicum Regel,wAMF)[5]。
1.3.2 小鼠腹腔巨噬细胞的制备及培养
依据文献[8-10]所报道的方法对小鼠腹腔巨噬细胞进行分离、提取及纯化,将获得的小鼠腹腔巨噬细胞置于含质量分数10%胎牛血清、1%双抗(100 U/mL青霉素、100 U/mL链霉素)的完全培养基中,于5% CO2、37 ℃恒温培养箱中培养,用于后续研究。
1.3.3 CCK-8法检测细胞增殖活力
应用CCK-8法检测沙葱总黄酮水洗组分对小鼠腹腔巨噬细胞增殖活力的影响,筛选有效且安全的沙葱总黄酮水洗组分质量浓度。调整细胞浓度,按4×104cells/孔将细胞接种于96 孔细胞培养板中,于5% CO2、37 ℃恒温培养2~4 h进行贴壁,弃掉孔内培养基,将细胞分为对照组(添加含终质量分数0.1%二甲基亚砜(dimethyl sulfoxide,DMSO)的完全培养基)[11-12]、不同质量浓度沙葱总黄酮水洗组分处理组(添加含有终质量浓度50、100、200、400、800 μg/mL沙葱总黄酮水洗组分的完全培养基),以无细胞只添加完全培养基为空白,于5% CO2、37 ℃继续培养24 h,弃去各孔培养基,加入含有质量分数10% CCK-8溶液的完全培养基,孵育2 h,应用全自动酶标仪检测450 nm波长处各孔的OD值,记为OD450nm。细胞增殖活力按下式计算。

1.3.4 实验分组
基于1.3.3节筛选出的沙葱总黄酮水洗组分安全质量浓度,将细胞分为空白对照组(添加含终质量分数0.1% DMSO的完全培养基)、LPS应激模型组(1 μg/mL LPS)及不同质量浓度沙葱总黄酮水洗组分预处理组(各组先加入100、200、400 μg/mL沙葱总黄酮水洗组分预处理细胞1 h,培养结束后,各组再分别添加终质量浓度为1 μg/mL LPS共同培养细胞),各组加入LPS后的处理时间根据后续不同实验所需时间进行调整。
1.3.5 Griess法检测小鼠腹腔巨噬细胞NO的生成量
实验分组同1.3.4节,细胞经各质量浓度沙葱总黄酮水洗组分处理1 h后,继续与LPS共同处理24 h,收集各处理组培养上清液。向待测培养上清液中加入等体积的Griess A(1%(质量分数,下同)磺胺、5%磷酸)及Griess B(N-1-萘基乙二胺二盐酸盐)试剂进行室温避光孵育,测定各孔520 nm波长处吸光度,根据绘制的标准曲线计算各处理组NO浓度。
1.3.6 ELISA法检测TNF-α、IL-1β、IL-6、IL-10的生成量
实验分组同1.3.4节,各质量浓度沙葱总黄酮水洗组分预处理细胞1 h后,继续与LPS共同处理24 h,12 000×g、4 ℃离心15 min,收集细胞培养上清液,依据ELISA试剂盒说明书检测各处理组TNF-α、IL-1β、IL-6、IL-10的质量浓度。
1.3.7 反转录实时荧光定量PCR法检测iNOS、TNF-α、IL-1β、IL-6、IL-10、MyD88、NF-κB mRNA的表达水平
实验分组同1.3.4节,各质量浓度沙葱总黄酮水洗组分预处理细胞1 h后,继续与LPS共同处理4 h。根据总RNA小量制备试剂盒说明书对收集的细胞进行细胞内总RNA的提取,对所获得的RNA溶液进行纯度及质量浓度的检测。应用反转录试剂盒将提取的RNA反转录为cDNA,采用10 μL反转录体系,反转录条件为:37 ℃、15 min;85 ℃、5 s。以β-actin为内参基因,按扩增试剂盒说明书对待测基因的mRNA表达量进行检测,反应条件为:95 ℃、30 s;95 ℃、5 s,60 ℃、20 s,40 个循环;95 ℃ 15 s;60 ℃ 20 s。采用2-ΔΔCt法计算待测基因的相对表达量,ΔΔCt=(Ct目的基因-Ctβ-actin)实验组-(Ct目的基因-Ctβ-actin)空白对照组。引物信息见表1[13-15]。

表1 引物序列Table 1 Primer sequences used for RT-PCR
1.4 数据处理与分析
实验数据采用平均值±标准差表示,应用GraphPad Prism 5软件对所有实验数据进行显著性分析并作图,组间比较采用单因素方差分析,多重比较采用Tukey's Test,P<0.05为差异显著。
2 结果与分析
2.1 沙葱总黄酮水洗组分对小鼠腹腔巨噬细胞增殖活力的影响
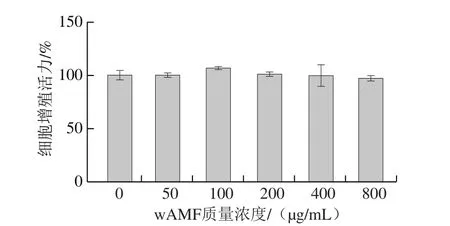
图1 沙葱总黄酮水洗组分对小鼠腹腔巨噬细胞增殖活力的影响Fig. 1 Effect of wAMF on cell viability of mouse peritoneal macrophages
如图1所示,各质量浓度沙葱总黄酮水洗组分处理小鼠腹腔巨噬细胞24 h后,小鼠腹腔巨噬细胞增殖活力与对照组相比均无显著差异(P>0.05),即沙葱总黄酮水洗组分质量浓度在50~800 μg/mL时对小鼠腹腔巨噬细胞无细胞毒性作用,选用100、200、400 μg/mL进行后续实验。
2.2 沙葱总黄酮水洗组分对LPS诱导的小鼠腹腔巨噬细胞NO浓度和iNOS mRNA表达量的影响
NO作为一种重要的炎性介质,其浓度是评价炎症反应程度的重要指标,而iNOS作为NO的限速酶,与NO的合成密切相关。图2显示,与未受LPS诱导的空白对照组相比,1 μg/mL LPS可高度显著提高小鼠腹腔巨噬细胞中NO浓度及iNOS mRNA的表达量(P<0.001)。而与LPS应激模型组相比,经过不同质量浓度沙葱总黄酮水洗组分(100~400 μg/mL)预处理的细胞均呈剂量依赖性地高度显著降低NO的生成及iNOS mRNA的表达(P<0.001),且在400 μg/mL时对NO的抑制率为74.2%。

图2 沙葱总黄酮水洗组分对LPS诱导的小鼠腹腔巨噬细胞NO生成及iNOS mRNA表达的影响Fig. 2 Effect of wAMF on NO production and iNOS mRNA expression in LPS-induced mouse peritoneal macrophages
2.3 沙葱总黄酮水洗组分对LPS诱导的小鼠腹腔巨噬细胞相关炎性细胞因子质量浓度及其mRNA表达量的影响
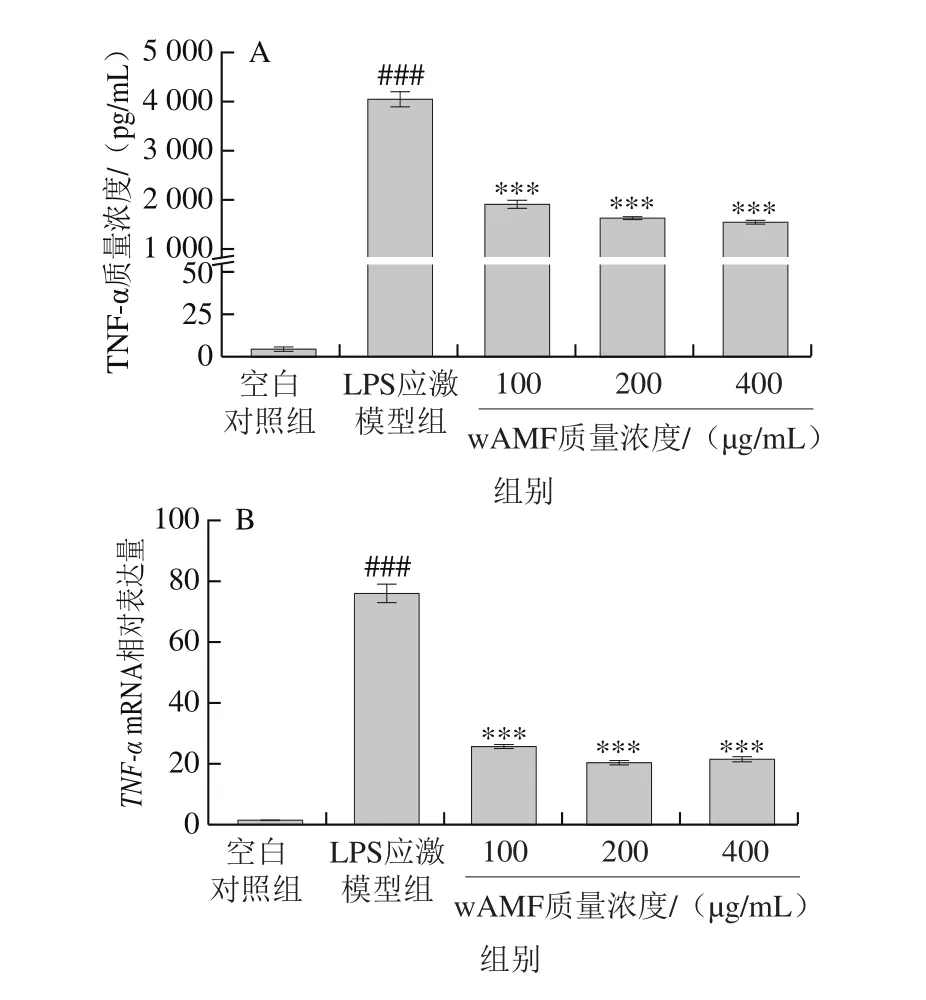


图3 沙葱总黄酮水洗组分对LPS诱导的小鼠腹腔巨噬细胞相关炎性细胞因子质量浓度及其mRNA表达量的影响Fig. 3 Effect of wAMF on inflammatory cytokine production and gene expression in LPS-induced mouse peritoneal macrophages
图3 A、C、E、G显示,与空白对照组相比,LPS应激模型组可高度显著提高TNF-α、IL-1β、IL-6及IL-10的质量浓度(P<0.001),表明炎症模型建立成功。与LPS应激模型组相比,添加不同质量浓度沙葱总黄酮水洗组分组均可不同程度地抑制促炎性细胞因子TNF-α、IL-1β、IL-6的分泌(P<0.01或P<0.001),对3 种促炎性细胞因子的最大抑制率分别为61.8%、29.6%及62.5%;同时高度显著提高抗炎性细胞因子IL-10的质量浓度(P<0.001),且呈剂量依赖效应,最大提高率为170.4%。
为进一步明确沙葱总黄酮水洗组分对TNF-α、IL-1β、IL-6及IL-10的调节作用,通过反转录PCR法检测了其mRNA表达量的变化。图3B、D、F、H显示,沙葱总黄酮水洗组分在100~400 μg/mL范围内均可显著或极显著抑制TNF-α、IL-1β、IL-6 mRNA的表达,提高IL-10 mRNA的表达,表明沙葱总黄酮水洗组分对炎性细胞因子TNF-α、IL-1β、IL-6及IL-10 mRNA表达量的调节作用与其对TNF-α、IL-1β、IL-6及IL-10 4 种炎性因子分泌水平的调节作用基本一致。
2.4 沙葱总黄酮水洗组分对LPS诱导的小鼠腹腔巨噬细胞中MyD88及NF-κB mRNA表达量的影响
由图4可知,与空白对照组相比,LPS应激模型组小鼠细胞中MyD88及NF-κB mRNA的表达量高度显著升高(P<0.001);与LPS应激模型组相比,小鼠腹腔巨噬细胞经不同质量浓度沙葱总黄酮水洗组分预处理1 h后,可极显著降低MyD88及NF-κB mRNA表达水平(P<0.01或P<0.001),且400 μg/mL时对NF-κB的抑制效果最佳。

图4 沙葱总黄酮水洗组分对LPS诱导的小鼠腹腔巨噬细胞中MyD88(A)及NF-κB(B)mRNA表达量的影响Fig. 4 Effect of wAMF on MyD88 (A) and NF-κB (B) mRNA expression in LPS-induced mouse peritoneal macrophages
3 讨 论
炎症是一种由物理因素(如温度、放射性物质及机械损伤)、化学因素(如强酸、强碱及内源性毒性物质的分解产物)或生物因素(如细菌、毒素)在一定条件下刺激触发的适应性反应[16]。在正常情况下,适宜的炎症反应有利于宿主抵御病原体和伤口愈合,从而保护机体免受伤害和感染。巨噬细胞在炎症反应过程中通过调节保护反应起着核心作用,当细菌等外来物质侵入机体时,其会释放炎症介质来预防有害刺激;但过度的炎症反应会导致组织损伤,并出现动脉粥样硬化、肥胖、系统性红斑狼疮及糖尿病等多种疾病[17]。所以,阻断或延缓炎症反应可治疗或预防由炎症引起的机体损伤。
细胞的增殖活性是机体的重要生命特征,也是体现细胞活力的重要指标。CCK-8法是一种无放射性、高灵敏度、简便、高效检测细胞毒性和增殖活力的方法。熊建文等[18]研究指出CCK-8法具有步骤少、重复性好等优点,能够准确反映出细胞的增殖活性。本实验通过CCK-8法检测了沙葱总黄酮水洗组分对小鼠腹腔巨噬细胞的潜在细胞毒性,结果显示,沙葱总黄酮水洗组分质量浓度在50~800 μg/mL时对小鼠腹腔巨噬细胞均没有细胞毒性作用,表明实验用沙葱总黄酮水洗组分的质量浓度对小鼠腹腔巨噬细胞是安全无毒的。
LPS是革兰氏阴性菌细胞壁的主要组成成分,又名内毒素,是引起机体炎症损伤的重要致病因子,可激活巨噬细胞产生TNF-α、IL-1β、IL-6、NO等多种促炎介质,并增加炎症损伤的程度。TNF-α是一种多功能的细胞因子,在炎症的发生与发展过程中起着至关重要的作用,可增强巨噬细胞的敏感性,激活中性粒细胞和淋巴细胞,促进其他炎性细胞因子的合成与释放[19-20];IL-6可由多种免疫细胞产生,参与、调节绝大多数由炎症引起的急性期蛋白诱发机体产生的非特异性反应[21];IL-1β作为促炎性细胞因子可在炎症初期大量产生,并促进炎症反应进程,引起多种炎症性疾病[22]。所以,由LPS诱导引发的对机体的炎症损伤远大于其对机体的直接毒性。在养殖业中,内毒素感染导致的动物死亡给养殖企业造成了巨大的经济损失。因此,中和、抑制LPS诱导产生的炎症介质及细胞因子成为预防与治疗炎症损伤的主要思路和方法之一。
本研究结果表明,小鼠腹腔巨噬细胞经LPS刺激后,可显著提高炎性介质的质量浓度。细胞经沙葱总黄酮水洗组分预处理后,可呈剂量依赖性地极显著抑制由LPS诱导的TNF-α、IL-1β、IL-6的产生,同时抑制相关炎性细胞因子mRNA表达量,表明沙葱总黄酮水洗组分通过调节促炎细胞因子的基因转录水平来抑制炎症的发生。NO为重要的炎症介质,在细胞中由iNOS催化L-精氨酸产生,在各种生理和病理条件下广泛存在于机体内,过量的NO会导致细胞死亡,破坏组织稳态[23-24]。沙葱总黄酮水洗组分可高度显著抑制LPS诱导小鼠腹腔巨噬细胞中iNOS mRNA的表达和NO的产生,表明沙葱总黄酮水洗组分通过抑制LPS诱导的小鼠腹腔巨噬细胞iNOS的活性抑制炎性介质NO的生成。IL-10作为另一种重要的细胞因子,其主要的生物学功能是调节炎症反应程度和炎症的持续时间,并选择性地阻断促炎性细胞因子及趋化因子的表达[25]。因此,诱导IL-10可被认为是内毒素损害机体期间内源性宿主保护机制的一部分。本研究结果表明,与LPS应激模型组相比,添加100~400 μg/mL沙葱总黄酮水洗组分能够高度显著提高抑炎细胞因子IL-10的质量浓度及其mRNA表达水平,并呈浓度依赖性。
细胞表面存在一类模式识别受体,如Toll样受体(Toll-like receptors,TLRs),被LPS激活后与连接蛋白MyD88衔接,进一步活化下游重要的核转录因子NF-κB,使其实现从细胞质到细胞核的核移位,引发如TNF-α、IL-1β、IL-6、NO等炎症介质的大量产生,进而造成机体炎性损伤[26]。所以,长期以来与NF-κB信号通路相关的关键分子被认为是许多抗炎药物的主要靶点。本研究结果表明,小鼠腹腔巨噬细胞经质量浓度100~400 μg/mL沙葱总黄酮水洗组分处理后,可极显著降低由LPS诱导的MyD88和NF-κB mRNA的表达,且在400 μg/mL时效果更好。提示沙葱总黄酮水洗组分的抗炎活性可能与NF-κB信号通路有关,但是具体的作用机制还有待进一步研究。
目前,天然健康产品或其次级代谢产物已被用于治疗和预防许多炎症性疾病,且可以强烈抑制TNF-α、IL-1β、IL-6等炎症因子的分泌,这可能归因于提取物对NF-κB活性的影响[27]。一些研究表明,自然抑制剂通过抑制炎症介质进而抑制NF-κB,从而可明显改善内毒素诱导的脓毒症[28]。近年来,越来越多的研究报道了黄酮类化合物对机体的抗炎作用及其机制,如抑制与类花生酸合成相关酶的产生及其本身存在的抗氧化活性;但有研究表明,一些黄酮类化合物可通过调节促炎分子的产生导致炎症反应的减弱[29]。有报道指出,异槲皮苷可通过调控NF-κB及丝裂原活化蛋白激酶信号通路抑制TNF-α、IL-6及iNOS等促炎介质的分泌,减轻由LPS诱导的心脏功能障碍,从而作为治疗脓毒症引起的心脏功能障碍的潜在药物[30]。Liu Lin等发现金合欢素对关节炎具有缓解作用,可预防病变,降低促炎介质的产生[31]。Elnur等的研究结果表明,由Inula montana L.中提取出的含有木樨草素等黄酮类化合物的复合成分可降低由LPS诱导的RAW264.7巨噬细胞中NO等炎症介质的产生,发挥较强的抗炎活性[32]。本研究结果与上述研究结果相一致,表明沙葱总黄酮水洗组分具有良好的抗炎活性。
综上所述,沙葱总黄酮水洗组分通过调节炎症介质及细胞因子的分泌体现其体外抗炎活性,其作用机制可能与NF-κB信号通路有关。

