超声处理对大豆分离蛋白-乳清分离蛋白混合蛋白功能特性的影响
崔 强,王 琳,周国卫,董洋洋,王喜波,江连洲
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
大豆蛋白和牛乳蛋白具有良好的功能性质、较高的营养价值和潜在的健康益处,一直是国内外的研究热点[1-2]。近年来,通过混合蛋白得到的具有全新质感且更有利于人体健康的食品,特别是含优质植物蛋白和优质动物蛋白的双蛋白食品越来越得到重视[3],已被列入“十三五”食品工业发展项目中[4]。然而,用植物蛋白部分或全部替代动物蛋白可能对食品质地和感官特性产生负面影响,如Drake等[5]报道,向乳制酸奶中添加质量分数1%的大豆蛋白也会导致感官垩白度增加。因此,了解含有植物蛋白的蛋白质混合物的结构和机械性质,并厘清这些性质如何在混合食品体系中发挥作用是至关重要的[6]。
在植物蛋白中,大豆分离蛋白(soy protein isolate,SPI)是研究最多且容易获得的植物蛋白之一,通常用作传统动物蛋白的部分替代品。加入SPI的混合蛋白食品有营养饮料、酸奶、咖啡奶精等。在不同条件下单一体系SPI的凝胶行为、微观结构和力学性能得到了广泛的研究,但是有关提高混合蛋白体系稳定性的研究较少。Jissy等[7]解析了乳清蛋白与大豆蛋白混合体系在不同离子浓度下的相互作用机理;汪亚强等[8]研究发现在谷氨酰胺转氨酶(transglutaminase,TG)交联作用下大豆蛋白为小麦蛋白提供了更多的催化位点,有效促进TG催化交联混合蛋白的反应,对混合蛋白凝胶性产生重要影响;Qin Xinsheng等[9]研究表明微波处理能改变混合蛋白的内部结构从而提高大豆与小麦混合蛋白凝胶性。超声波在生物材料中的传播会引起颗粒的压缩和舒张,从而改变材料的物理化学性质并提高各种性能,已在食品加工中得到广泛应用[10]。超声波脉冲被认为是提高蛋白质溶解度和其他功能特性的最佳方法[11]。超声波改变蛋白质功能特性主要利用其空化作用和空穴效应破坏蛋白质的四级结构,使蛋白分子结构发生改变释放出小分子亚基或肽[12],是一种安全有效的蛋白质处理技术。然而,目前关于超声处理对SPI-乳清分离蛋白(whey protein isolate,WPI)混合蛋白体系功能性质的研究鲜见报道。本实验以SPI-WPI混合蛋白体系为对象,以SPI和WPI为对照,研究不同超声波功率处理对混合蛋白乳化性与凝胶性的影响,并分析混合蛋白相互作用的机理,为开发新型双蛋白食品提供理论和技术支持。
1 材料与方法
1.1 材料与试剂
SPI由东北农业大学食品学院实验室自制;WPI、十二烷基硫酸钠(sodium dodecyl sulphate,SDS)美国Sigma公司;TG 江苏一鸣生物制品有限公司;其他试剂均为分国产析纯。
1.2 仪器与设备
ULTRA-TURRAX T18 Basic型高速分散机/匀浆机德国IKA公司;TU-1800型紫外-可见分光光度计北京普析通用仪器有限责任公司;超声波细胞破碎仪宁波新芝生物科技股份有限公司;TA-XT2i型质构分析仪英国Stable Micro Systems公司;扫描电子显微镜 日本日立高新技术公司。
1.3 方法
1.3.1 SPI-WPI混合蛋白制备
制备方法参照Qin Xinsheng等[9]的方法,分别将SPI、WPI溶于去离子水中,质量浓度为100 mg/mL。25 ℃下磁力搅拌1 h,后将两种蛋白1∶1(V/V)混合并用分散器以10 000 r/min间歇处理5 min(处理1 min,休息1 min),继续匀速磁力搅拌1 h。对照组分别将单一SPI、单一WPI溶于去离子水中,质量浓度为100 mg/mL。按上述条件搅拌,使其充分溶解,静置过夜(4 ℃)。
1.3.2 超声处理
超声处理参考Hu Hao等[13]的方法,将制备好的SPI-WPI蛋白混合液、SPI与WPI(30 mL)放入50 mL锥形瓶中,将超声波处理器的钛探头(直径0.636 cm)插入液面距锥形瓶底部1 cm处,然后在20 kHz,输出功率为分别为150、300、450 W下处理30 min。整个过程对锥形瓶进行冰水浴处理,使蛋白温度控制在25~35 ℃之间。
1.3.3 乳化性及乳化稳定性的测定
参考Pearce等[14]的方法,用磷酸盐缓冲液(0.2 mol/L、pH 7.0)稀释改性后的混合蛋白样品至2 mg/mL,以体积比3∶1将蛋白样品溶液与大豆油混合,并对其进行11 000 r/min、1 min的均质处理。处理后迅速吸取底部乳液100 μL,将其加入到10 mL质量分数0.1% SDS溶液中均匀混合。然后用分光光度计于500 nm波长处分别测定0 min和10 min的吸光度。其乳化活性指数和乳化稳定性指数计算分别见公式(1)、(2)。
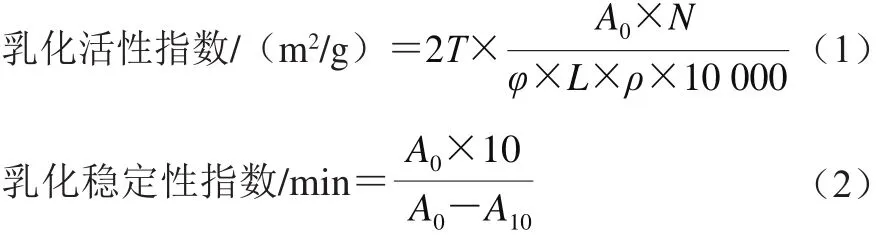
式中:N为稀释倍数100;T为常数2.303;L为比色池光径(1 cm);φ为油相体积分数(0.25%);ρ为乳化液形成前蛋白质的质量浓度/(g/L);A0、A10分别为乳状液在0、10 min的吸光度。
1.3.4 紫外光谱扫描
参照Liu Yan等[15]的方法并略作改动。将超声处理后的样品稀释至2 mg/mL后进行紫外光谱扫描,波长范围250~310 nm、扫描速率100 nm/min、分辨率0.2 nm。
1.3.5 混合蛋白凝胶的制备与分析
将不同比例的混合蛋白(10 g)超声处理后加入TG(0.3 g)[7]。在45 ℃下将样品保持2 h,在90 ℃加热灭酶10 min。形成的凝胶在4 ℃下冷藏过夜,后进行凝胶强度、持水性(water holding capacity,WHC)测定及扫描电子显微镜观察,将样品经冷冻干燥后进行SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)分析。
1.3.6 凝胶强度测定
参考Jin等[16]的方法,采用TA-XT2i型质构仪进行测定。将混合蛋白超声处理后置于烧杯中(25 mL),制备成凝胶。凝胶强度的测定使用p/0.5柱形探头,探头下行速率为1 mm/s,检测速率为5 mm/s,后撤速率为5 mm/s,下压深度为10 mm,触发力为5 g,一次测定探头下压两次。
1.3.7 持水性测定
将凝胶样品置于10 mL的离心管中,离心机4 000 r/min下离心30 min,分别将离心前与离心后移除多余水分的试管称质量[17],WHC按式(3)计算。

式中:mt为样品离心前与离心管的总质量/g;mr为样品离心除水后与离心管的总质量/g。
1.3.8 SDS-PAGE分析
参考Laemmli等[18]的方法略作修改:分离胶质量分数为12%,浓缩胶质量分数为5%,样品质量浓度为5 mg/mL,上样前于沸水浴中加热5 min,上样量为8 μL,电泳电压初始为90 V,待样品进入分离胶时,提高电压至120 V。电泳后用考马斯亮蓝R250溶液染色,接着用脱色液脱色4 次,脱色完全后,采用Gel Doc EZ imager型凝胶成像系统分析电泳条带。
1.3.9 扫描电子显微镜观察
将超声处理后的样品进行前处理,凝胶切块,浸泡在戊二醛固定剂溶液中24 h。用0.1 mol/L、pH 7.2的磷酸盐缓冲液冲洗3 次。用体积分数为50%、70%、90%乙醇溶液各进行脱水一次,每次15 min,然后体积分数100%乙醇脱水3 次,每次15 min。用体积分数100%乙醇-叔丁醇(1∶1,V/V)纯叔丁醇各置换一次,后冷冻干燥。然后将样品置于扫描电子显微镜(5 kV)下观察其显微结构[19]。
1.4 数据统计分析
每次实验做3 次平行,采用SPSS Statistics 20软件进行数据统计分析,采用Origin 8.0软件作图。
2 结果与分析
2.1 乳化性及乳化稳定性分析结果
不同超声功率处理对SPI-WPI、SPI与WPI乳化活性与乳化稳定性的影响如图1所示,SPI-WPI与WPI的乳化活性先升高后下降,在300 W时分别达到最大值(76.46 m2/g和71.31 m2/g),而SPI的乳化活性随着超声功率的升高而增加,在450 W时达到最大值59.08 m2/g。SPI-WPI与SPI的乳化稳定性先上升后下降,在300 W时分别达到最大值22.83 min和14.98 min。WPI的乳化稳定性随着超声功率的升高而增加,在450 W时达到最大值21.68 min。超声的空穴效应会破坏蛋白质的结构,使蛋白质释放出小分子亚基与肽,导致蛋白液乳化活性升高[20]。混合蛋白体系乳化活性显著高于对照组,这可能是因为超声处理后SPI-WPI混合蛋白质在水中进一步伸展,内部基团暴露,整体结构的舒展利于两种蛋白之间相互作用[21]。此外,超声处理后的混合蛋白体系构象稳定性更强,蛋白粒子减小更易解折叠及快速在油-水界面上稳定,因此乳化稳定性升高。Sui Xiaonan等[22]的研究结果与此相似,其认为超声处理蛋白时,颗粒的破碎与重聚集同时发生,超声功率增大到450 W后颗粒会聚集变大。随着超声功率的增加,两种蛋白之间会发生重聚集,易于附聚在一起形成附聚物,可能影响疏水基团的暴露,从而降低体系乳化活性与乳化稳定性。
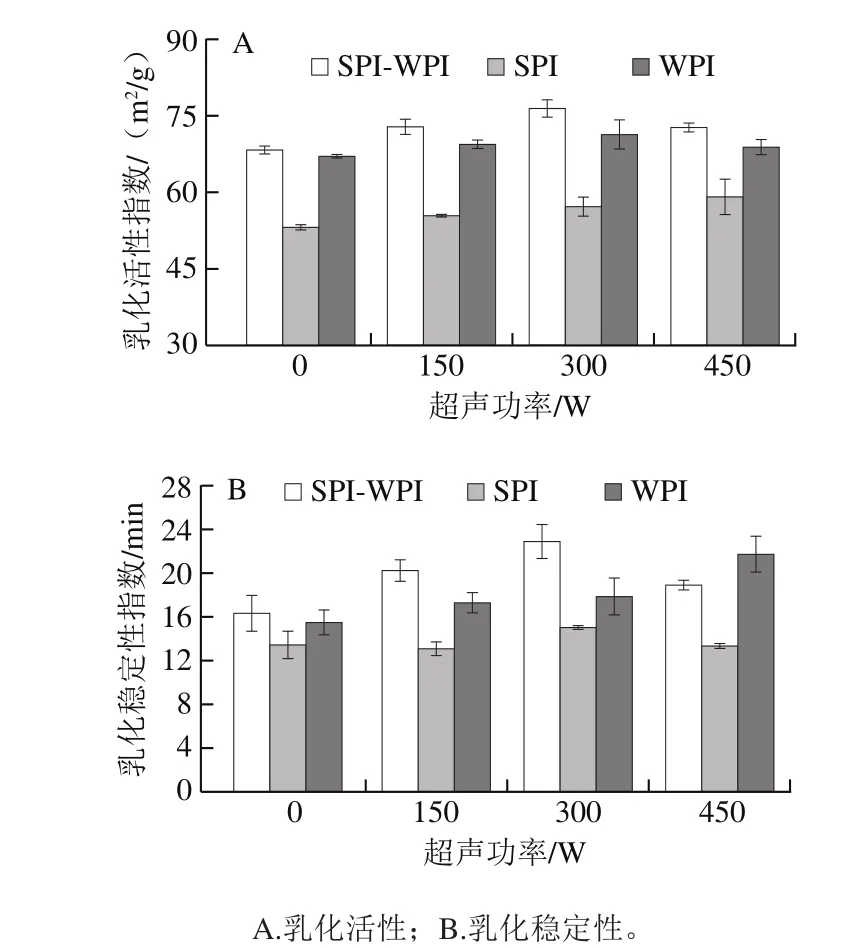
图1 超声处理对SPI-WPI乳化性的影响Fig. 1 Effect of ultrasonic treatment on emulsifying properties of SPI-WPI mixture
2.2 凝胶强度分析结果
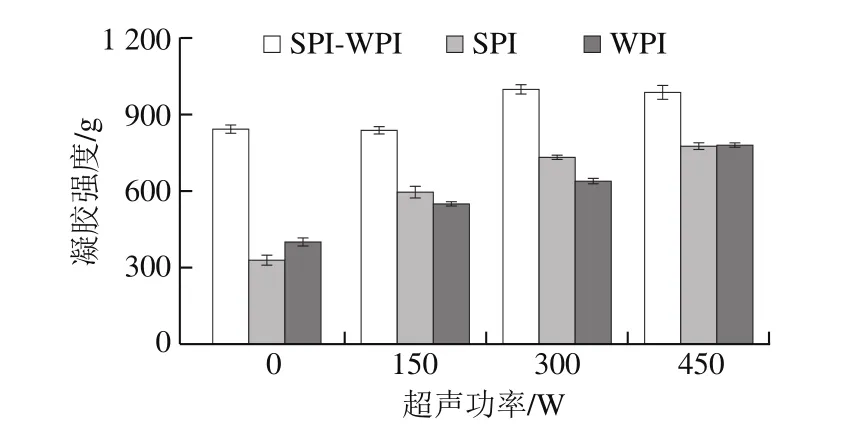
图2 超声处理对凝胶强度的影响Fig. 2 Effect of ultrasonic treatment on gel strength
凝胶强度是蛋白凝胶最重要的指标之一,由图3可知,SPI与WPI的凝胶强度随着超声功率的升高明显增加,SPI-WPI混合体系的凝胶强度随着超声功率的增加先升高后降低。这可能是因为随着超声功率的增加,蛋白质充分变性,蛋白之间弱键占主导地位,有利于混合蛋白之间二硫键的形成,使凝胶三维网络结构更致密、规则。另外,TG对蛋白结构的影响是通过改变蛋白质侧链上的疏水相互作用而实现的,形成孔洞微小且均匀的微观凝胶网络结构,在TG作用下有助于凝胶强度升高[23]。而当超声功率增大到450 W时,蛋白质颗粒之间又发生重聚集,SPI-WPI凝胶强度反而下降。经过450 W超声处理后,混合体系凝胶强度下降,可能是因为高功率超声处理不溶性聚集体形成,SPI与WPI蛋白质之间的相互作用减弱,没有形成更多的二硫键导致凝胶强度与稳定性有所下降,不溶性聚集体内部结构较为致密,在外界强应力作用下易断裂,宏观上表现为凝胶强度低[24]。扫描电子显微镜观察结果同样证实该点。
2.3 WHC分析结果
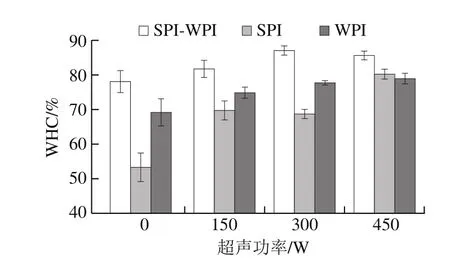
图3 超声处理对WHC的影响Fig. 3 Effect of ultrasonic treatment on water-holding capacity
WHC是蛋白凝胶最重要的特性之一,由图3可知,SPI-WPI混合体系的凝胶WHC先上升后下降。在300 W时达到最大值87.11%。SPI与WPI的凝胶WHC在450 W时达到最大值,分别为80.18%和78.96%。超声处理显著改善了蛋白质凝胶的WHC。Wu Wei等[25]得到相似的结果,并指出这可能是因为SPI与WPI混合体系在超声作用下粒径减小,促进两种蛋白之间形成更加致密和均匀的凝胶结构,高密度孔隙结构且稳定的凝胶可以有效地固定水分并提升WHC[26]。SPI-WPI混合体系超声处理后蛋白内部基团暴露,在TG作用下易形成二硫键,从而形成更加稳定的凝胶三维网络结构。当超声功率增加到450 W时,蛋白颗粒发生重聚集,得到疏松、不均匀的凝胶结构,一些大分子的不溶性聚集体造成凝胶孔隙增大,WHC降低[24]。
2.4 紫外光谱分析结果
超声处理SPI-WPI、SPI与WPI产生不同紫外吸收峰的主要原因是两种蛋白质侧链含有不同色氨酸、酪氨酸和苯丙氨酸残基[27]。不同的紫外吸收光谱可以推断出蛋白质分子三级构象的变化,进而分析氨基酸残基的相对移动[28]。如图4所示。随着超声功率的增加,SPI-WPI、WPI和SPI的紫外光谱强度增加,说明SPI与WPI分子内部多肽链部分展开,发色基团与芳杂环疏水基团更加暴露。混合蛋白体系与SPI紫外光谱强度远大于WPI,说明超声处理对混合蛋白与SPI作用效果更明显,这与SDS-PAGE结果一致。另外随着超声功率的增加,SPI-WPI紫外最大吸收峰发生轻微的红移,说明氨基酸环境向更加疏水的环境转移,这是因为混合蛋白体系构象发生了改变,超声使蛋白结构变得更加舒展。
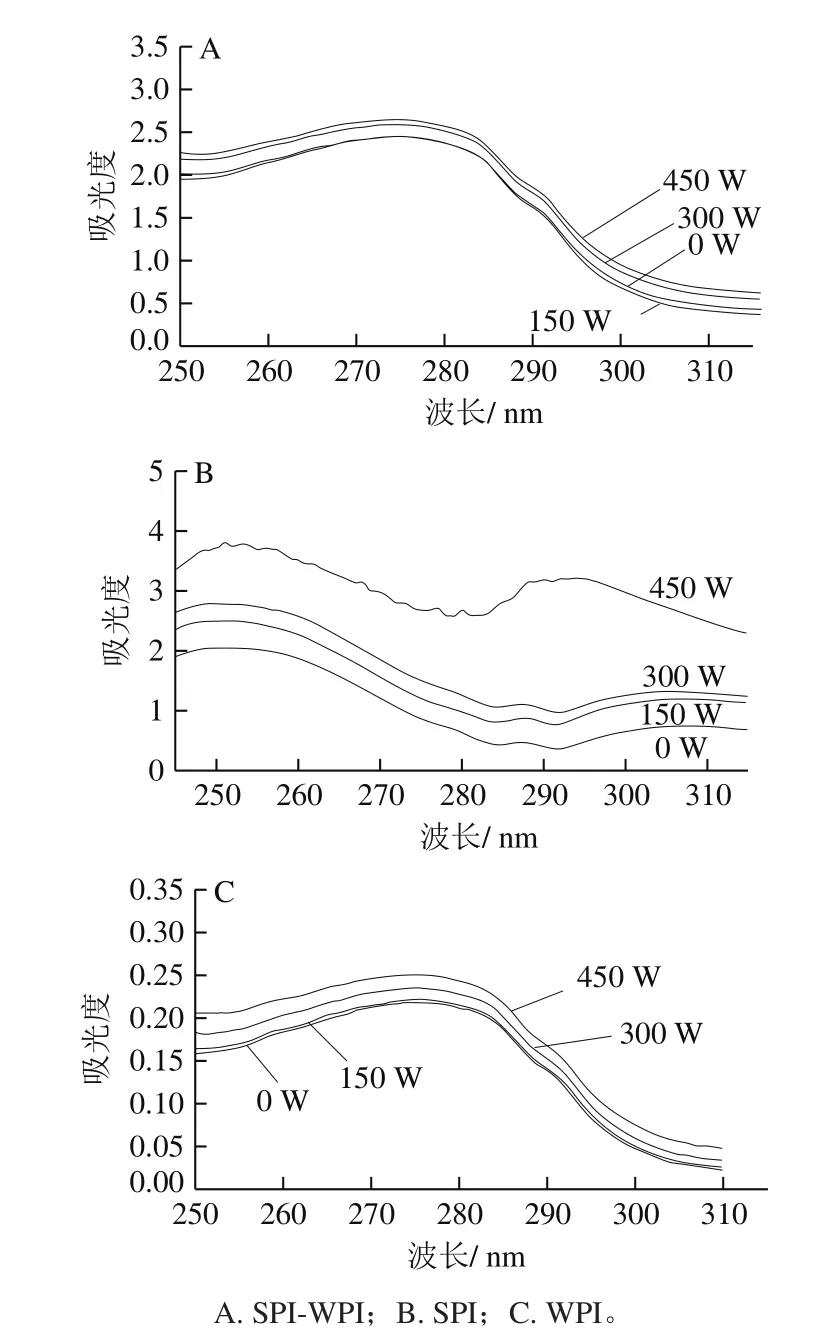
图4 不同超声条件下SPI-WPI、WPI、SPI的紫外光谱图Fig. 4 UV spectra of SPI-WPI, WPI and SPI as affected by ultrasonic power
2.5 蛋白的亚基变化
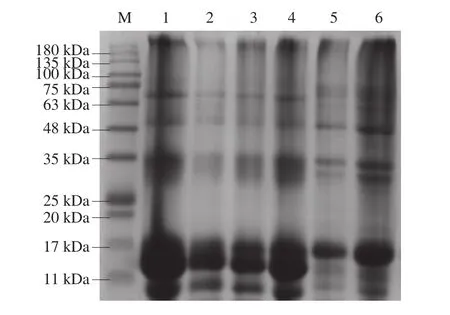
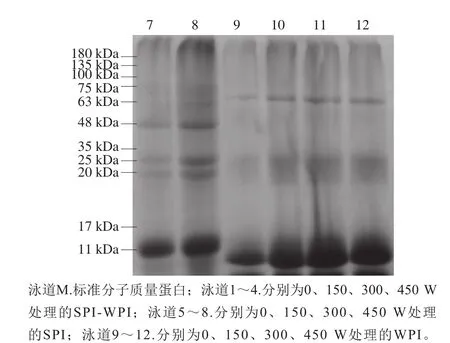
图5 不同超声条件下SPI-WPI、WPI、SPI的SDS-PAGEFig. 5 SDS-PAGE patterns of SPI-WPI, WPI and SPI as affected by ultrasonic power
如图5所示,SPI的蛋白条带主要分布在48、35 kDa与17 kDa。WPI的蛋白条带分子质量主要分布在11 kDa。经超声处理的SPI-WPI混合蛋白条带主要分布在63~75、25~35、11~17 kDa以及小于11 kDa处,且随着超声功率的增加,条带灰度变浅,说明超声处理会影响大豆蛋白亚基的组成[29],可能是因为超声使蛋白分子解聚。一般的改性手段可以形成暂时可溶性聚集体,然后解聚成酸性和碱性多肽[1],而高强超声处理后在TG作用下形成了致密的凝胶网络结构,大豆蛋白亚基在蛋白体系和SPI-WPI混合体系中变性聚集,很可能超过凝胶检测分子质量的上限,造成条带的缺失。与对照组相比,SPI-WPI混合体系凝胶在63~75、11~17 kDa与小于11 kDa中有新条带出现,这表明SPI与WPI之间形成复合物。因此可以发现,超声处理SPI-WPI混合体系蛋白质-蛋白质相互作用确实存在且有聚集体形成。
2.6 扫描电子显微镜观察结果
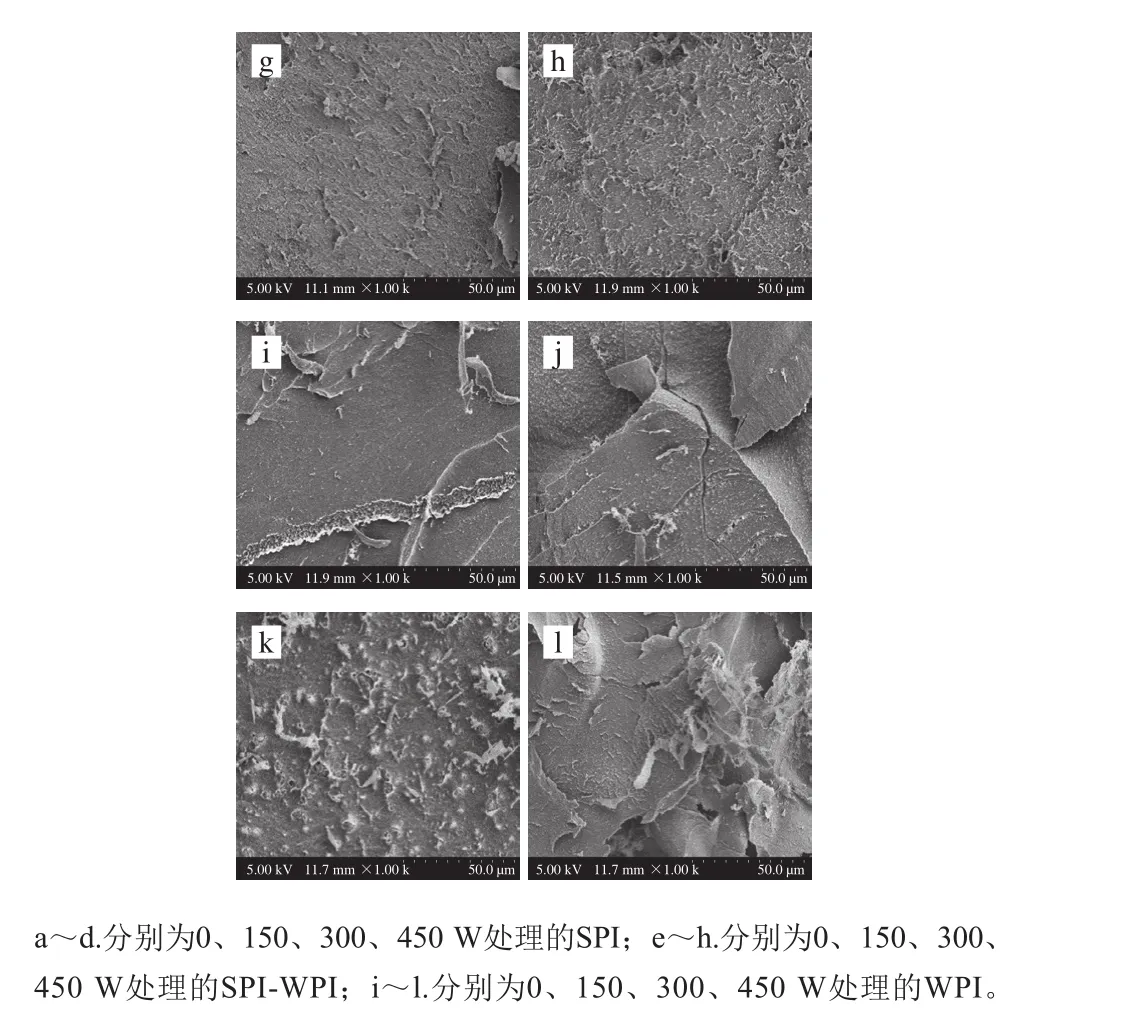
图6 不同超声条件下SPI-WPI、WPI、SPI的扫描电子显微镜图Fig. 6 Scanning electron micrographs of SPI-WPI, WPI and SPI as affected by ultrasonic power
通过扫描电子显微镜可以观察到在TG作用下不同超声功率处理SPI-WPI混合蛋白、SPI和WPI凝胶放大1 000 倍后的微观结构,如图6所示,未经超声处理的蛋白凝胶结构粗糙、表面不平整,且未形成致密的凝胶网络结构。与之相比,经过超声处理的蛋白凝胶结构均一、致密、空间结构分布均匀,汪亚强等[8]实验结果与此相似。这可能是因为超声处理后蛋白分子舒展,形成小分子物质,在TG催化作用下,两种蛋白之间互相作用形成共价交联。另外超声处理后蛋白内部基团暴露于蛋白表面,更有利于混合蛋白二硫键的形成和疏水相互作用,形成分子内或分子间的网络结构,从而表现出均匀致密的凝胶三维网络结构[30]。Ringgenberg等[31]研究表明凝胶结构与蛋白的聚集体有密切的关系,高强度超声处理后,由于重聚集作用,蛋白凝胶均匀结构受到破坏,显得更加无序,立体感差。
3 结 论
超声功率为300 W时,SPI-WPI混合体系乳化活性与乳化稳定性达到最高值。紫外光谱结果显示,SPI-WPI紫外最大吸收峰发生轻微红移,且紫外光谱强度发生改变。说明超声处理改变了蛋白内部结构,更有利于两种蛋白相互作用。
SPI-WPI混合蛋白300 W超声功率处理后在TG交联作用下,凝胶强度与WHC达到最大值,分别为1 000.93 g和87.11%。这与扫描电子显微镜观察到的结果一致。两种蛋白在超声空化效应作用下,分子内部结构被打开,TG作用位点增加,在TG诱导的凝胶化过程中SPI和WPI分子之间形成了二硫键,因而形成结构致密均匀的蛋白凝胶。
SDS-PAGE结果显示有新的条带出现,说明超声处理后在TG作用下SPI-WPI混合蛋白之间形成复合物。本研究为SPI-WPI混合蛋白的实际加工利用提供了理论参考。

