内镜超声引导下胆道引流术治疗恶性梗阻性黄疸的应用*
刘逸,陈炳芳,徐馥,陈建平,马亮
(常州市第一人民医院 消化内科,江苏 常州 213003)
恶性胆道梗阻(malignant biliary obstruction,MBO)是消化系统常见疾病,经内镜逆行胰胆管造影(endoscopic retrograde cholangiopancreatography,ERCP)是治疗失去手术机会的MBO 的标准疗法。对于ERCP 失败后传统的替代方法,如经皮肝胆管引流(percutaneous transhepatic cholangial drainage,PTCD),严重降低了患者的生活质量。近年来,内镜超声引导下胆道穿刺引流(endoscopic ultrasound-guided biliary drainage,EUS-BD)迅速发展并日渐成熟。本研究旨在研究EUS-BD 治疗恶性梗阻性黄疸的疗效及安全性。
1 资料与方法
1.1 一般资料
选取2016年1月-2019年1月本院行EUS-BD治疗恶性梗阻性黄疸的患者21 例。其中,男17 例,女4 例;患者年龄为44 ~91 岁,平均(67.24±11.07)岁,其中< 65 岁者6 例,占28.57%,65 岁及以上者15 例,占71.43%。影响患者的主要疾病包括恶性肿瘤伴胆管转移(52.38%)、胰头癌(23.81%)、原发性胆管癌(14.29%)和壶腹部肿瘤(9.52%)。21 例EUS-BD 的指征中,3 例为ERCP 插管失败,18 例为消化道解剖结构改变。
1.2 纳入和排除标准
纳入标准:①原发或转移性恶性肿瘤引起的胆管狭窄或闭塞;②影像学证实存在梗阻性黄疸;③具有梗阻性黄疸典型临床表现;④血清胆红素指标,尤其是直接胆红素升高,尿胆红素升高,尿胆原减少或者阴性。
排除标准:①良性病变导致的梗阻性黄疸;②住院期间死亡者。
1.3 仪器和设备
超声内镜:Olympus UCT-260 纵扫超声内镜;超声主机:Olympus ME2 超声主机;胆道金属支架:南京微创非覆膜自膨式支架;胆道塑料支架:COOK 8.5圣诞树型胆道支架,COOK 7Fr×7 双猪尾胆道支架;穿刺针:COOK ECHO-19G 穿刺针;乳头切开刀:德国福莱克斯(ENDO-FLEX)OE 130067 F2;导丝:波士顿M00556580,波士顿M00556561。
1.4 治疗方法
EUS-BD 手术由具有介入性内镜超声专业知识的医师完成。常规行EUS-BD 术前准备。EUS-BD 传统术式包括:①内镜超声引导下胆道会师术(EUS-Rendezvous,EUS-RV);②内镜超声引导下经腔内胆汁引流,包括肝胃吻合术(EUS-guided hepatogastrostomy,EUS-HGS)、胆总管十二指肠吻合术(EUS-guided choledochoduodenostomy,EUS-CDS)和肝肠吻合术(EUS-guided hepatoduodenostomy,EUS-HDS);③内镜超声引导下顺行胆汁引流(EUSguided antegrade,EUS-AG);④内镜超声引导下胆道穿刺外引流术[1]。目前EUS-AG 报道较少,国际上还产生了一种新的改良术式,即腔内胆汁引流联合顺行胆汁引流[2],在狭窄部位放置支架的同时,沿导丝在肝肠造瘘处置入支架,达到双引流目的。综合实际情况,本科采取的术式包括EUS-RV、EUS-HDS 和EUS-HDS 联合EUS-AG。术式原理图见图1。
1.4.1 EUS-RV 内镜超声选定穿刺点,彩色多普勒显示穿刺路径上无明显血流信号,用COOK-19G 穿刺针进针,抽取胆汁,移除针芯,造影,插入导丝。导丝通过狭窄部进入十二指肠乳头,乳头活检钳拉出导丝,沿导丝置入十二指肠镜至乳头,乳头切开刀沿导丝插入胆管造影,于狭窄处放置胆管支架引流。

图1 超声引流原理图Fig.1 Schematic of EUS-BD
1.4.2 腔内胆汁引流术(EUS-CDS、EUS-HGS 及EUS-HDS) 在腔内引流病例中,整个过程都使用超声内镜来完成。如前所述选取胆管后,用导管、探条、球囊或乳头切开刀扩张肝肠瘘,在肝肠瘘处先置入鼻胆引流管外引流1 周,待肝肠瘘处窦道形成,拔出鼻胆管,沿窦道行支架置入术。扩张胆肠瘘的器械多样,包括导管、探条、球囊或乳头切开刀等,这些器械根据患者解剖结构及梗阻性狭窄的特点来选择。
1.4.3 EUS-AG EUS-AG 通过肝内穿刺引流在肝内胆管和上消化道造瘘,通过瘘管到达并扩张狭窄部位,于狭窄部位放置支架达到引流目的。超声内镜探及胆管并定位,选定穿刺点,彩色多普勒显示穿刺路径上无明显血流信号,予COOK-19G 穿刺针进针,抽取胆汁,沿穿刺针插入导丝,见导丝进入胆总管并穿出乳头或吻合口至肠腔,X 线监视下退出穿刺针,沿导丝使用乳头切开刀扩张瘘管,造影显示狭窄部位,对于恶性狭窄者推入金属支架。
1.5 术后处理
术后常规禁食、抑酸、抗感染、止血、保肝退黄及对症支持处理。
1.6 观察指标
①技术成功率:操作成功定义为在内镜和/或放射学上确定的理想位置放置支架或鼻胆引流管成功;②临床疗效:临床疗效评价根据手术前后总胆红素的下降情况进行疗效判断,统计学判断是否具有显著差异;③术后住院时间;④住院费用;⑤安全性:包括术后不良事件的发生率及严重程度。
1.7 统计学方法
采用SPSS 23.0 统计学软件对数据进行处理。计量资料以均数±标准差(±s)表示,采用配对样本t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 EUS-BD 的技术成功率与临床疗效
21 例患者中,手术成功者16 例,技术成功率为76.19%(16/21)。16 例手术成功者中,2 例接受EUS-RV 治疗,并植入胆道塑料支架(10Fr×11 cm,10Fr×7 cm);3 例接受EUS-HDS,留置鼻胆管外引流,并植入肝肠塑料支架(7 Fr×7 cm 双猪尾)1 枚;10例接受EUS-HDS 联合EUS-AG,植入胆道金属支架(1 例覆膜金属支架,9 例非覆膜金属支架)和肝肠塑料支架各1 枚;1 例仅接受鼻胆管外引流术。16 例手术成功的患者中,15 例1 周后总胆红素水平明显下 降,取得临床疗效良好[(175.91±77.23)和(131.25± 71.57)mmol/L,t=3.83,P=0.002],1 例 术 后 未 到达有效引流,转入肝胆科行超声引导下经皮经肝胆囊穿刺引流置管术(Ultrasound guided percutaneous gallbladder,PTGD)。因此,临床成功率为71.43%(15/21)。
2.2 EUS-BD 的安全性
共发生3 例与手术相关的不良事件。术中贲门黏膜撕裂伴出血1 例,术后消化道穿孔引起气胸1 例,胆汁漏合并菌血症1 例。不良事件发生率为14.29%(3/21),3 例患者均为男性,在内科保守治疗好转后出院。
2.3 住院时间和费用
手术成功的16 例患者平均住院时间为(20.56± 4.94)d,其中3 例出现并发症的患者平均住院时间为(28.67±5.13)d,EUS-RV 术式患者平均住院时间为(12.50±0.71)d。手术成功患者平均住院费用为(48250.08±16330.08)元,其中3 例并发症患者平均住院费用为(76829.13±18144.65)元,EUS-RV术式患者平均住院费用为(20235.29±4729.29)元。
2.4 典型病例
EUS-HDS 治疗胃癌术后胰头癌伴肝门部转移病例,该患者前期已行内镜超声胆道穿刺鼻胆管外引流,术中沿导丝置入双猪尾支架, 支架在位畅。见图2。EUS-RV 治疗2 次ERCP 失败的胃癌伴肝门部转移病例,术中沿导丝置入塑料支架1 枚,支架引流畅。见图3。EUS-AG 治疗胃癌术后转移性病灶侵犯胆总管下端病例,效果良好。见图4。

图2 EUS-HDSFig.2 EUS-HDS

图3 EUS-RVFig.3 EUS-RV
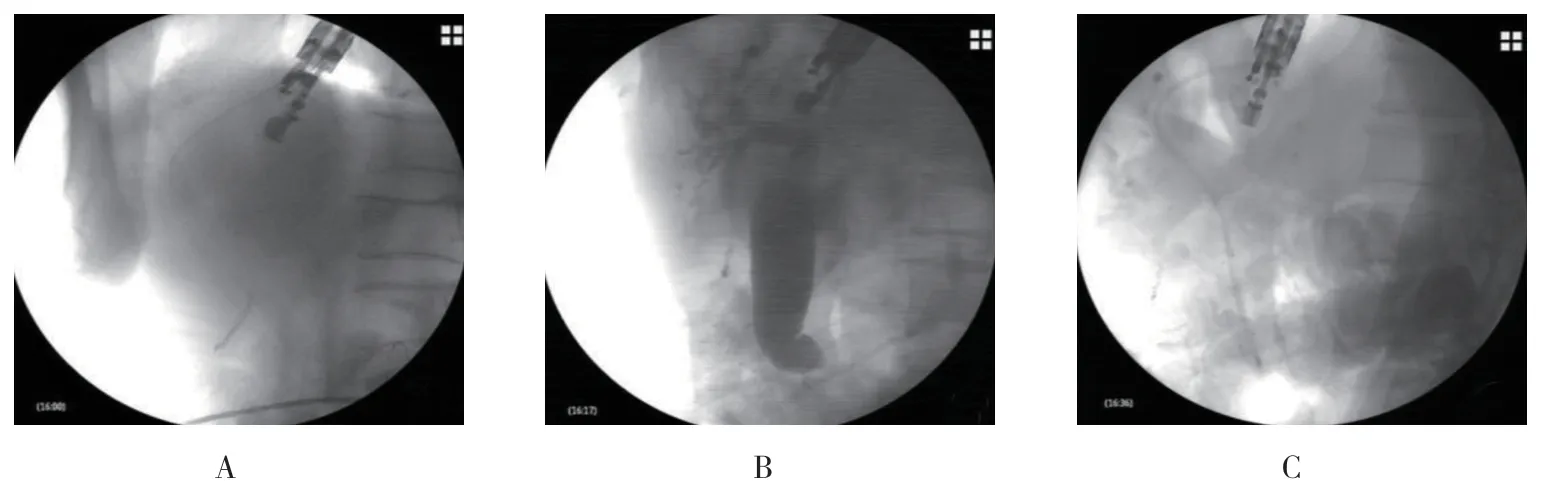
图4 EUS-AGFig.4 EUS-AG
3 讨论
近年来, EUS-BD 的快速发展并日渐成熟,在胃肠道及胆胰系统疾病的治疗及姑息治疗中应用广泛。在治疗胆道梗阻中,当常规ERCP 插管失败,或由于胃肠道梗阻以及外科手术导致解剖结构改变、乳头无法找到时,应当考虑EUS-BD。
本研究是对EUS-BD 的一项回顾性分析,并在部分患者中证明了该技术的有效性及安全性。共有21例患者在本院接受EUS-BD 手术,16 例获得技术成功(76.19%),其中15 例获得临床成功(71.43%),共发生3 例不良事件(14.29%),均在后续治疗中康复。5 例技术失败原因均为胆管扩张不明显,导丝无法超选。本研究发现,患有MBO 并在ERCP 手术失败后接受EUS-BD 治疗的患者中,男性多于女性,比例分别为80.95%和19.05%,PARK 等[3]和KHASHAB 等[4]的研究中报道了类似结果。目前对于性别分布趋势的报道较少。国外有文献[5-7]分析比较了EUS-BD 和PTCD 治疗ERCP 失败的MBO 患者的效果,共纳入的10 项研究显示,EUS-BD 及PTCD 技术成功率分别为76%~100%和46%~100%,临床成功率分别为62.2%~96%和25%~100%。EUS-BD 与PTCD 在技术成功率与临床成功率上相似,但EUS-BD 更安全,PTCD 术后并发症高达33%[8]。国外已有小样本前瞻性实验证实了EUS-BD 与ERCP 在治疗胆道梗阻时有相似的技术成功率、临床疗效以及安全性[9],但尚缺乏大样本多中心随机对照实验的研究[10]。
EUS-BD 与ERCP 相比,有以下优势:①EUS-BD 术后发生医源性胰腺炎概率较低;②通过ERCP 植入的支架更易发生肿瘤植入,而EUS-BD 的部分术式,如EUS-CDS,穿刺点远离引起梗阻的肿瘤组织,具有更长时间的支架通畅率[11];③发生支架功能障碍时,ERCP 术后患者须更换支架来引流胆汁,而EUS-BD术后患者因永久性胆肠瘘的形成,部分不予干预也能有效引流[10]。EUS-BD 与ERCP 相比,有以下缺点:①创伤性较大;②更高的住院费用与更长的住院时间;③更容易发生食物堵塞、胆漏、胆汁性腹膜炎[5]。而EUS-BD 与PTCD(ERCP 失败后传统的选择)相比,则具有以下优势:①创伤性小,EUS-BD 穿刺路径短,途径脏器少,并发症相对少,而PTCD 更容易继发胆汁性腹膜炎、酸碱平衡失调及水和电解质紊乱[12];②穿刺点选择范围大,引流途径多,肝左叶与胃壁紧邻,胆漏局限,而PTCD 容易受肝内胆管扩张等情况限制[13];③生活质量高,多数不必长时间携带外引流袋;④可在ERCP 术失败后即刻执行,减少拖延成本;⑤受腹水影响小[8,14]。
EUS-BD 术式选择尚无定论,其取决于患者自身条件,包括消化道解剖、梗阻部位及是否合并腹水等多因素综合,并受内镜医师自身偏好影响[15]。多数专家认为,EUS-RV 最安全,因其借力于ERCP 实现胆道引流,比腔内引流并发症更少[16-17]。EUS-CDS 一般用于治疗ERCP 失败后的远端胆道梗阻,近期有EUSCDS 用于一线治疗远端MBO 的报道[18]。EUS-HGS 与EUS-CDS 相似,区别是穿刺点不同,其局限在于:①胃壁与肝左叶不贴合,穿刺点与左肝内胆管存在位移,有穿刺失败的可能;②经食管途径可能发生纵隔炎;③肝硬化患者穿刺困难;④存在门静脉损伤风险;⑤置入支架直径较小。EUS-AG 更安全有效,但操作难度大,有关报道较少[19]。目前,有一种改良术式,即腔内引流联合顺行引流治疗MBO,本科多采用此法。该术式的不良事件发生率及维持支架通畅方面均优于EUS-HGS[20]。
本研究的经验是,若消化道解剖结构完整且导丝可穿出十二指肠乳头,首先尝试EUS-RV 术式。多数病例系胃癌、胰腺癌术后患者,消化道解剖结构改变,无法找到十二指肠乳头,常先予以肝肠穿刺,并于肝肠瘘处置入鼻胆管外引流(国外也有类似的报道[21]),1 周后再行支架置入术,支架置入部位包括肝肠瘘部位以及梗阻部位两处,即EUS-HGS 联合EUS-AG。这样做的优点在于:①缩短单次手术时间,降低不良事件发生率,且单次反复尝试超选胆管,穿刺针容易将导丝割破;②通过外引流有效减黄,改善患者一般状况,提高患者耐受力,同时可观察胆汁及引流效果;③提供2 次尝试机会,提高导丝超选成功概率,提高胆道支架置入的成功率;④外引流形成窦道后,再次手术无需穿刺,操作方便。这种方式也存在住院时间延长、住院费用增加的问题,有待进一步研究改进。
综上所述,EUS-BD 具有创伤性小、成功率高和并发症较低的优点,是ERCP 失败后治疗恶性梗阻性黄疸的有效替代手段,具有良好的应用前景。但其在术式、支架类型及规格选择、外引流必要性、窦道扩张器选择和操作流程规范上仍有诸多争议[22]。同时,在如何缩短住院时间及减少住院费用上,有待进一步研究完善。

