经腹腔镜行肝切除术的肝脏恶性肿瘤患者手术并发症的危险因素及预测价值分析
李贤杰,冯雪峰,周善学,范天逸
(宁波大学医学院附属医院 肝胆外科,浙江 宁波 315000)
原发性肝癌是我国发病率较高的常见恶性肿瘤疾病,随着内镜技术的不断发展和完善,腹腔镜肝切除术已成为我国原发性肝癌的首选治疗手段。临床研究[1-2]表明,术中出血量的控制是该术式最关键的环节,而出血量的大小与患者肝硬化的程度密切相关。术前有效地评估患者肝硬化的程度,对于手术效果以及术后并发症有着直接的关系。Fibrotouch 是利用超声技术通过对肝纤维化进行定量分析并得出肝硬度值(liver stiffness measurement,LSM)的创新技术,近年来,有临床研究[3-4]证实,LSM 与肝硬化程度呈明显的相关性,可作为反映患者肝储备状态的辅助诊断指标。然而,关于LSM 对肝切除术的影响则鲜有研究。因此,本研究观察LSM 对经腹腔镜肝切除术患者术后并发症的影响,探讨其对术后并发症的预测价值,旨在为临床手术方案的制定和优化提供帮助。
1 资料和方法
1.1 一般资料
经我院医学伦理委员会批准,选择2015年10月-2018年12月于我院住院行手术治疗的56 例肝脏恶性肿瘤患者作为研究对象。其中,男38 例,女18 例,年龄29 ~75 岁,平均年龄(56.03±5.14)岁。
1.2 纳入标准和排除标准
1.2.1 纳入标准 ①经临床检查和术后病理检查确诊为原发性肝癌;②自愿接受腹腔镜肝切除术;③肝功能分级为A 级或B 级;④患者术前自愿接受Fibrotouch 检查,检测结果有效,并针对研究相关内容签署知情同意书。
1.2.2 排除标准 ①合并有远处转移者;②继发性肝癌者;③既往有手术切除治疗史者;④术前已接受腹腔镜射频消融术、经导管肝动脉化疗栓塞术等治疗者;⑤临床资料缺失,或自愿中断术后治疗者。
1.3 手术方法
行腹腔镜肝切除术。由同一组医生进行手术,术前经影像学检查确定肿瘤定位、肿瘤大小以及病灶周围情况。患者全麻后取仰卧位,采用四孔法进行手术。气腹压力14 ~15 mmHg,中心静脉压保持≤5 mmH2O。依照先左后右的原则,依次切除左半肝和右半肝的病变部位,离断肝实质。肝门预置阻断带,当出血量增加时可采用间断Pringle 法阻断血流。确认肝脏断面无出血后,覆盖可吸收止血纱布,放置引流管,缝合伤口。术后所有患者均给予常规抗感染、保肝等治疗,监测血常规和肝功能指标,经超声检查无出血或淤积后拔管。
1.4 研究方法
1.4.1 观测指标及处理 根据患者术后30 d 内是否发生并发症,对患者的性别、年龄、乙型肝炎病毒(hepatitis B virus,HBV)感染、丙型肝炎病毒(hepatitis C virus,HCV)感染、体质指数(body mass index,BMI)、肝功能相关血液检测指标、肝功能分级、术前LSM、吲哚菁绿15 min 滞留率(indocyanine green retention rate at 15 minutes,ICG R15)、手术时间和术中出血量等临床资料进行单因素分析,对于影响术后并发症发生的指标进行多因素Logistic 回归分析。绘制术前LSM 与术后并发症的受试者工作特征曲线(receiver operating characteristic,ROC)图。
1.4.2 LSM 检测方法 由超声科丰富经验的同一医师采用Fibrotouch 进行检测,于肋间隙探测肝叶弹性回波,连续测量,取成功捕获的10 次回波,取中位数值为标准LSM,以成功捕获回波次数/总发射次数≥60%为检测结果有效的标准。
1.5 统计学方法
采用SPSS 24.0 软件进行统计学处理及分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验。计数资料以例数和百分比表示,比较采用χ2检验。影响因素的综合分析为非条件Logistic 回归,预测诊断价值分析为ROC 分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 影响腹腔镜肝切除术后并发症的单因素分析
本研究56 例患者术后发生并发症18 例,发生率为32.14%,包括:胸腔积液6 例,术后大出血3 例,腹腔脓肿3 例,肝功能衰竭3 例,多器官功能衰竭2 例,胆漏1 例。
根据是否发生并发症,将患者分为有并发症组(n=18)和无并发症组(n=38),并和临床及统计专家协商,列出可能影响腹腔镜肝切除术后并发症的因素及指标16 个,分别进行单因素分析。结果显示,术前LSM、ICG R15、术中出血量以及肝纤维化Ishake评分是患者术后并发症发生的影响因素(P<0.05)。见表1。
2.2 影响腹腔镜肝切除术后并发症的多因素分析
建立非条件Logistic 回归模型,以本次研究的56例行手术治疗的肝脏恶性肿瘤患者资料为样本,以腹腔镜肝切除术后并发症状况为应变量,赋值1=有并发症,0=无并发症。以前述单因素分析中P≤0.10的指标/因素为自变量。选择术前LSM、ICG R15、术中出血量及肝纤维化Ishake 评分等4 个指标作为自变量。其中前3 个指标为连续变量,参考两组总均值进行分段(分层),转化成两分类变量,以提高统计效率,使回归结果清晰。
回归过程采用后退法以进行自变量的选择和剔除,设定α 剔除=0.10,α 入选=0.05。回归结果:共有术前LSM 和术中出血量2 个变量被保留入回归方程(P<0.05,OR^ >1),ICG R15 被回归过程剔除,肝纤维化Ishake 评分和术前LSM 有共线性而未予保留。见表2。
2.3 术前LSM 和术中出血量作为预测术后并发症的诊断价值分析
经前述多因素分析知,术前LSM 和术中出血量均和术后并发症的发生密切关联,故对该二指标进行预测术后并发症的诊断价值分析。
2.3.1 术前LSM 和术中出血量指标的单独应用 仍以本研究两组资料为样本(其中18 例有并发症为阳性样本),再将术前LSM 和术中出血量两指标水平划分成7 或8 个组段,建立ROC 曲线诊断分析模型。经ROC 分析知:当术前LSM 为24 kPa、术中出血量大于350 ml 时,预测术后并发症发生的敏感性和特异性最佳,ROC 曲线下面积(area under curve,AUC)分别为0.794 和0.719。两个指标,特别是术前LSM,对术后并发症的发生具有较高的预测价值,在其理论阈值点处,敏感度和特异度均高于0.75。分析结果见表3和ROC 分析曲线见附图。
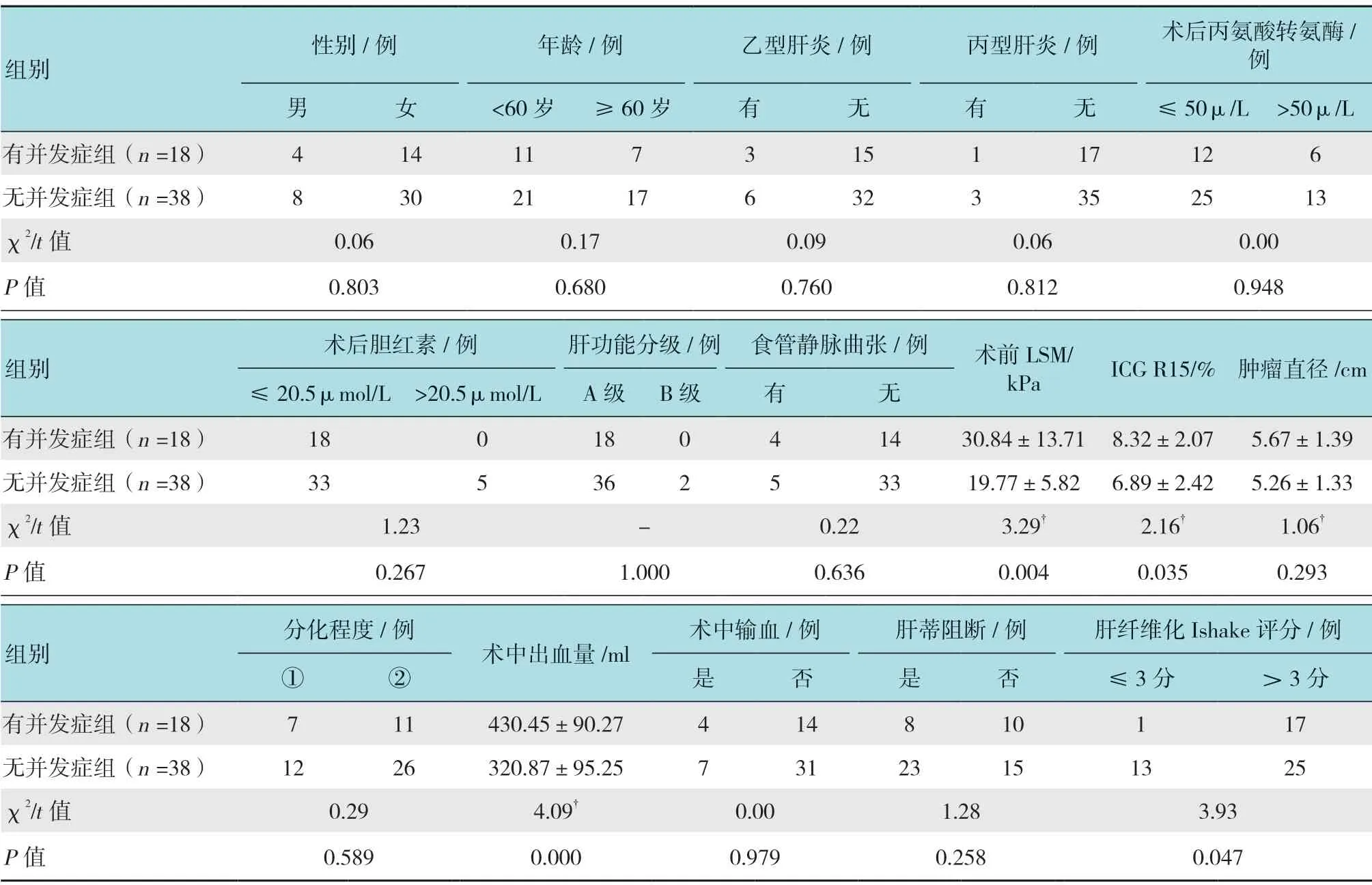
表1 影响腹腔镜肝切除术后并发症的单因素分析Table1 The univariate analysis of complications after laparoscopic hepatectomy

表2 Logistic 回归结果Table2 Logistic regression results
2.3.2 术前LSM 和术中出血量指标的联合应用 采用临床实用的综合联合诊断模式,仍使用两个指标各自的诊断阈值,两个指标同为阳性或阴性时做阳或阴性诊断,否则进行复测。若复测结果不变,则结合专业实践及医师观点进行诊断,并侧重考虑术前LSM 指标。以本研究样本实测计算显示,LSM 和术中出血量指标的联合应用,预测术后并发症的灵敏度和特异度分别为0.833(15/18)和0.816(31/38)。LSM 指标若联合术中出血量指标进行预测诊断,其诊断效能还能有明显的提高。见表3。
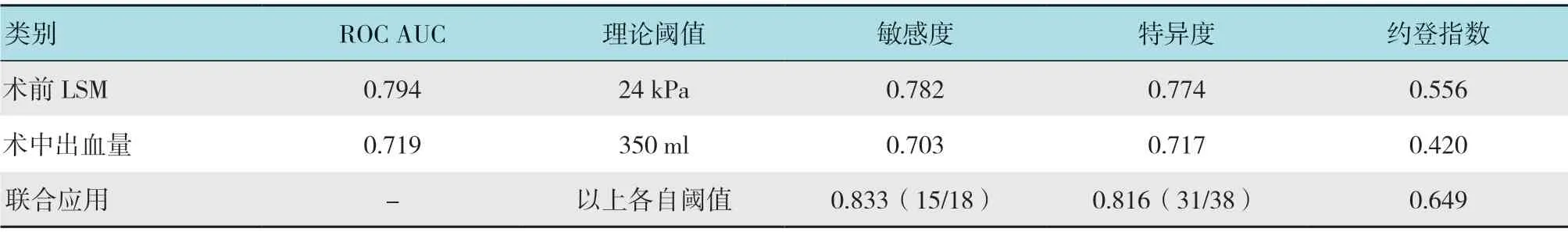
表3 术前LSM 和术中出血量指标单独和联合应用的诊断价值分析结果Table3 The analysis results of the diagnostic value of LSM and intraoperative blood loss indicators alone and in combination

附图 术前LSM 和术中出血量指标ROC 曲线Attached fig.ROC curve of LSM and intraoperative blood loss
3 讨论
3.1 肝癌患者术后并发症研究现状
外科手术是目前治疗肝脏恶性肿瘤的最佳方案,由于肝移植术受供体器官缺乏和配型成功率低下的影响,肝切除术相比肝移植术在临床的应用更多,成为最广泛的肝癌治疗方法。随着内镜技术的发展,通过腹腔镜进行肝切除术,可大大降低手术患者组织器官的损伤,缩短机体的恢复时间。近年来,对于肝癌术后患者的生存率研究[5]表明,肝癌患者的远期生存率已有了明显的提高。但是,在肝切除术后手术相关并发症的发生率仍然居高不下,其中肝衰竭和死亡是发生率最高的,也是最为严重的并发症[6-8]。有临床研究[9]表明,是否伴有肝硬化以及肝硬化的程度与肝癌切除术治疗患者预后密切相关。韩秀国等[10]临床观察肝硬化肝癌和无肝硬化肝癌患者发现,肝硬化肝癌患者发生围手术期肝衰竭和死亡的风险相比无肝硬化肝癌患者大大增加,肝硬化为影响并发症发生的独立危险因素。李四桥等[11]的临床研究显示,肝切除术后患者术后并发症的发生率为36.80%,主要包括胸腔积液、腹腔积液、腹腔大出血、胆漏、肝功能衰竭、肺部感染、多器官功能衰竭、肝旁脓肿以及肺部感染等。本研究纳入的56 例行腹腔镜肝切除术患者术后共发生并发症18 例,发生率为32.14%,其中以胸腔积液发生率最高,占比33.33%,其次为术后大出血、腹腔脓肿、肝功能衰竭,各发生3 例,多器官功能衰竭2 例,胆漏1 例。本研究结果与上述国内相关研究[10-11]结果一致。
3.2 肝切除术后并发症影响因素
本研究单因素分析结果显示,术前LSM、ICG R15、 术中出血量以及肝纤维化Ishake 评分与患者术后并发症发生有关,经Logistic 回归分析显示,术前LSM 与术中出血量是影响肝切除术后并发症发生的独立危险因素。既往研究[12]认为,术中出血量较大可增加患者术后并发症的风险,甚至对肝癌患者术后无瘤生存期有着明显的影响,临床学者认为,术中出血量大可能引发肿瘤溢出和肿瘤细胞的扩散,加速肿瘤的复发,使患者的无瘤生存期缩短。另一方面,术中大量失血可能因全身性低灌注以及由此所致的组织器官长期供氧不足所致,在此条件下,也可增加患者术后全身炎症反应的发生风险,并无法为抗肿瘤免疫细胞因子提供良好的条件,以致预后不良[13]。因此,对于择期进行肝切除术的患者,做好术前评估,充分准备有效的止血措施和止血材料,最大程度地控制出血量,对患者术后恢复有重要的作用。
术前LSM 是应用Fibrotouch 基于肝脏瞬时弹性成像技术对肝脏纤维化程度进行定量分析的检测技术,“中国慢性乙型肝炎防治指南”[14]认为,Fibrotouch 技术可准确有效的对肝硬化进行诊断,判断肝纤维化程度,并表示其与血清相关指标联合应用,可进一步提高对于肝纤维化的诊断准确率。诸多研究结果[15-16]也证实,通过应用Fibrotouch 检测LSM,在评估肝硬化程度方面相比常用的其他评估方法,如Fib-4 指数、Fibrotest 和FibroScan 等,其准确性更高,特别对于重度肝纤维化,优势更加明显。本研究根据术后是否发生并发症进行分组比较后显示,发生术后并发症的患者术前LSM明显高于无并发症患者,进一步分析表明,术前LSM水平越高,患者术后发生并发症的风险越大。笔者认为,术前肝纤维化程度可直接反映出患者肝功能受损程度,即LSM 值越大,表明患者的肝功能受损越严重,在此情况下,患者的肝代偿能力及心、肾等其他器官功能水平均较肝纤维化程度较低的患者明显下降,患者的手术耐受性差,术后康复能力弱,更加容易发生手术相关并发症。同时,对于严重肝硬化患者来说,往往伴有不同程度的凝血功能障碍、门静脉高压等,在进行肝切除术时,出血量也会大大增加,结合上述相关分析,必然影响患者术后并发症的发生风险。
3.3 术前LSM 与术中出血量对术后并发症的预测价值
本研究ROC 分析显示,当LSM 为24 kPa、术中出血量> 350 ml 时,其独立预测术后并发症发生的敏感度和特异度最佳,ROC AUC 分别为0.794 和0.719。两个指标,特别是术前LSM,对术后并发症的发生具有较高的预测价值,在其理论阈值点处,敏感度和特异度均高于0.75。若将术前LSM 和术中出血量指标联合应用,预测术后并发症的灵敏度和特异度均较独立预测增高,分别为0.833 和0.816。承文龙等[17]通过Meta 分析显示,术中失血量是导致肝癌切除术后感染并发症的独立危险因素,但尚缺乏该因素对术后并发症的预测分析。陈熙等[18]研究结论与本文一致,均证实术前LSM 水平增高是导致肝癌切除术后并发症发生的独立危险因素,但在预测术后并发症的术前LSM 理论阈值方面存在差异,推测其原因为:随着肝硬化程度的加重,手术过程中出血的控制程度也更加困难,由此出现的气腹压力骤降、断面暴露不佳或医生推压止血不足等,均可能导致术后肝功能不全的发生。因此,手术过程中操作流程、医生应急处理能力以及止血方式等均可能影响术后并发症的发生,从而可能会对LSM 水平的研究造成影响。
综上所述,术前LSM 对预测肝脏恶性肿瘤患者腹腔镜下肝切除术后并发症的发生具有较高的预测价值,且联合术中出血量预测价值更高。

