高考中热点电化学试题分析与评价
徐俊龙


笔者分析近几年全国各地高考试题与高考模拟题,对电化学这部分的热门考点进行相关整理,从必备知识、关键能力、思维方法、核心素养等角度阐述命题规律,供各位同学在今后的高考备考参考。
一、原电池装置的考查变迁
对于原电池的认识,从必修二中简单的原电池,到选修四化学反应原理中的带盐桥的原电池,以及后续高中出现带隔膜的原电池,均是化学核心素养中的证据推理与模型认知、科学探究与创新意识的具体应用,也是学生思维螺旋式上升的具体体现。高考试题对这些方面也进行了细致考查,下面通过具体实例来说明。
【例1】[2013年广东卷,33题(2)节选]设计两种类型的原电池,探究其能量转化效率。限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq),铜片,铁片,锌片和导线。
(2)①完成原电池甲的装置示意图(补充完整图1),并作相应标注。
要求:在同一烧杯中,电极与溶液含相同的金属元素。
②铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极_____________________。
③甲、乙两种原电池中可更有效地将化学能转化为电能的是________,其原因是_______________________________。
【分析与解答】①根据题给信息,找出金属活动性的差异,将不同的金属片置于烧杯中,注入含对应阳离子的溶液,组装好装置,并标清楚电极、溶液、导线,可以绘出三种合理的组合(由物理知識可知金属活动性差异越大,电势差越大),当年高考时有些同学没有画出溶液或电极与导线相连的示意图,或没有标注电极或标清楚溶液等导致扣分。具体参考答案见图2所示:
②乙池的示意图见图3所示,此时负极的现象:既有电化学腐蚀的现象(溶解),也有直接接触的化学腐蚀,产生铜附着在锌的表面。本问与下面③问是一脉相承,具体规范答案是两个方面来回答:A. 电极逐渐溶解;B. 有红色固体析出。
③在原电池甲(图2)中,负极不与CuSO4溶液直接接触,所发生的化学反应只有原电池反应,而在原电池乙(图3)中,负极Zn与CuSO4溶液直接接触,所发生的化学反应除原电池反应以外,还有非原电池反应,产生热量损失,因此,在原电池甲和乙中,甲可更有效地将化学能转化为电能。本问的答案为:装置甲;电池乙的负极可与CuSO4溶液直接发生反应,导致部分化学能转化为热能;电池甲的负极不与所接触的电解质溶液反应,化学能在转化为电能时损耗较小。
【评注】带盐桥的原电池中考查盐桥的作用,在高考范畴中首次全面考查就是2013年广东卷的这道题,几乎所有教辅资料均有转载,而②问的答案绝大多数教辅资料上是以讹传讹,只给第一条,没有答化学腐蚀直接反应生成红色固体的现象。关于盐桥的作用,在中学阶段不妨从以下三点来理解(严格讲盐桥还有消除液接电势的重要作用,但超出课程标准要求):(1)构成闭合回路,形成原电池;(2)避免电极与电解质溶液直接反应,有利于最大程度地将化学能转化为电能;(3)盐桥中的阴、阳离子定向迁移,使溶液保持电中性,反应持续进行,能长时间稳定放电。回顾自2004年实施新课标以来的新高考(2007年起)试题中,带盐桥的装置已经多次考查。例如:2020年全国I卷第27题(2)考到电池装置中盐桥中的电解质溶液的选择问题,强调盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且给出信息,离子的电迁移率(u∞)应尽可能地相近。再如:广东卷2008年第5题考了带盐桥原电池的细节问题,只是该题并未给出装置图,同学们可以自己脑补一下。此外,2007年海南卷第14题是新课标(2003年版)高考中具有里程碑意义的首次考带盐桥的高考题。此后,考查情境不断翻新和升级,图4列举了几道经典的带隔膜的原电池装置:2014年福建卷第11题考带隔膜的,当年得分率极低,2015年全国I卷第11题考微生物燃料电池是带隔膜装置,2015年天津卷第4题考带隔膜装置等等……这些都是带盐桥的装置的进一步的创新。在电解原理应用中,带隔膜的装置也普遍出现,值得大家研究和厘清相关问题。
二、常考的各种新型化学电源考查方式
众所周知,现代生活与各种电源息息相关,例如手机等移动设备中的电池等。近几年高考中电化学题型多以新型化学电源为背景,而这些电池大多取材于真实的文献素材,经过加工处理编制成试题呈现在大家面前。面对新颖奇特的电池相关试题,该如何快速得出答案,这成为每位考生必须直面的问题。梳理一下,不难发现有规律可循,具体实例如下:
【例题2】(2020年全国III卷,12题)一种高性能的碱性硼化钒(VB2)-空气电池如图5所示,其中在VB2电极发生反应:VB2+16OH--11e- = VO■+2B(OH)-4+4H2O该电池工作时,下列说法错误的是
A.负载通过0.04 mol电子时,有0.224 L(标准状况)O2参与反应
B.正极区溶液的pH降低、负极区溶液的pH升高
C.电池总反应为4VB2+11O2+20 OH-+6H2O = 8B(OH)-4+4VO■
D.电流由复合碳电极经负载、VB2电极、KOH溶液回到复合碳电极
【分析与解答】关于硼化钒的碱性燃料电池几年前就见报道,并出现在各类高考模拟题,本题素材是真实的学术背景,题给装置图和负极反应,结合所学知识,不难解决:当负极通过0.04mol电子时,根据电子守恒可知,正极也通过0.04 mol电子,可判断本题装置中用的是阴离子交换膜,根据正极的电极方程式:O2+4e-+2H2O= 4OH-可知,通过0.04 mol电子消耗0.01 mol O2,而0.01 mol O2在标准状况下体积为0.224 L,A正确;放电过程中,根据两极电极反应式可知:正极生成大量的OH-会使正极区pH升高,正极产生的OH-会通过阴离子交换膜迁移到负极,负极消耗OH-使负极区OH-浓度减小pH降低,B错误;写出正极电极反应式和负极电极反应相加,使电子守恒,即可得出电池的总反应为:4VB2+11O2+20 OH-+6H2O = 8B(OH)-4+4VO■,C正确;电池放电时,外电路中,电子由负极(VB2电极)经导线和负载流向正极(复合碳电极),电子没有流经溶液!电流方向是正电荷的流向,外电路中电流方向与电子流向相反,内电路中(溶液中阳离子移向正极)电流由负极流向正极,故电流流向为复合碳电极→负载→VB2电极→KOH溶液→复合碳电极,D正确。
【例题4】(2014年北京卷,28题)用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1 mol·L-1的FeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压数值):
(1)用KSCN检验出Fe3+ 的现象是____________________。
(2)I中,Fe3+ 产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+ 氧化。写出有关反应:________________________
___________________________。
(3)由II推测,Fe3+ 產生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有_________性。
(4)II中虽未检验出Cl2,但Cl- 在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:
①NaCl的浓度是_________ mol·L-1。
②IV中检测Cl2的实验方法_________________________
___________________________。
③与II对比,得出的结论(写出两点):______________
___________________________。
【分析与解答】本题背景是真实工业情境的应用,在2013年福建卷第23题和2013年天津卷第9题均有考查,曾引起广泛讨论。2014年北京卷就是在此背景下,通过具体真实实验来设问。(1)用KSCN检验出Fe3+的现象是溶液变红,学生多数能答对,个别答成红色沉淀而不得分;(2)根据表格中I描述的现象可知,阳极产生了Cl2和Fe3+,一种普遍的观点认为阴离子在阳极放电,故先生成氯气,氯气再氧化Fe2+,具体涉及到的反应为:2Cl--2e-=Cl2↑和Cl2+2Fe2+=2Fe3++2Cl-;(3)II和I对比,电压降低了,无Cl2产生,则有的观点认为是Fe2+的还原性比Cl-强,因此Fe2+先放电;(4)采用控制单一变量法进行实验:阳离子换成无还原性的Na+,阴离子Cl-的浓度保持不变,故①NaCl的浓度应该选用0.2 mol·L-1;②检验氯气,可以利用其氧化性,注意氯气在溶液中有一定的溶解度,故具体应该为:取少量阳极附近的溶液,滴在淀粉碘化钾试纸上,试纸变蓝;③因为在电压为a时有Cl2和Fe3+ 产生,在电压为b时无Cl2有Fe3+ 产生,电压小于b两者均无,现在控制单一变量,氯离子浓度相同,无Fe2+ 存在,在电压a和b之间再引入一个中间量的电压c,得出IV和V的结论,因此说明:A. 通过控制电压,证实了产生Fe3+ 的两种原因都成立;B. 通过控制电压,证实了产生Fe2+先于Cl-放电。
【评注】电解的相关考查中,学生最大困惑就是电极放电顺序问题,导致电极反应式书写出错。一些教辅资料过多总结,例如认为:“阴离子在阳极放电,阳离子在阴极放电”,这在很多同学脑海里根深蒂固,认为这是一成不变的!本题从实际出发设计巧妙,考查学生的宏观辨识与微观探析、证据推理与模型认知、科学探究与创新意识等化学核心素养。让他们认识到电极放电的影响因素其实很多,例如电压、粒子浓度、电极材料、电极距离和面积等因素有很大关系。其实高考考查阳离子在阳极放电也有很多,例如2014年全国II卷第27题(3)考查:Pb2++2H2O-2e-=PbO2+4H+;最高价含氧酸根也有可能放电:例如2009年江苏卷第16题(4)考查: 2SO■-2e-=S2O■等;此外电解池中并不一定是非自发的反应才用电解,若是自发反应,采用电解则速率更快,例如2012年上海卷第14题考查:Zn+2H+=Zn2++H2↑,给出一个不完整的图,考查应该如何设计的问题,值得各位同学认真思考。
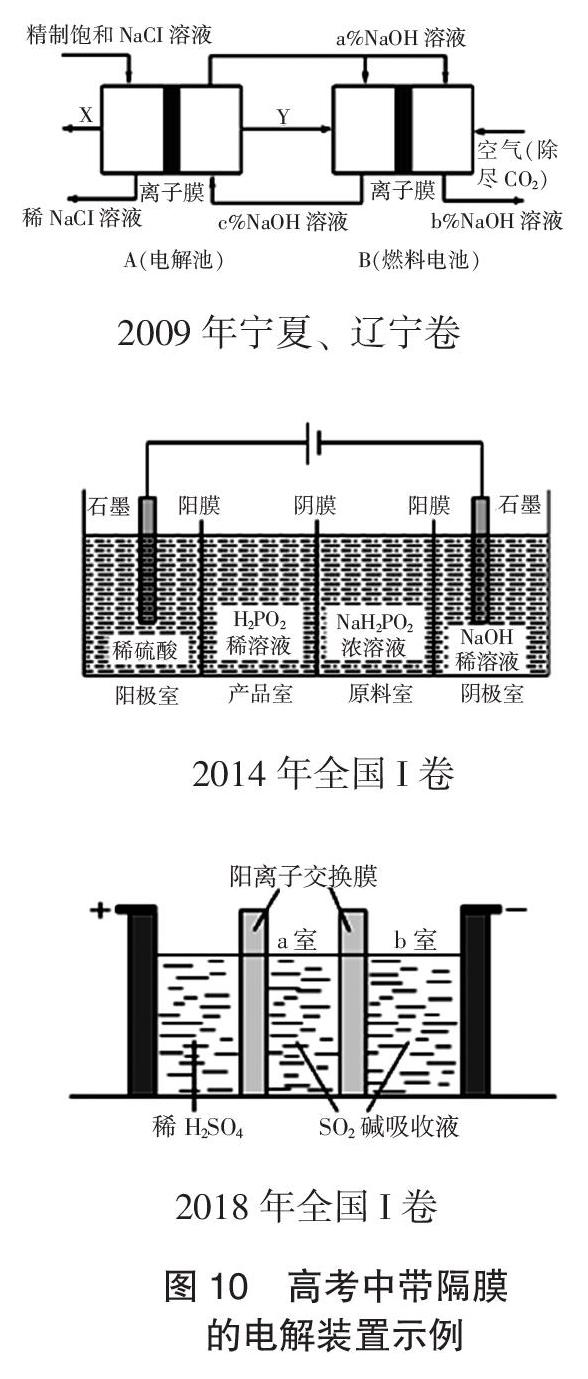
此外,各种带隔膜的电解装置的考查也是不少老师进行的重点专题复习,值得仔细研究。图10列出几道高考题的装置图,请大家找到对应高考题自己仔细研究:2009年宁夏、辽宁卷第27题(3),2014年全国I卷第27题(4),2018年全国I卷第27题(3),去深刻领会命题人的命题立意,触类旁通,在今后就能够创造性的解决各种新问题。
电解的有关计算,需要看清楚是并联电路还是串联电路,看清楚电解前溶液中是否发生了反应,例如离子反应生成沉淀或气体等,电解过程中是否存在后续反应,例如先生成什么,后生成什么等等。另外还可能考查法拉第电解定律及法拉第常数,法拉第常数F=9.65×l04C·mol-1,这个在2010年新课标全国卷第35题(4)(湖南省用的化学与生活选考题中),2012年海南卷第16题(3)、2013年全国卷I第28(5)、2015年全国II卷第26(2)均考查有关法拉第常数计算的应用。
四、金属的腐蚀及防护在高考中的考查方式
金属的腐蚀问题是世界性的难题,防护就显得尤为重要,课本上介绍的一些腐蚀和防护的原理在实际生产和生活中息息相关,对化学核心素养中除了上述的几个维度外,专门对科学态度与社会责任这个维度进行了很好的阐述和考查。平时同学们对课本不够重视,因此考到实际问题学生容易出错,下面具体看高考题。
【例题5】(2017年全国I卷,11题)支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图11所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是( )
A.通入保护电流使钢管桩表面腐蚀电流接近于零
B.通电后外电路电子被强制从高硅铸铁流向钢管桩
C.高硅铸铁的作用是作为损耗阳极材料和传递电流
D.通入的保护电流应该根据环境条件变化进行调整
【分析与解答】本题在最新版人教版《反应原理》P113第7题收录了本题,素材取自老人教版选修四课本86页(下同)倒数第二段话(最新的人教版反应原理在111页),图像取自课本87页图4-20略加修改。这道题是2017年全国I卷理综化学选择题中得分率最低的一道题目,广东省全省本题的得分率37%,错选A、B、D的人数高达63%实在是出乎意料之外。其实仔细阅读题意,这是外加电流的阴极保护法,钢管桩为阴极,电子被强制流向被保护的阴极钢管柱,阴极被保护,钢管桩表面腐蚀电流是指铁失去电子形成的电流,接近于零,铁不容易失去电子,A正确;电解池的外电路中,阳极上发生氧化反应,失去电子,电子由阳极流向正极,由电源的正极经外电路流向阴极,B正确;高硅铸铁做阳极,阳极上发生氧化反应,但是题给信息这个高硅铸铁是惰性电极,不是普通的铁做阳极为活泼电极,故阳极不被损耗,阳极上主要是海水中的水被氧化生成氧气,C错误;根据海水对钢管桩的腐蚀情况,增大或减小电流强度,D正确。本题错误的主要原因就在于,不少同学一看到阳极含铁,就以为是活泼电极,会被损耗,而认为C是正确的,这是思维定式和不看题给信息所造成的,从而错选其他三个不常见的叙述答案,以为是错的,其实这三个选项在课本有叙述。像这样的问题值得我们警示,在后期高考中不要再出现。
【评注】金属的腐蚀和防护问题课本介绍篇幅较少,平时复习和练习时容易出现盲点,导致考试时容易出现意想不到的问题。因此,有必要把这些系统的搞清楚,选择恰当的题目进行训练,例如吸氧腐蚀与析氢腐蚀的问题,有些同学可能出现孤立地看待,其实可以通过2014年安徽卷第28题进一步来训练学生的各项能力,辩证看待问题。其实腐蚀并不是一无是处,一分为二的来看待,也可以加以利用:例如吸氧腐蚀的原理来测空气中氧气的含量、制成双吸剂(吸氧和吸水)在食品包装里面、一次性保暖贴等。再例如课本P87科学探究验证牺牲阳极的阴极保护法,2018年北京卷第12题对这个方法进行改进,值得关注;关注课本的习题及其改编,例如课本P88页第10题改成的2016年北京卷第12题,这道高考题当年也是得分率极低,值得反思。
电化学中同学们普遍觉得困难的是电极反应式的书写问题,这个在众多资料书上有介绍,每位老师都会有专门的讲解和针对训练,限于篇幅,本文不再赘述电极反应的书写问题。此外,有些题目考查跨学科综合考查,例如2018年全国I卷,出现比较电极上的电势高低等。最后,笔者觉得有个题目有必要再提一下,限于篇幅,不具体列出,请各位具体翻看高考原题:2011年广东卷第32题(4)、2014年山东卷第30题(1)、2015年广东卷第32题(5),这三年都是重复考离子液体中来电镀铝工艺,以阴极反应为例:4Al2Cl-7+3e-=Al+7AlCl-4,这个电极反应式的书写确实难度较大,后续各种模拟题对这个考点也是层出不穷(最新鲁科版《反应原理》中P43第9题也引入此考点),它作为书写电极反应式来说,是个极好的训练素材,值得仔细玩味来彻底弄懂,然后再迁移应用到其他,定会妙不可言,屡试不爽。因此,在前人的基础上研究高考题,找出命题规律和完善自己知识体系、提升自己的关键能力,以不变应万变,从而避免重蹈覆辙,只有这样才能在高考中立于不败之地!
责任编辑 李平安

