枸杞多糖及其硫酸化产物的免疫调节活性
孙玉姣,高润凝,崔湘怡,张 楠
(陕西科技大学 食品与生物工程学院,陕西 西安 710021)
0 引言
多糖广泛存在于自然界,是一类重要的生物信息分子.它们参与了细胞识别、生长、分化、机体代谢、胚胎发育和免疫应答等许多重要的生命活动.免疫调节活性是多糖最重要的生物活性,多糖免疫功能的发挥可直接或间接影响多糖发挥抗肿瘤、抗病毒、抗氧化等其他功能.多糖作为免疫调节剂,是许多药食两用植物最重要的免疫活性成分,不仅能激活巨噬细胞、T/B淋巴细胞和NK细胞等免疫细胞,调节靶细胞的细胞因子分泌,促进抗体生成,还能激活补体系统,增强红细胞免疫功能等[1];而且多糖的免疫调节活性是通过宿主中介起作用,无毒副作用,不影响正常细胞.因此,多糖的免疫调节活性研究引起了人们极大兴趣[2].
近年来,多糖的化学分子修饰,尤其是硫酸化修饰受到了食品化学、医药科学等领域工作者的广泛关注.硫酸化修饰是通过化学方法在多糖分子结构中引入硫酸基团,从而使多糖糖链中单糖分子的羟基被硫酸基团取代.相比天然多糖,硫酸化修饰多糖具有更加广泛和优越的生物活性[3,4].研究发现,部分多糖经过硫酸化修饰后,免疫调节活性显著增强,主要表现为促进脾淋巴细胞和巨噬细胞增殖以及刺激细胞因子分泌等方面[5,6].此外,多糖经过硫酸化修饰后,生物活性增强,可以有效提高多糖的利用率,对其开发与应用具有深远意义.
阿拉伯半乳聚糖(Aragalactan)的免疫调节活性已得到广泛认可,研究发现,从枸杞中提取的多糖类型均为阿拉伯半乳聚糖.枸杞(Lycium bararum L.)是我国一种药食两用物质,有“补肾益精,养肝明目”的功效,民间多用来作为延年益寿的补品,也是进行食品或保健食品开发的重要原料.近年来,现代药理学研究发现枸杞具有明显的免疫调节作用,其中多糖是枸杞发挥免疫调节活性的重要物质基础[7].因此,本研究拟以枸杞多糖为模型分子,通过对枸杞多糖进行硫酸化修饰,研究硫酸化修饰对多糖免疫调节活性的影响.本研究的开展有助于在分子水平上深入探讨硫酸化多糖免疫调节活性的作用机制,为多糖的目的性筛选和定向硫酸化修饰提供理论依据.此外,通过硫酸化修饰,可扩大并优化枸杞多糖的免疫调节功能,有助于拓宽其在功能性食品方面的开发和应用.
1 材料与方法
1.1 实验材料、试剂和仪器
1.1.1 实验材料
枸杞干果购于陕西省西安市中药材市场,产地为宁夏省中卫市.
1.1.2 实验试剂
葡聚糖标准(相对分子质量分别为5、12、25、50、80和150 kDa)、硫酸化试剂三氧化硫-吡啶复合物(SO3·Py)、二甲基亚砜(DMSO)、MTT(四氮唑蓝)和脂多糖(LPS)购于美国Sigma-Aldrich公司;DEAE-52纤维素填料购于上海恒信化学试剂有限公司;Sephadex G-100凝胶填料购于瑞典Pharmacia有限公司;RAW 264.7细胞株购于中国科学院上海细胞库;胎牛血清(FBS)、DMEM培养基、链霉素、青霉素、中性红染料、磷酸对硝基苯酯和Triton X-100购于上海生工生物工程股份有限公司;NO测定试剂盒购于碧云天生物技术研究所;IL-1β和TNF-αELISA试剂盒购于武汉基因美科技有限公司;RNA抽提试剂Trizol、PrimeScriptTM RT和SYBR-Green PCR试剂盒购于Takara公司;其余试剂都是国产分析纯.
1.1.3 实验仪器
T6新世纪型紫外-可见光分光光度计,北京普析通用仪器有限公司;BS-IOOA型自动部分收集仪,上海沪西分析仪器厂;EQUINOX-55型红外光谱仪,德国Bruker公司;Waters 2695型高效液相色谱仪,美国Waters公司,2414示差折光检测器、色谱柱TSK-gel G4000SW,7.5 mm × 30.0 cm,日本Tosoh公司;Multiskan Ascent酶标仪,美国Thermo公司;CFX Connect Real-Time PCR 仪,美国Bio-Rad公司.
1.2 实验方法
1.2.1 枸杞粗多糖LBP的提取
枸杞粗多糖LBP的提取和分离纯化采用前期已建立的方法[8].将100 g枸杞干果浸泡在400 mL的蒸馏水中,在室温放置2 h后,将浸出液浓缩到体积为50 mL.提取过程重复两次,合并提取液.然后加入4倍体积的95%(v/w)乙醇,过夜放置于4 ℃环境下.再将溶液于4 ℃离心,沉淀部分溶于50 mL的蒸馏水中.采用Sevag法(氯仿∶正丁醇=4∶1,v/v)除去游离蛋白,重复6~7次,待溶液中不形成白色凝胶状沉淀为止.最后将此溶液对水透析,浓缩和冻干,得到枸杞粗多糖LBP.
1.2.2 枸杞多糖LbGp1和LbGp4的分离纯化
采用DEAE-52型弱碱性(HCO3- form)的阴离子交换柱(5.0 cm × 50 cm)对得到的枸杞粗多糖分离.取1 g LBP溶于10 mL的蒸馏水中,离心取上清后上样.依次用500 mL的蒸馏水,0.05 mol/L、0.10 mol/L、0.25 mol/L和0.5 mol/L NaHCO3洗脱,洗脱液流速为1.0 mL/min.同时自动收集洗脱液,每管8 min.收集完毕后,用紫外-可见光分光计隔管检测蛋白吸收(280 nm)和糖吸收(490 nm,苯酚-硫酸法).根据蛋白和糖的光吸收值,绘制出洗脱曲线,将同一色谱峰的洗脱液合并后,透析,浓缩,冻干.经过阴离子交换柱的分离,一共得到了五个组分,分别为Lbp1、Lbp2、Lbp3、Lbp4和Lbp5.
将Lbp1和Lbp4用Sephadex G-100凝胶柱(2.0 cm × 100 cm)进一步纯化,取80 mg Lbp1和Lbp4上样,用0.1 mol/L NaCl缓冲液洗脱,流速为0.5 mL/min.将洗脱曲线中的主要组分收集起来,透析,浓缩,冻干,得到LbGp1和LbGp4.
1.2.3 总糖含量的测定
总糖含量的测定采用苯酚-硫酸法[9].以Ara为标准,绘制标准曲线.将Ara配制成浓度为0.2 mg/mL的标准溶液,分别吸取0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL、0.6 mL、0.7 mL、0.8 mL、0.9 mL和1.0 mL于试管中,每管用蒸馏水补到2.0 mL.依次加入50μL的80%(w/v)苯酚溶液和2.5 mL的浓硫酸.摇匀后,在室温下放置20 min,于490 nm处测定光吸收值.2 mL的蒸馏水作为空白对照,同样按上述方法操作.平行做三份,求出各个浓度吸光度的平均值.将得到的结果制作标准曲线,横坐标为标准单糖质量,纵坐标为平均吸光度值,得到线性回归方程.
样品的总糖含量测定:将LbGp1和LbGp4配制成浓度为2 mg/mL的溶液,吸取各样品溶液0.1 mL,按以上操作方法测定其吸光度值.根据回归方程计算各个样品的总糖含量.
1.2.4 非选择性硫酸化修饰
分别称取20 mg、40 mg和80 mg三乙胺-三氧化硫,加入25 mL二甲基甲酰胺和300 mg枸杞多糖,于50 ℃搅拌反应12 h.反应完成后,用5 mol/L NaOH中和反应物,加入三倍体积95%乙醇,静置过夜后离心,收集沉淀物,干燥,然后溶于少量蒸馏水,用截留分子量为300 Da的透析袋透析,冻干,命名为LbGp1-SL、LbGp1-SM和LbGp1-SH以及LbGp4-SL、LbGp4-SM和LbGp4-SH.
1.2.5 巨噬细胞株 RAW 264.7的培养
RAW 264.7细胞用含有1%双抗(青霉素和链霉素)和10%胎牛血清的DMEM培养液培养.放置于二氧化碳恒温培养箱内培养,培养条件为37 ℃、5% CO2,隔天传代.
1.2.6 细胞活力的检测
收集对数生长期细胞,调整细胞悬液浓度为5×104cell/mL,接种于96孔培养板,每孔100μL,37 ℃、5% CO2培养24 h.加入不同浓度硫酸化枸杞多糖(25、50、100、150、200μg/mL)150μL,以培养液作对照,药物处理24 h,加入100μL的MTT溶液(5 mg/ml),37 ℃、5% CO2,继续培养4 h.弃上清,每孔加入100μL的DMSO,温室振荡10 min.用酶标仪于490 nm处测各孔的吸光度[10].
1.2.7 细胞吞噬能力的检测
采用吞噬中性红实验检测枸杞多糖对RAW 264.7细胞吞噬能力的影响.收集对数生长期细胞,调整细胞浓度为5×104cell/mL,接种于96孔培养板,每孔100μL,37 ℃、5% CO2培养24 h.加入不同浓度硫酸化枸杞多糖(25、50、100、150、200μg/mL)150μL,并以150μL脂多糖(LPS,1μg/mL)和培养液分别作为阳性对照和空白对照.培养24 h后,弃细胞培养液,每孔加入0.1%中性红生理盐水溶液100μL,继续培养4 h,每孔加入150μL的细胞裂解液,37 ℃放置1 h,振荡均匀,用酶标仪于540 nm处测各孔的吸光度[11].
1.2.8 NO含量的检测
收集对数生长期细胞,调整细胞悬液浓度为5×104cell/mL,接种于96孔培养板,每孔100μL,37 ℃、5% CO2培养24 h.加入不同浓度硫酸化枸杞多糖(25、50、100、150、200μg/mL)150μL,并以150μL LPS(1μg/mL)和培养液分别作为阳性对照和空白对照,继续培养24 h后,进行检测.采用NO检测试剂盒检测NO含量.用酶标仪于492 nm处测各孔的吸光度[12].
1.2.9 酸性磷酸酶活力的检测
收集对数生长期细胞,调整细胞悬液浓度为5×104cell/mL,接种于96孔培养板,每孔100μL,37 ℃、5% CO2培养24 h.加入不同浓度硫酸化枸杞多糖(25、50、100、150、200μg/mL)150μL,并以150μL LPS(1μg/mL)和培养液分别作为阳性对照和空白对照,继续培养24 h后,每孔加入25μL的1% Triton X-100和150μL的磷酸对硝基苯酯(1 mg/mL)继续培养1 h.反应结束后,加入50μL的3 mol/L NaOH进行检测.用酶标仪于405 nm处测各孔的吸光度[13].
1.2.10 细胞因子分泌量的检测
收集对数生长期细胞,调整细胞悬液浓度为5×104cell/mL,接种于96孔培养板,每孔100μL,37 ℃、5% CO2培养24 h.加入不同浓度硫酸化枸杞多糖(25、50、100、150、200 μg/mL)150μL,并以150μL LPS(1μg/mL)和培养液分别作为阳性对照和空白对照,继续培养24 h后,进行检测.采用ELISA法检测细胞因子TNF-α和IL-1β的分泌水平.
1.2.11 细胞因子mRNA表达量的检测
采用qRT-PCR方法检测硫酸化枸杞多糖对RAW 264.7细胞因子基因表达的影响.收集对数生长期细胞,调整细胞悬液浓度为5×104cell/mL,接种于6孔培养板,每孔2 mL,37 ℃、5% CO2培养24 h.加入不同浓度硫酸化枸杞多糖(25、50、100、150、200μg/mL)150μL.硫酸化多糖处理24 h后,加入0.6 mL的Trizol试剂,然后用移液枪反复吹打直至裂解液中无明显沉淀,提取细胞中的总RNA.将提取的总RNA进行纯度鉴定后,进行qRT-PCR分析检测细胞因子TNF-α和IL-1βmRNA的表达水平[14].
qRT-PCR扩增条件为:94 ℃预变性30 s;94 ℃变性5 s,60 ℃退火及延伸34 s,共计40个循环.引物序列如表1所示.
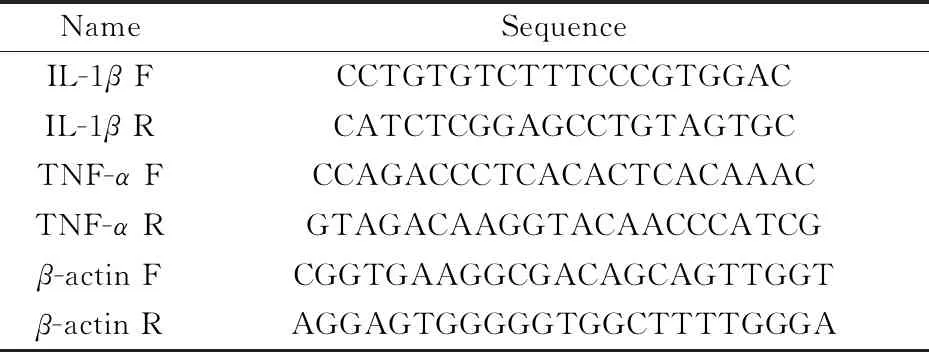
表1引物序列
2 结果与讨论
2.1 枸杞多糖及其硫酸化产物的理化性质分析
2.1.1 总糖含量分析
如表2所示,硫酸化修饰后,枸杞多糖LbGp1和LbGp4的糖含量显著下降,并且随着硫酸化程度的提高,糖含量也随之降低.

表2 枸杞多糖及其硫酸化产物的总糖含量(%)
2.1.2 硫酸基团含量分析
以K2SO4为标准,绘制出标准曲线.横坐标为硫酸基团的质量(mg),纵坐标为其在360 nm处的吸光度值A(A=A1-A2),由此得到的线性回归方程是:y=3.239 3x+0.000 3,R2=0.996 5,由此计算LbGp1-SL、LbGp1-SM和LbGp1-SH以及LbGp4-SL、LbGp4-SM和LbGp4-SH的硫酸基含量(如表3所示).并且,随着硫酸化程度的提高,硫酸基含量也随之增加.

表3 枸杞多糖硫酸化产物的硫酸基含量(%)
2.1.3 相对分子质量分析
如表4所示,硫酸化修饰后,枸杞多糖LbGp1和LbGp4的相对分子质量逐渐增加.并且,随着硫酸化程度的提高,相对分子质量也随之增加.
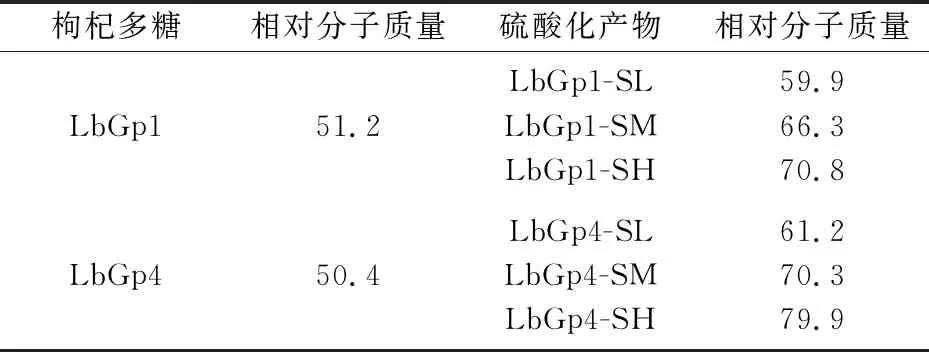
表4 枸杞多糖及其硫酸化产物的相对分子质量(kDa)
2.1.4 FT-IR谱图分析
硫酸化枸杞多糖的红外光谱如图1所示.从光谱中可以看出,相比于枸杞多糖,硫酸化枸杞多糖在3 600~3 200 cm-1位置的吸收降低,推测这是由于多糖经过硫酸化修饰后,硫酸基取代了羟基的位置,因此多糖O-H的伸缩振动峰吸收降低.并且,硫酸化枸杞多糖出现了两个新的特征峰.在1 229 cm-1处有S=O的伸缩振动峰,在808 cm-1处有C-O-S的伸缩振动峰,这说明枸杞多糖LbGp1和LbGp4确实发生了硫酸化.
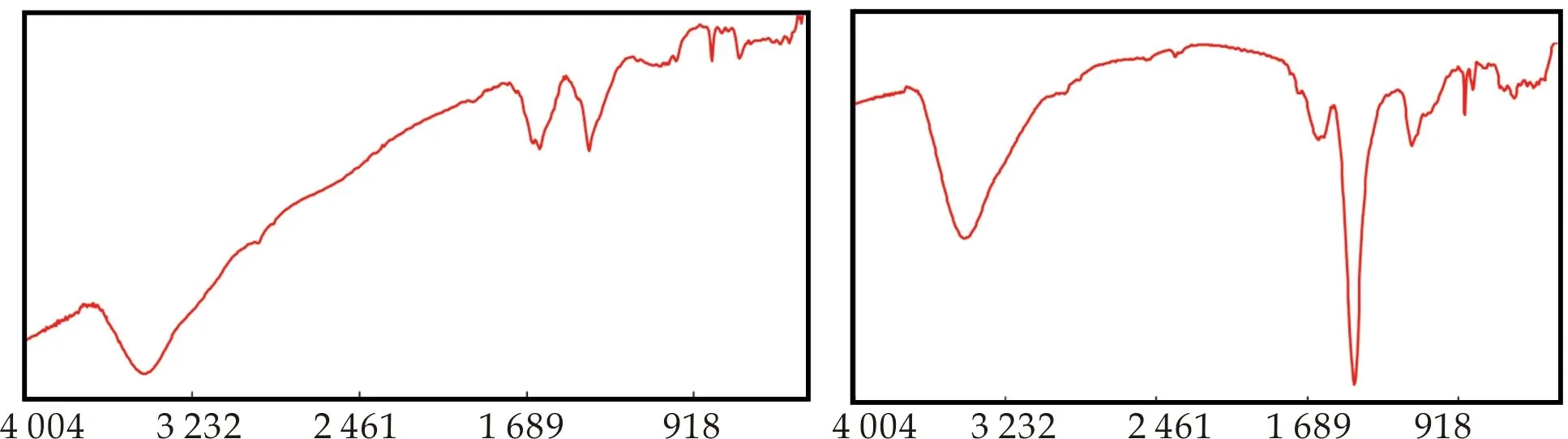
(a)LbGp1-O (b)LbGp1-SL

(c)LbGp1-SM (d)LbGp1-SH
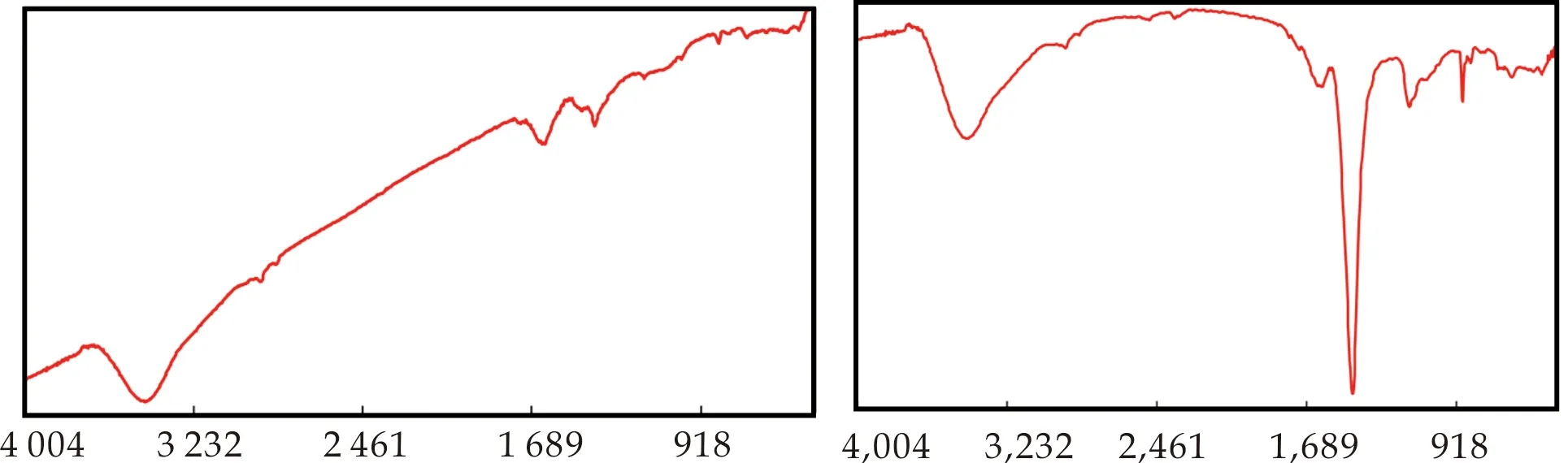
(e)LbGp4-O (f)LbGp4-SL

(g)LbGp4-SM (h)LbGp4-SH图1 枸杞多糖(a、e)和硫酸化枸杞多糖(b、c、d、f、g、h)的FT-IR光谱
2.2 硫酸化枸杞多糖对RAW 264.7细胞活力的影响
如图2所示,不同浓度的枸杞多糖和硫酸化枸杞多糖(25、50、100、150、200μg/mL)均能显著刺激RAW 264.7细胞的增殖.相比于枸杞多糖,硫酸化枸杞多糖的促进作用更加明显,并且硫酸化修饰对LbGp1的免疫增强作用高于LbGp4.

图2 枸杞多糖(A)和硫酸化枸杞多糖(B)对RAW 264.7细胞活力的影响(***p<0.001、**p<0.01和*p<0.05对比于空白组)
2.3 硫酸化枸杞多糖对RAW 264.7细胞吞噬功能的影响
巨噬细胞在体内通过吞噬作用发挥免疫调节功能,静息的巨噬细胞受到免疫调节药物刺激后,其吞噬功能会增强,因此测定巨噬细胞的吞噬功能可以评价药物的免疫活性[15].不同浓度的枸杞多糖和硫酸化枸杞多糖处理细胞24 h后,采用中性红法测定RAW 264.7细胞的吞噬活性,来评价枸杞多糖和硫酸化枸杞多糖对RAW 264.7细胞吞噬功能的影响.如图3所示,不同浓度的枸杞多糖和硫酸化枸杞多糖均可以提高RAW 264.7细胞吞噬中性红的能力,并且随着多糖浓度的增加,RAW 264.7细胞的吞噬能力也随之增加.此外,LbGp1-SH和LbGp4-SH处理后,RAW 264.7细胞的吞噬能力最高,表现为LbGp1-SH >LbGp1-SM >LbGp1-SL >LbGp1;LbGp4-SH >LbGp4-SM >LbGp4-SL >LbGp4.说明硫酸基团含量越高,越有利于增加RAW 264.7细胞的吞噬能力.
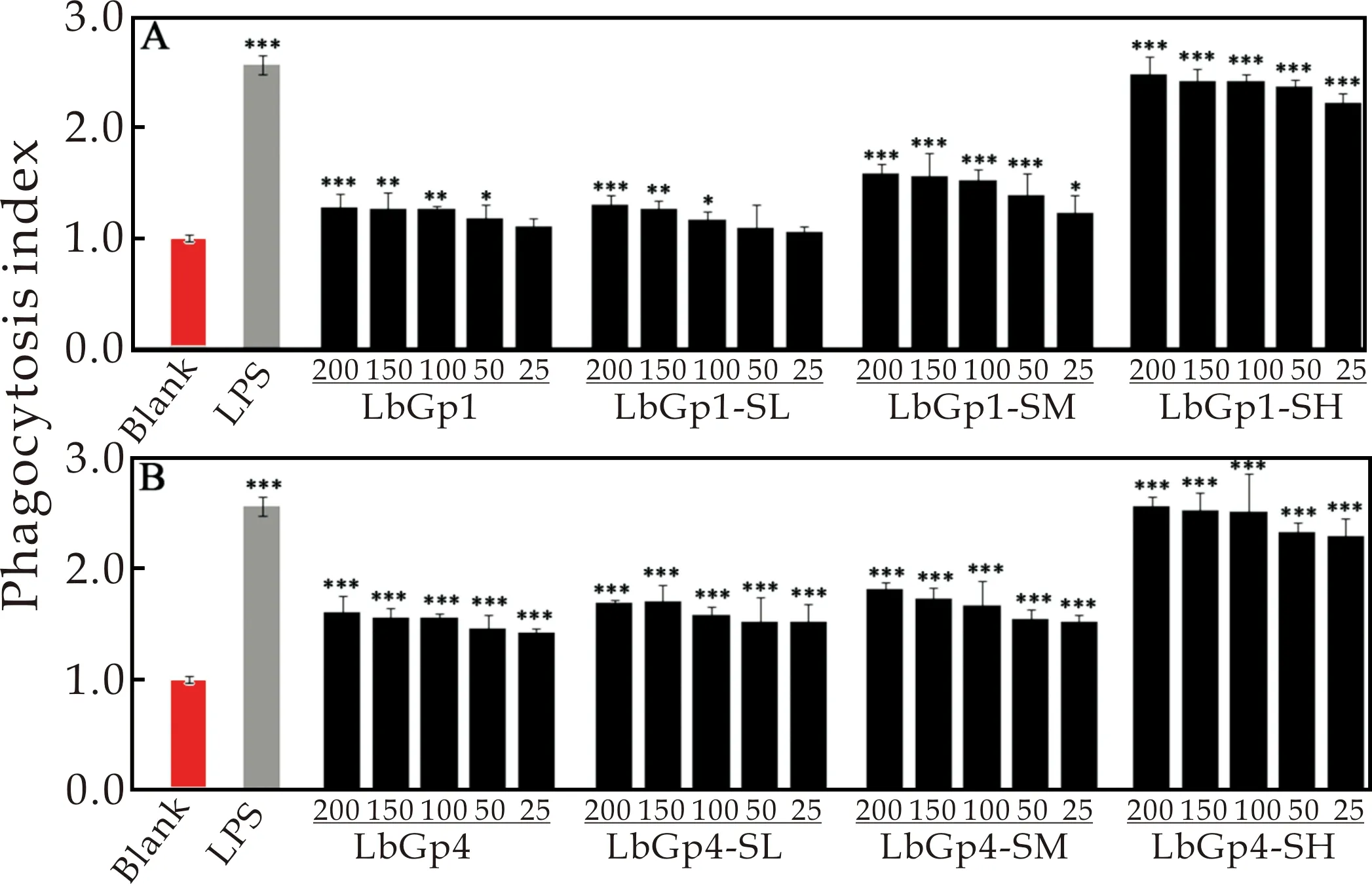
图3 枸杞多糖(A)和硫酸化枸杞多糖(B)对RAW 264.7细胞吞噬功能的影响(***p<0.001、**p<0.01和*p<0.05对比于空白组)
2.4 硫酸化枸杞多糖对RAW 264.7分泌NO的影响
NO是一种重要的生物信号分子,在机体内广泛参与多种生理过程.研究证明,巨噬细胞通过释放NO发挥抗肿瘤、抗病毒、促进淋巴细胞增殖等免疫功能,NO分泌水平成为评价巨噬细胞活化的重要指标.NO在体内极不稳定,细胞分泌后会很快转化为亚硝酸盐.实验中采用Griess法测定细胞培养上清液中亚硝盐的含量反映细胞分泌NO水平.由图4可见,空白组的RAW 264.7细胞分泌少量的 NO,阳性对照LPS可以显著刺激NO产生,细胞经过不同浓度的枸杞多糖和硫酸化枸杞多糖处理24 h后,NO的分泌水平显著提高.并且,硫酸化枸杞多糖处理组的NO分泌水平强于枸杞多糖处理组,其中,LbGp4-SH的促进水平可以LPS的促进作用想媲美.此外,LbGp4及其硫酸化产物处理组的NO分泌水平表现为LbGp4-SH>LbGp4-SM>LbGp4-SL>LbGp4,说明硫酸化修饰更能有效促进枸杞多糖LbGp4刺激细胞内NO的产生,并且硫酸基团含量越高,NO的产生量也随之增加.

图4 枸杞多糖(A)和硫酸化枸杞多糖(B)对RAW 264.7细胞分泌NO的影响(***p<0.001、**p<0.01和*p<0.05对比于空白组)
2.5 硫酸化枸杞多糖对RAW 264.7细胞酸性磷酸酶活力的影响
酸性磷酸酶是巨噬细胞的标志酶,存在于巨噬细胞的溶酶体中,酸性磷酸酶活性的高低反映了巨噬细胞被激活的程度[16].由图5可见,阳性对照LPS可以显著提高酸性磷酸酶的活力;对比LbGp1的各个硫酸化修饰产物,LbGp1-SH由于含有较高的硫酸基团含量,在50~200μg/mL浓度之间均表现出较高的酸性磷酸酶活力;而LbGp4的硫酸化产物LbGp4-SH、LbGp4-SM和LbGp4-SL对RAW 264.7细胞酸性磷酸酶活力的影响更加明显,在各个浓度下,表现出LbGp4-SH>LbGp4-SM>LbGp4-SL>LbGp4,说明硫酸化修饰更能有效维持和促进枸杞多糖LbGp4对胞内酸性磷酸酶活力的激活作用.并且巨噬细胞胞内酸性磷酸酶活力随着硫酸基团含量的增加而提高,因此LbGp4-SH的酸性磷酸酶活力最高.

图5 枸杞多糖(A)和硫酸化枸杞多糖(B)对RAW 264.7细胞酸性磷酸酶活力的影响(***p<0.001、**p<0.01和*p<0.05对比于空白组)
2.6 硫酸化枸杞多糖对RAW 264.7细胞因子分泌的影响
白细胞介素-1β(IL-1β)和肿瘤坏死因子-α(TNF-α)是巨噬细胞分泌的重要细胞因子,参与机体的炎症反应和免疫应答等过程[17].由图6可见,相比于枸杞多糖LbGp1和LbGp4,硫酸化枸杞多糖更能有效促进RAW 264.7细胞中IL-1β和TNF-α的分泌,其作用效果比LPS的刺激作用更加明显,表现为LbGp1-SH>LbGp1-SM>LbGp1-SL>LbGp1;LbGp4-SH>LbGp4-SM>LbGp4-SL>LbGp4,说明硫酸化枸杞多糖更能有效促进细胞因子的分泌,并且硫酸基团含量越高,IL-1β和TNF-α的分泌量也越高.
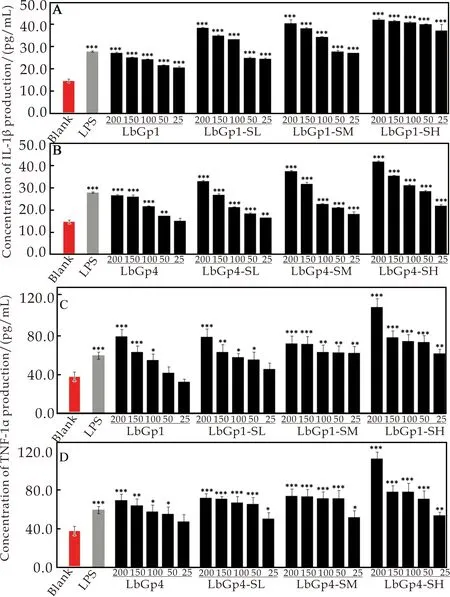
图6 枸杞多糖对RAW 264.7细胞因子IL-1β(A)和TNF-α(C)以及硫酸化枸杞多糖对RAW 264.7细胞因子IL-1β(B)和TNF-α(D)分泌的影响(***p<0.001、**p<0.01和*p<0.05对比于空白组)
2.7 硫酸化枸杞多糖对RAW 264.7细胞因子mRNA表达的影响
通过ELISA方法检测硫酸化枸杞多糖对RAW 264.7细胞因子的影响,发现硫酸化枸杞多糖可促进IL-1β和TNF-α的分泌,进一步采用qRT-PCR 方法对该结果进行验证.结果发现,硫酸化枸杞多糖同样影响细胞因子mRNA水平上的表达.如图7所示,硫酸化枸杞多糖能明显上调IL-1β和TNF-α的基因表达,并且硫酸基团含量越高,IL-1β和TNF-αmRNA表达越高.
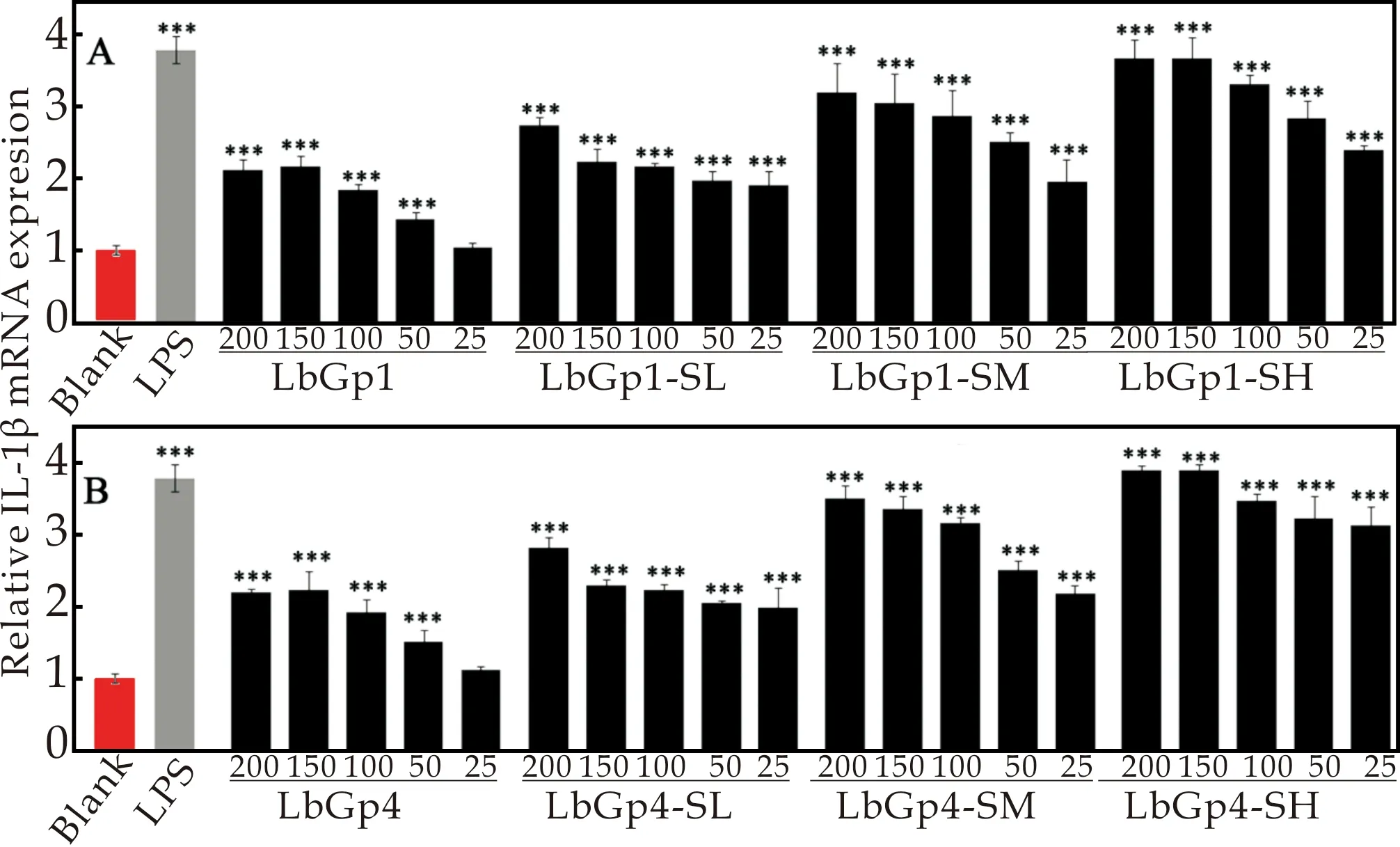

图7 枸杞多糖对RAW 264.7细胞因子IL-1β(A)和TNF-α(C)以及硫酸化枸杞多糖对RAW 264.7细胞因子IL-1β(B)和TNF-α(D)表达的影响(***p<0.001、**p<0.01和*p<0.05对比于空白组)
3 结论
本研究以枸杞多糖LbGp1和LbGp4为对象,对其进行非选择性硫酸化修饰,得到了一系列硫酸化枸杞多糖产物LbGp1-SL、LbGp1-SM和LbGp1-SH以及LbGp4-SL、LbGp4-SM和LbGp4-SH.以巨噬细胞RAW 264.7为靶细胞,从细胞和分子水平分别研究了硫酸化修饰对枸杞多糖免疫调节活性的影响,结果表明,硫酸化修饰能明显增强枸杞多糖的免疫调节活性,并且硫酸化修饰对LbGp4的影响更加显著.研究结果可为进一步阐明硫酸化枸杞多糖免疫增强作用的分子机制提供科学依据,为深入探讨硫酸化多糖的构效关系奠定理论基础.

