质控图联合Westgard多规则法在他克莫司治疗药物监测质量控制及药学服务中的应用
谌介秀,高丽红,骆锦前,张凌鹏,王学彬,王 卓
(海军军医大学长海医院药学部,上海 200433)
他克莫司(tacrolimus,FK506)是一种新型强效免疫抑制剂,广泛用于器官移植术后患者的长期抗排斥治疗[1]。由于他克莫司的治疗窗窄、药动学个体差异大及影响血药浓度波动的因素较多等原因,因此必须对他克莫司进行治疗药物监测(therapeutic drug monitoring,TDM),并根据TDM结果调整给药方案,以提高疗效和减少药品不良反应(ADRs)发生[2]。目前,临床上用于他克莫司TDM的方法有化学发光微粒子免疫分析法(CMIA,雅培Architect i1000全自动化学发光分析仪)、均相酶联免疫分析法(EMIT,Viva-E西门子全自动生化分析仪)、电化学发光免疫分析法(ECLIA,罗氏Cobase411全自动电化学发光免疫分析仪),以及高效液相色谱-串联质谱法(LC-MS/MS)[3-5]。用不同的方法和仪器检测他克莫司的血药浓度,检测结果有一定的差异,同一个患者若在不同检测平台或不同实验室进行TDM,得到的检测结果不一致,可能会给临床医师和患者带来误判的风险[6]。严格的TDM质量控制能够确保检测结果的准确性。质量控制图(以下简称质控图)是一种重要的质量控制统计图形,能准确分析和判断检测过程是否处于在控状态,从而区分正常波动与异常波动。当出现异常波动时,可以比较客观地分析是随机误差还是系统误差所导致。目前,质控图在各种检测项目的质量控制中应用广泛[7]。质控图在TDM中的应用可以确保检测结果的准确性,同时也为临床药师解读不同实验室或不同检测方法的他克莫司TDM结果之间的差异提供重要技术支持,从而减少误判[8-9]。本课题组利用海军军医大学长海医院他克莫司质控样品测定结果,绘制Levey-Jennings和Z分数室内质控图,应用Westgard多规则法进行评价,同时结合他克莫司TDM的具体案例,探讨室内质控图联合Westgard多规则法在他克莫司TDM及相关药学服务实践中的意义。
1 材 料
1.1 仪器 Architect i1000全自动化学发光分析仪(CMIA,美国雅培公司);旋涡混合器、台式离心机(美国赛默飞世尔科技公司);移液枪(刻度范围20~200 μl,德国艾本德公司)。
1.2 试剂 他克莫司试剂盒(100 测试/盒,美国雅培制药有限公司);免疫抑制剂复合质控样品(美国伯乐生命医学产品公司)。
2 方法和结果
2.1 他克莫司血药浓度检测方法 按照他克莫司试剂盒说明书和Architect i1000全自动化学发光分析仪的操作手册,对他克莫司质控样品和临床样本进行预处理并检测。首先,将每份质控样品和临床样本轻轻颠倒5~10次,混匀后立即精确吸取200 μl置离心管中,加入200 μl前处理液,盖上盖子后采用旋涡混合器强力涡旋5~10 s,10 900 r/min(离心半径15 cm)离心5 min,离心结束后将上清液转移至移植处理管中,上机检测。


表1 他克莫司TDM室内质控结果Table 1 The results of interior quality control of tacrolimus TDM
TDM:治疗药物监测;RSD:相对标准差;SD:标准差
2.3Z分数质控图的绘制及评价[10]Levey-Jennings质控图适用于同一水平的质量控制,且该图只能监测精密度,不能判断准确度。鉴于本研究采用低、中、高3种不同浓度的质控样品(靶值分别为4.56、9.49、14.30 ng/ml),因此评价时需将不同浓度的质控样品测定值转换成Z分数形式,绘制在一张质控图上进行比较。Z分数也叫标准分数,计算公式为Z=(x-μ)/σ。其中,x为某一实际检测值的具体分数,μ为平均数,σ为标准差。他克莫司TDM的Z分数质控图见图2。


图1 他克莫司TDM的Levey-Jennings质控图Figure 1 Levey-Jennings quality control chart of tacrolimus TDMA:低浓度(4.56 ng/ml);B:中浓度(9.49 ng/ml);C:高浓度(14.30 ng/ml);TDM:治疗药物监测

图2 他克莫司TDM的Z分数质控图Figure 2 Z score quality control chart of tacrolimus TDM○:低浓度(4.56 ng/ml);●:中浓度(9.49 ng/ml);△:高浓度(14.30 ng/ml);TDM:治疗药物监测

2.5 TDM药学服务案例 患者,女性,31岁,2018-03-22在本院行肾移植术,术后长期服用他克莫司胶囊+麦考酚钠肠溶片(商品名 米芙)+强的松三联免疫抑制方案抗排斥治疗,定期至本院门诊随访。随访当日早晨7:00~8:00(服药前0.5 h)在当地医院门诊检验科采集外周静脉血1 ml,置于乙二胺四乙酸二钾(EDTA-K2)抗凝管中,将采集所得血样寄送至本院药学部TDM室进行他克莫司血药浓度监测。患者在2018年6月和7月有4次用同一时间采集的两份标本分别在本院和当地医院同时进行他克莫司血药浓度监测,患者自行比对两份TDM结果后,对两家医院测定的他克莫司血药浓度差异较大提出质疑。同时,随访医师也怀疑本院他克莫司TDM的检测仪器和方法不可靠。该患者2018年6-7月的具体用药方案见表2。
2.6 临床药师对TDM结果的解读
2.6.1 他克莫司TDM结果准确性的判定临床
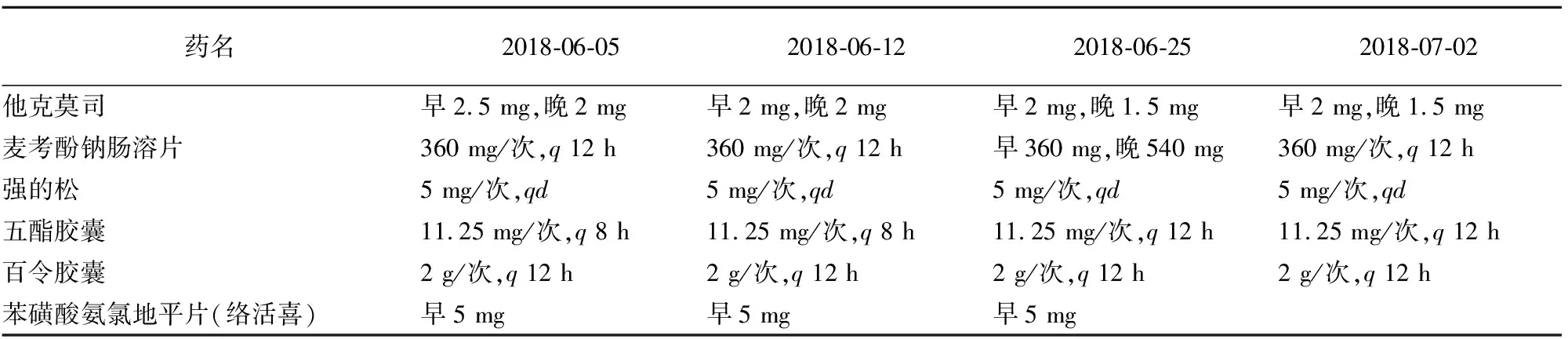
表2 患者2018年6-7月的用药情况Table 2 The medication regimen of the patient from June to July in 2018
药师查阅该患者2018-06-05至2018-07-02在本院的他克莫司TDM结果(见图3),发现患者的血药浓度适用于本院他克莫司高、中浓度质控范围。由图1可见,本院他克莫司高浓度质控样品在此期间质控良好,未有失控情况;中浓度质控尽管提示一次警告,但仍在失控线内,说明本院所发TDM报告无误,提供的他克莫司血药浓度测定结果准确、可靠。

图3 本院与当地医院的他克莫司TDM结果比较Figure 3 Comparison of tacrolimus TDM results between this hospital and the local hospital○:本院;●:当地医院;TDM:治疗药物监测
2.6.2 他克莫司血药浓度变化原因分析 临床药师查阅患者2018-06-05至2018-07-02的服药情况(见表2),发现患者在此期间的给药方案在不断调整,2018-06-12他克莫司减量0.5 mg,2018-06-25他克莫司又减量0.5 mg,五酯胶囊减量11.25 mg(1粒),导致他克莫司血药浓度逐渐下降并趋于平稳(见图3)。吴雪等[12]研究发现,五酯胶囊服用剂量增加1倍后,他克莫司血药浓度增加的幅度平均为87.28%,增加幅度存在个体差异,且增加幅度与五酯胶囊的给药剂量呈正相关。傅尚希等[13]研究发现,肾移植术后6个月以上的患者服用五酯胶囊1周后,他克莫司血药浓度增加56.91%,停药1周后,他克莫司血药浓度降低35.36%。因此,根据该患者他克莫司及五酯胶囊的用药方案调整情况,临床药师认为,该患者他克莫司血药浓度的降低幅度与文献报道基本一致,能够满足临床治疗的需要。
3 讨 论
Levey-Jennings质控图联合Z分数质控图,运用Westgard多规则法进行室内质量控制评估,对免疫抑制剂的TDM质量控制至关重要[8-11]。本研究通过绘制室内质控图发现,2018年6-8月他克莫司低浓度和高浓度的质控良好,中浓度存在系统误差,但未失控。这可能是由于中浓度质控样品的挥发、沉淀析出、吸水及变质等原因造成,可通过更换中浓度质控样品的方法解决[14]。本研究结果表明,质控图在TDM室内质控中可及时发现曲线漂移、连续6点以上分布于靶值线同侧等非随机误差现象,与单纯的每批样本跟随质控的“即刻法”相比,能更合理、有效地进行质量控制[8]。
此外,目前鲜有将质控图应用于TDM个体化药学服务的案例报道。本研究将质控图应用于1例特殊案例的他克莫司TDM结果分析,试图发现造成两家医院测定同一样本血药浓度结果不一致的原因。临床药师进一步了解后发现,本院和当地医院检测他克莫司血药浓度的方法分别是化学发光微粒子免疫分析法和电化学发光免疫分析法。欧洲的一项多中心研究用这两种方法同时测定肾移植患者的他克莫司血药浓度,并进行线性回归分析,得到回归方程的斜率为1.01(95%Cl:0.98~1.04)(r=0.97);用Bland-Altman法对两种方法测定的他克莫司血药浓度进行一致性评价,发现偏差为-4.7%(±1.96SD:-31.4%~22.1%),表明两种分析方法的相关性良好[15]。但随着他克莫司血药浓度增加,两种方法的测定结果离散度增大。这项研究说明对于较高浓度的他克莫司样本,这两种方法的测定结果之间可能存在一定的差异。因此,临床药师认为,该患者在两家医院对同一样本所测他克莫司血药浓度之间的差异可能是方法学差异导致,但两种方法测定结果有差异的具体原因尚需进一步探究。
总之,他克莫司TDM平台应强化质量控制意识,充分应用质控图及其评价方法,提高TDM相关药学服务的质量。此外,长期随访的器官移植患者应尽可能在同一家医院进行他克莫司TDM,减少由于不同检测仪器和不同检测方法导致的结果差异,规避误调他克莫司给药方案可能带来的排斥反应或药品不良反应风险。建立科学有效的TDM质量控制及评价方法,有助于控制并减少测定误差,为临床药师进行TDM结果解读提供技术保障,从而提高临床医师和患者对TDM结果的信任度。

