复方硝酸咪康唑软膏微生物限度检查的方法学验证
倪玉佳,朱文静,戈 煜,汤 露,董文燊,瞿发林*
(1.联勤保障部队第九〇四医院医学工程科,江苏常州 213000;2.南京中医药大学翰林学院,江苏淮安 223001)
复方硝酸咪康唑软膏(曾用名:菌克软膏)为联勤保障部队第九〇四医院(原解放军第一〇二医院)的非标准制剂,其主要成分为盐酸林可霉素、硝酸咪康唑和醋酸地塞米松,具有较强的抑菌性[1]。其基质较为复杂,包括白凡士林、单双硬脂酸甘油酯、硬脂酸、液体石蜡等。作者查阅文献发现,基质复杂并有强抑菌性的软膏采用平皿法做微生物限度检查,试验菌易回收失败,而采用薄膜过滤法又存在过滤效率低甚至堵膜的问题。针对此软膏的理化特性,本研究采用研磨[2-3]、萃取[4]和静置[5]相结合的方法,对供试品做适当前处理,解决了采用薄膜过滤法过滤效率差及堵膜的难题,建立了适合复方硝酸咪康唑软膏的微生物限度检查方法。
1 材 料
1.1 仪器 EL-300J电子天平(常州天之平仪器设备公司);SM-CJ-1FD净化工作台(苏净集团苏州安泰空气技术有限公司);ZHS-150SC恒温恒湿培养箱、ZMJ-150-Ⅱ霉菌培养箱(上海喆图科学仪器公司);HHS电热恒温水浴锅(上海医疗器械五厂);LDZX-30KBS立式压力蒸汽灭菌锅(上海申安医疗器械厂)。
1.2 培养基 胰酪大豆胨液体培养基(TSB,批号160802)、胰酪大豆胨琼脂培养基(TSA,批号1609262)、沙氏葡萄糖液体培养基(SDB,批号151113)、沙氏葡萄糖琼脂培养基(SDA,批号161017)、溴化十六烷基三甲胺琼脂培养基(批号160309)、甘露醇氯化钠琼脂培养基(批号160226)、pH 7.0无菌氯化钠-蛋白胨缓冲液(批号160408),上述培养基均由北京三药科技开发公司生产。
1.3 试剂 十四烷酸异丙酯(批号20170807)和聚山梨酯80(批号20170925)由国药集团化学试剂有限公司提供;N,N-二甲基对苯二胺盐酸盐(天津市化学试剂研究所有限公司,批号20170901)。
1.4 验证用菌株 白念珠菌[编号CMCC(B)98001,批号98001-2a15-3]、铜绿假单胞菌[编号CMCC(B)10104,批号10104-2a20-3]、黑曲霉[编号CMCC(F)98003,批号0A1001]、金黄色葡萄球菌[编号CMCC(B)26003,批号26003-5a28-5]、枯草芽孢杆菌[编号CMCC(B)63501,批号63501-2a22-1],由中国食品药品检定研究院提供。
1.5 样品 复方硝酸咪康唑软膏(规格:20 g/支,批号20180118、20180323、20180426)。由本院自制。
1.6 其他 Nylon6滤膜(直径47 mm,孔径0.45 μm),由天津市津腾实验设备有限公司提供。
2 方法和结果
2.1 供试液的制备 取50 g软膏,加入50 ml十四烷酸异丙酯,研磨5 min后加入少量含10%聚山梨酯80的pH 7.0无菌氯化钠-蛋白胨缓冲液,继续研磨5 min,加入500 ml已预热至44 ℃的含10%聚山梨酯80的pH 7.0无菌氯化钠-蛋白胨缓冲液,在44 ℃水浴中保温静置40 min,制成1∶10的溶液,取水层作为供试液。
2.2 菌液的制备 取1.4项的验证用菌株,按《中华人民共和国药典》2015年版第四部的要求,以pH 7.0无菌氯化钠-蛋白胨缓冲液将菌新鲜培养物稀释,制成适宜的菌悬液。
2.3 需氧菌、霉菌及酵母菌总数计数方法验证
2.3.1 实验组 取2.1项的供试液50 ml,分别加入各实验菌菌悬液0.5 ml(使菌终浓度≤100 cfu/ml),混匀后取1 ml过膜,以500 ml含1%聚山梨酯80的pH 7.0无菌氯化钠-蛋白胨缓冲液分5次冲洗,冲洗结束后把膜贴于对应琼脂培养基中培养。
2.3.2 供试品对照组 取2.1项的供试液,用稀释液替代菌液,其余操作与实验组相同。
2.3.3 菌液对照组 用不含稀释剂的稀释液替代供试液,其余操作与实验组相同。
2.3.4 稀释剂对照组 取相应量的稀释液替代供试液,其余操作与实验组相同。
2.3.5 回收率计算 实验组菌落数回收率=(实验组平均菌落数-供试品对照组平均菌落数)/菌液对照组平均菌落数×100%。稀释剂对照组菌落数回收率=(稀释剂对照组菌落数均值/菌液对照组菌落数均值×100%。计算各实验菌的回收率,结果若在0.5~2之间,则确定该方法可行。验证结果见表1。
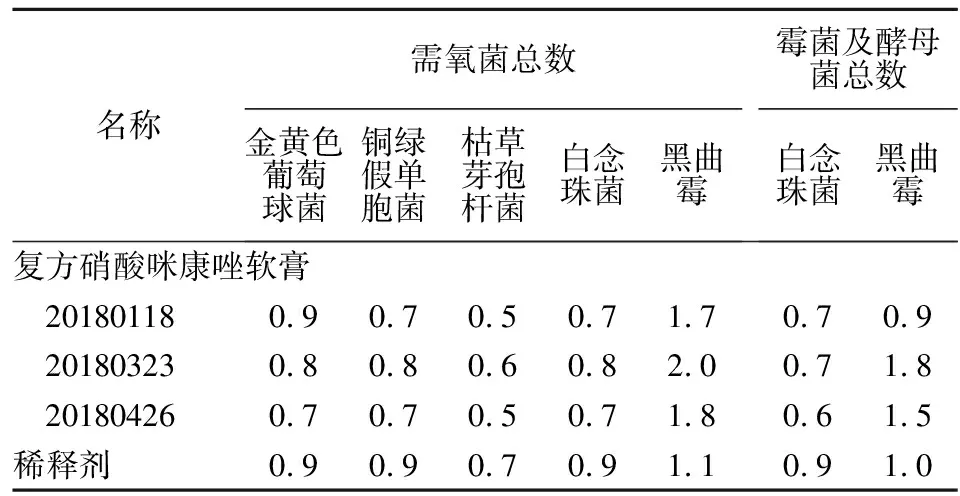
表1 菌落数回收率测定Table 1 Results of recovery rates of colony count
2.4 控制菌的检查
2.4.1 试验组 (1)铜绿假单胞菌:取2.1项下1∶10的供试液10 ml和1 ml铜绿假单胞菌(不超过100 cfu),加入100 ml的胰酪大豆胨液体培养基中,混匀,33 ℃培养18 h。将上述培养物以划线法接种在溴化十六烷基三甲胺琼脂培养基上,33 ℃培养18 h,取菌落进行氧化酶实验。(2)金黄色葡萄球菌:①培养基稀释法。分别取2.1项下1∶10的供试液10 ml和1 ml金黄色葡萄球菌(不超过100 cfu),加入200、500、800、1000 ml胰酪大豆胨液体培养基中,混匀,33 ℃培养18 h。将所得培养物以划线法接种于甘露醇氯化钠琼脂培养基上,33 ℃培养18 h,观察菌落的颜色和形态。②薄膜过滤法。取2.1项下1∶10的供试液10 ml,用含1%吐温80的pH 7.0无菌氯化钠-蛋白胨缓冲液冲洗(500 ml/膜,100 ml/次),在最后一次冲洗液中加入1 ml金黄色葡萄球菌(不超过100 cfu),冲洗结束后,将滤膜加入100 ml的胰酪大豆胨液体培养基中,混匀,33 ℃培养18 h。将所得培养物按划线法接种于甘露醇氯化钠琼脂培养基上,33 ℃培养18 h,观察菌落的颜色和形态。③培养基稀释法结合薄膜过滤法。取2.1项下1∶10的供试液10 ml,用含1%吐温80的pH 7.0无菌氯化钠-蛋白胨缓冲液冲洗(500 ml/膜,100 ml/次),在最后一次冲洗液中加入1 ml金黄色葡萄球菌(不超过100 cfu),冲洗结束后,将滤膜加入200 ml胰酪大豆胨液体培养基中,混匀,33 ℃培养18 h。将所得培养物按划线法接种于甘露醇氯化钠琼脂培养基上,33 ℃培养18 h,观察菌落的颜色和形态。
2.4.2 供试品组 除不加入相应控制菌,其余操作与实验组相同。
2.4.3 阳性组 除不加入供试液,其余操作与实验组相同。
2.4.4 阴性组 除不加入相应控制菌和供试液,其余操作与实验组相同。
2.4.5 控制菌检查方法的验证 因复方硝酸咪康唑软膏为外用皮肤制剂,故需对铜绿假单胞菌及金黄色葡萄球菌进行控制菌验证实验。验证要求实验组均可检出,供试品和阴性对照组未检出。药典规定外用皮肤制剂需氧菌总数不超过100 cfu/g;霉菌、酵母菌总数不超过10 cfu/g;且样品中不得检出金黄色葡萄球菌或铜绿假单胞菌。铜绿假单胞菌验证采用常规法,金黄色葡萄球菌验证采用常规法及培养基稀释法均失败,后选择培养基稀释法结合薄膜过滤法验证成功,结果见表2和表3。

表2 铜绿假单胞菌控制菌验证结果Table 2 Verification results of control bacteria of Pseudomonas aeruginosa
2.5 样品检验结果 取3个批号的样品,按上述微生物计数及控制菌检查方法检验,结果见表4。由表4可见,3个批号的复方硝酸咪康唑软膏检验结果均符合规定。
3 讨 论
复方硝酸咪康唑软膏含3种主要成分,分别是盐酸林可霉素、硝酸咪康唑和醋酸地塞米松。盐酸林可霉素是抗生素,硝酸咪康唑为广谱抗真菌药,两药均有较强的抑菌性[1],若采用常规法进行微生物检测,会造成漏检的情况,不能确定样品是否存在污染,从而带来用药安全隐患[6-7]。故需寻求适宜的中和剂或通过薄膜过滤法去除软膏抑菌成分后,再进行微生物限度检测,所得到的结果才是科学、准确的。
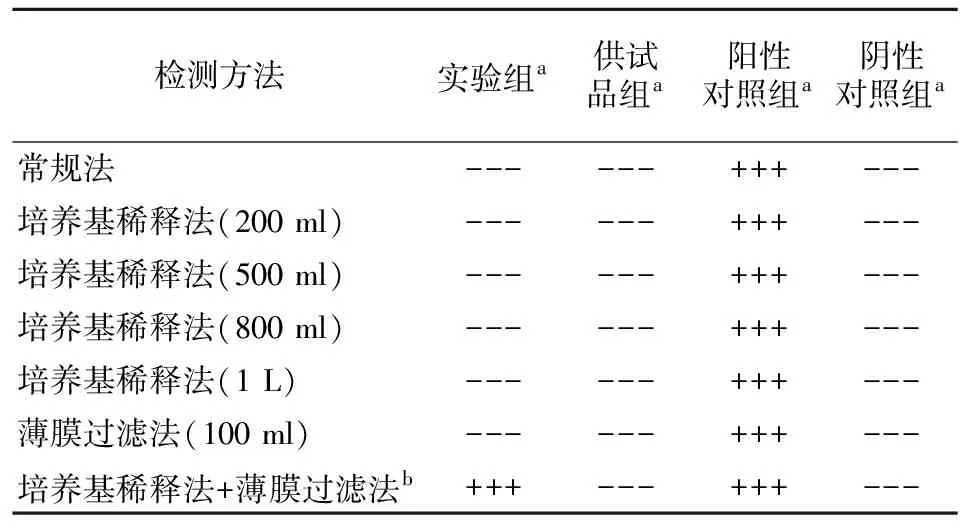
表3 金黄色葡萄球菌控制菌验证结果Table 3 Verification results of control bacteria of Staphylococcus aureus
+:检出;-:未检出;a:使用3个批号的样品;b:培养基稀释法(200 ml)结合薄膜过滤法(500 ml/膜,100 ml/次)

表4 样品检验结果Table 4 Sample testing results (cfu/g)
-:未检出
3.1 乳化剂的比较 软膏是黏稠的半固体制剂,与菌接触后不易分散均匀,故须制成适宜的供试液后才能进行微生物限度检测。本研究根据文献方法,首先尝试以十四烷酸异丙酯[5]以及含1%聚山梨酯80的pH 7.0无菌氯化钠-蛋白胨缓冲液[3]这两种单一乳化剂结合研磨法处理供试品,但得到的供试液分散极不均匀,能明显看到较大颗粒,且有部分软膏仍然黏在研杵上,造成浪费与污染,影响后续试验。继而尝试用司盘、聚山梨酯80、单硬脂酸甘油酯[8]与司盘、聚山梨酯80[9]混合乳化剂处理供试品,44 ℃水浴加热能完全乳化,但由于软膏本身抑菌性太强,平皿法的回收率无法满足要求。当采用薄膜过滤法时,由于供试品中颗粒孔径较大,当供试液稀释级达到1∶100时才能顺利过膜,且不适用于霉菌、酵母菌总数计数和控制菌的检查。
3.2 聚山梨酯80浓度的选择 为进一步降低生产压力、优化实验流程,实验中对供试品的处理采用研磨与萃取相结合的方法,软膏与十四烷酸异丙酯混合研磨后加入少量乳化剂继续研磨,最终与稀释剂混合,静置,取下清液进行实验。当聚山梨酯80浓度过低时,金黄色葡萄球菌控制菌检测实验中,下层萃取液过膜情况极不理想,严重堵膜,若想得到理想的萃取液则需要大幅度延长萃取时间,给以后的日常检验带来极大不便。另一方面,升高聚山梨酯80浓度,供试液萃取得更完全,但逐渐出现了枯草芽孢杆菌的抑制现象。实验最终确定的乳化剂为含10%聚山梨酯80的pH 7.0无菌氯化钠-蛋白胨缓冲液,能同时满足微生物计数回收率和控制菌检查要求。
3.3 控制菌检查方法优化 由于软膏抑制作用极强,单纯地采用培养基稀释法[7]或薄膜过滤法仍然无法去除抑菌性,因此本研究采用培养基稀释法结合薄膜过滤法用于金黄色葡萄球菌控制菌检查,减少了冲洗量,缩短了实验时间,经过5次冲洗(500 ml/膜,100 ml/次),之后置于200 ml胰酪大豆胨液体培养基中培养,可检出该实验菌。
综上所述,对复方硝酸咪康唑软膏中的需氧菌、霉菌和酵母菌总数可采用薄膜过滤法进行计数实验;控制菌部分,铜绿假单胞菌可采用常规法进行测定,金黄色葡萄球菌可采用培养基稀释法结合薄膜过滤法进行测定。本研究最终确立的验证方法及实验中对供试品的处理方式为其他抑菌性较强的软膏的微生物限度检查提供了参考。

