自动检测程序与人工检测对肺结节 检测的效能对比分析
侯秋雨 张晨策 李辉坚 刘方波 袁娜

摘要: 针对肺结节自动检测程序与人工检测存在的差异,本文对比分析了自动检测程序与人工检测对肺结节检测的效能。收集了青岛市第八人民医院2019年2月~10月胸部CT平扫602例,并以2名从事影像诊断专业20年以上的副主任医师共同阅片检出的肺结节数目和大小为参考标准,比较A组(1名副主任医师、1名主治医师) 和B组(肺结节自动检测程序)对肺结节的检出率、平均阅片时间和假阳性率。研究结果表明,B组检出率高于A组,差异有统计学意义(P<0.05),A组假阳性率高于B组,差异有统计学意义(P<0.05);在不同大小结节检测方面,A、B组在小于3 mm的结节检出率差异有统计学意义(P<0.05),大于等于3 mm结节检出率差异无统计学意义(P>0.05)。A、B组阅片时间分别为(5.0±1.1) min和(1.3±0.2) min,差异有统计学意义(P<0.05)。肺结节自动检测程序对肺结节的检测效率高于人工检测,可作为肺结节筛查的有效辅助工具。
关键词: 肺结节; 自动检测; 程序; 胸部CT
中图分类号: R445.3; R734.2 文献标识码: A
肺结节是指肺内的类圆形病灶,密度增高、直径小于等于3 cm,病变周围被含气肺组织包围,并且不伴有肺不张、纵隔及肺门淋巴结肿大、胸腔积液等表现。通常情况下,肺结节有可能是肺癌的早期表现,作为临床影像科常见的偶然发现,根据其影像特征来评估其恶变的可能性,早期发现及评估肺结节对于诊断和治疗肺癌十分重要。手术切除或活检应对首次发现与随访影像对比有增长的肺结节患者进行,稳定至少两年的实性肺结节一般不需要做进一步随访。具有直径大于等于8 mm的实质肺结节、直径小于8mm的非实质或部分实质肺结节的患者应参照恶性的概率、影像学结果以及不同治疗方案的风险和收益等原则进行后续处理与评估[1] 。目前,对于偶然发现的对肺结节的处理,国际上有许多专业组织或研究机构给出了一些推荐的处理方案,这些组织或机构包括国际肺癌研究协会(international association for the study of lung cancer,IASLC)、弗莱舍学会(the fleischner society,TFS)和欧洲呼吸学会(european respiratory society,ERS)等,也有一些研究或报告可供参考[2 5] 。目前,胸部高分辨率CT在早期肺癌筛查中应用广泛,导致了大量肺结节的检出,从而医生的阅片工作量剧增,肺结节的准确检测对于临床医生具有较大的挑战[6] ,因此,高效准确的肺结节检测系统非常必要[7] 。本文对一种基于三维联通域的肺结节检测系统[8] 与临床医师对肺结节检测能力进行对比分析,结果表明肺结节自动检测程序对肺结节的检测效率高于人工检测。该研究为探讨其临床应用具有重要意义。
1 材料与方法
1.1 材料
随机抽取青岛市第八人民医院2019年2月~10月602例患者的胸部CT平扫图像作为研究对象,其中男性366例,女性236例,年龄为16~80岁,平均(41±0.8)岁。所有患者均采用GE16排螺旋CT(Lightspeed16)行胸部平扫,扫描条件为管电压120 kV,管电流80 mA。扫描范围从肺尖至肺底全部区域,两侧包括胸壁和腋窝,层厚5 mm,平扫后按肺部标准算法重建,层厚1 mm,观察采用窗宽1 500 Hu,窗位-600 Hu。要求肺结节个数1~10个,直径小于30 mm。
1.2 方法
1.2.1 人工检测方法
由2名从事影像诊断专业20年以上的副主任医师共同阅片,分析结节的数目及大小。当判读结果不一致时,由第3名副主任医师参与协商,确定一致性意见,从而作为参考标准,以此计算肺结节的检出率和假阳性率。根据《胸部CT肺结节数据标注与质量控制专家共识(2018)》的分类标准,结节分为小于3 mm为微结节,3~5 mm为微小结节,6~10 mm为小结节,11~30 mm为结节。因为小于3 mm的微结节通常没有临床意义,所以本文按结节大小分为小于3 mm与大于等于3 mm 两类进行分析。在确定参考标准后,由1名副主任医师和1名主治医师分别阅片,内容是结节检出的数目、大小,并与参照标准对照,分别计算肺结节的检出率和假阳性率,阅片时间指医师在显示屏逐层观察图像,得出每例患者结节数目和结节大小的时间。
1.2.2 自动检测方法
1) CT切片影像的像素值单位转换。由于从不同品牌不同型号的CT设备上获取的影像技术参数不同,所以CT影像的数据格式也不同。为统一计算,需根据不同的技术参数,将像素的灰度值转换成统一单位,即亨氏单位。
像素灰度值的亨氏单位可由元数据参数计算得到,其文件为DICOM格式,计算公式为
HU=PV×RS+RI
式中,HU表示CT像素的灰度值;PV表示CT的像素值;RS表示CT的重缩放斜率;RI表示重缩放截距。式中的PV是CT影像对应层面中相应的一个点的像素灰度值,常规CT影像层面切片的分辨率为512×512(行×列),该参数分别存放在DICOM格式文件的标签行数(0028,0010)和列数(0028,0011)中,RS是DICOM文件标签(0028,1053)的数值,RI是标签(0028,1052)中的数值。当RT(0028,1054)标签为空时,该影像像素值单位就是亨氏单位。
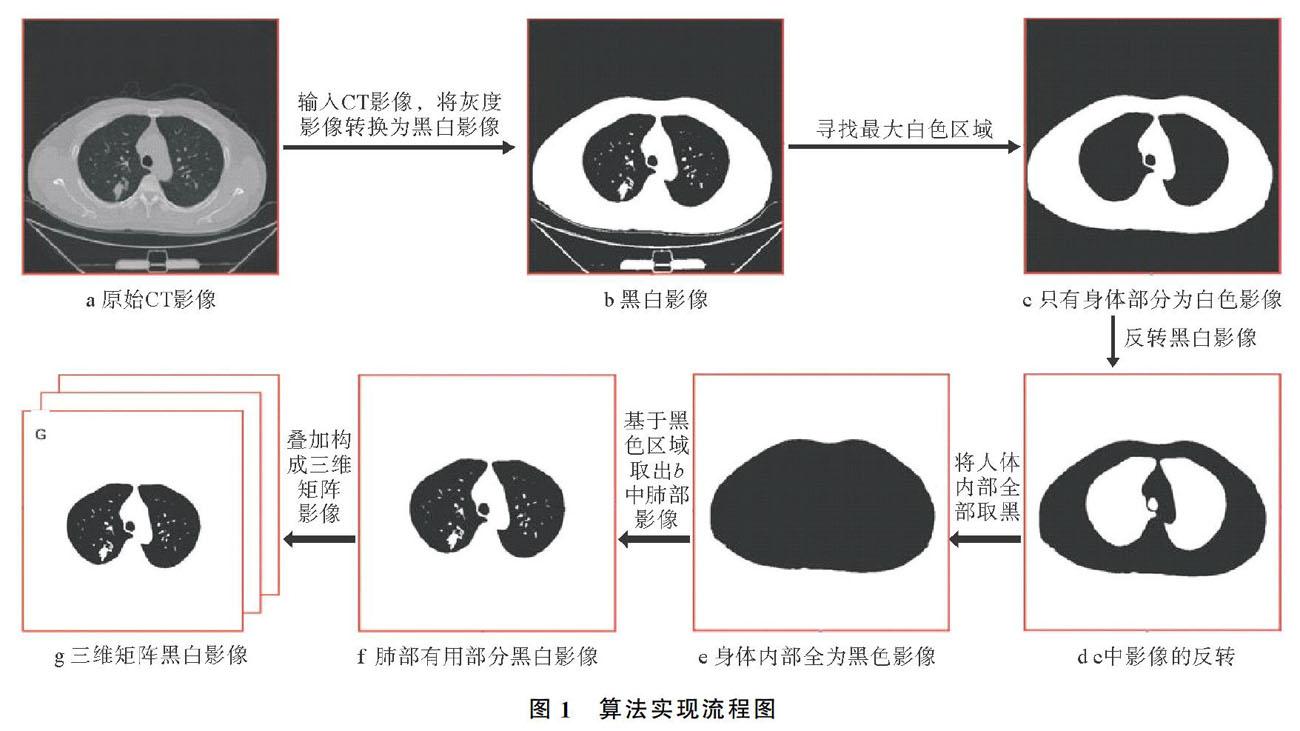
2) CT切片灰度影像转换为黑白影像。当影像的像素值转换为亨氏单位(HU)后,设置一个像素阈值,对于大于或等于该阈值的像素值,将其设置为1(白色),小于该阈值,則设置为0(黑色)。采用此方法可以将如图1a所示的灰度CT影像转换成图1b所示的黑白CT影像。算法实现流程图如图1所示。
3) CT切片影像中無用影像的去除。为了利用三维连通域的概念实现算法,最重要的步骤是除去每一个层面切片影像中人体以外的影像。
首先利用最大面积算法,选择图1b中最大白色身体轮廓区域,然后将其他区域均设置为黑色,从而得到图1c的影像,而无用影像及有用影像均被删除。为了使身体轮廓以内的有用影像得到显示,对图1c再次使用最大面积算法选择身体轮廓区域,即白色区域,此次对图1c进行反向操作,将原来的白色区域变为黑色,原来黑色的区域变为白色,获得的影像如图1d所示。对图1d使用最大面积算法,选择身体轮廓以外的区域(白色),并将其他的所有区域均置为黑色,得到的影像如图1e所示。最后,基于图1e的黑色区域,将图1b身体轮廓以外的区域设置为白色,得到所需要的影像如图1f所示。
4) 叠加CT切片影像构成三维矩阵影像。将所获得的一系列黑白CT层面切片影像叠加,构成三维矩阵影像(如图1g),矩阵中每个点的像素值均为1(白色)或0(黑色),由1相连的区域即为三维连通域。
5) 过滤小于连通域阈值的三维连通域。设置一个阈值,该阈值即为三维连通域的大小,过滤掉小于阈值的三维连通域。这是由于在CT影像的处理过程中,可能会产生一些小的碎片或存在影像噪声,导致一些非常小的连通域产生,再就是小于3 mm的肺结节临床上通常没有意义。
6) 计数三维连通域及计算其直径。通过计算三维连通域的数量,即可得到肺结节的个数,计算三维连通域的大小,即是肺结节的直径大小。肺部组织与身体轮廓构成一个大的三维连通域,应该排除在外。按照以上描述方法,该算法得到了较好的实现。
1.2.3 观察指标
人工与自动两组结节检出的数目和大小与参考标准对比,分别计算每组肺结节的检出率和假阳性率,以及2组平均阅片时间。检出率和假阳性率分别为
DR=TPN/TN×100%,
FPR=FPN/TN×100%
式中,DR为检出率;FPR为假阳性率;TPN为真阳性结节;FPN为假阳性结节;TN为结节总数。
1.3 统计学方法
采用SPSS 20.0统计软件进行数据分析,计数资料以百分率表示,进行χ2检验,以P<0.05为差异,有统计学意义。
2 研究结果
2.1 参考标准
2名副主任医师共检出3250个结节,每例患者肺结节数为1~10个,平均(5±1.6)个,结节直径为2~29 mm。
2.2 两组结节检出情况比较
比较结果发现,b组检出率高于A组,差异有统计学意义(P<0.05),A组假阳性率高于B组,差异有统计学意义(P<0.05)。在不同大小结节检测方面,A和B组在小于3 mm的结节检出率差异有统计学意义(P<0.05),大于等于3 mm结节检出率差异无统计学意义(P>0.05)。
2.3 阅片时间
A和B组阅片时间分别为(5.0±1.1) min和(1.3±0.2) min,差异有统计学意义(P<0.05)。A和B组检出率及阅片时间比较如表1所示。
3 讨论与分析
研究结果表明,肺结节自动检测系统对肺结节的检出率高于人工检测,假阳性率低于人工检测,平均阅片时间远低于人工检测。本研究所用的检测方法与近年来逐步进入临床应用的基于传统计算机视觉算法计算机辅助诊断系统(computer-aided detection,CAD)和基于深度学习(deep learning,DL)的人工智能(artificial intelligence,AI)[9 10] 有所不同,CAD系统通常需要自动预分割肺部影像算法[11] ,程序较复杂且误差较大[12] ,AI是一种基于卷积神经网络的肺结节检测模型,DL是通过构建深层网络结构进行多层特征学习的人工智能方法[13] 。近年来,随着DL和AI技术的不断发展,图像识别技术有了更好的发展,并已开始应用于临床领域,特别是胸部影像识别[14 15] ,与传统CAD相比,AI识别技术在检出率、假阳性率等方面都更优秀,其敏感度和特异度较传统的CAD高。
本研究所采用的是基于三维连通域的一种算法,该算法采用灰度阈值法(基于亨氏单位HU),经过对肺部CT影像黑白转换预处理,以三维连通域的概念,在CT影像中将人体与肺器官(气管和血管等)等看作一个整体的实体,而孤立的肺结节不与这个整体相连,从而实现了在CT影像中基于三维连通域检测孤立性肺结节的算法。在AI与人工检测肺结节的效能对比研究中,AI的检出率可达96.6%[9] 。本研究自动检测技术的肺结节检出率为96.3%,两者的检测能力近似,但在另一个AI与人工检测肺结节的效能对比研究中[16] ,AI的假阳性率高于人工检测,本研究自动检测技术的假阳性率为6%,AI高假阳性率的原因表明,目前AI技术深度学习的重点集中在阳性结节上,而非假阳性结节。本研究自动检测技术假阳性率低的原因和算法的原理有关,这是由于基于三维连通域的肺结节检测算法目前无法识别胸膜下结节(与胸膜相连)。
4 结束语
本研究是基于三维连通域的一种算法,该算法采用灰度阈值法,以三维连通域的概念为基础,在CT影像中将人体与肺器官(气管和血管等)等看作一个整体的实体,孤立的肺结节不与这个整体相连,从而实现了在CT影像中基于三维连通域检测孤立性肺结节的算法。与人工检测相比,该研究在检出率、假阳性率和平均阅片时间上都有优势,具有一定的临床应用前景,但也存在不足之处,待后续进一步研究完善。总之,目前自动检测方法并不能完全的替代人工检测,但两者相结合可以大幅度的提高检测效率,减轻临床医师的工作强度,具有广阔的应用前景。
参考文献:
[1] Kikano G E, Fabien A, Schilz R. Evaluation of the solitary pulmonary nodule[J]. Am Fam Physician, 2015, 92(12): 1084 1091A.
[2] MacMahon H, Naidich D P, Goo J M, et al. Guidelines for management of incidental pulmonary nodules detected on CT images: from the Fleischner Society[J]. Radiology, 2017, 284(1): 228 243.
[3] Elia S, Loprete S, De Stefano A, et al. Does aggressive management of solitary pulmonary nodules pay off? European Respiratory Society[J]. Breathe, 2019, 15(1): 15 23.
[4] Iaccarino J M, Wiener R S. Pulmonary nodule guidelines[J]. Chest, 2017, 152(2): 232 234.
[5] Gould M K, Donington J, Lynch W R, et al. Evaluation of individuals with pulmonary nodules: when is it lung cancer? Diagnosis and management of lung cancer, 3rd ed: american college of chest physicians evidence-based clinical practice guidelines[J]. Chest, 2013, 143(5): e93S e120S.
[6] Sim Y T, Poon F W. Imaging of solitary pulmonary nodule-a clinical review[J]. Quant Imaging Med Surg, 2013, 3(6): 316 326.
[7] Rubin G D. Lung nodule and cancer detection in CT screening[J]. J Thorac Imaging, 2015, 30(2): 130 138.
[8] Zhang C C, Shen Y, Kong Q, et al. A novel algorithm for segmentation of solitary pulmonary nodules in chest computed tomography based on three-Dimensional connected voxels[J]. Journal of Medical Imaging and Health Informatics, 2019, 9(8): 1622 1629.
[9] 金文忠, 陆耀, 汪阳. 基于人工智能的胸部CT智能辅助诊断系统在LDCT数据集上的应用研究[J]. 中国医学计算机成像杂志, 2018, 24(5): 373 377.
[10] El-Baz A, Beache G M, Gimelfarb G, et al. Computer-aided diagnosis systems for lung cancer: challenges and methodologies[J]. Int J Biomed Imagin, 2013(1): 1 406.
[11] Sluimer I, Schilham A, Prokop M, et al. Computer analysis of computed tomography scans of the lung: a survey[J]. IEEE Trans Med Imaging 2006, 25(4): 385 405.
[12] Armato S G, Sensakovic W F. Automated lung segmentation for thoracic CT: impact on computer-aided diagnosis[J]. Acad Radiol, 2004, 11(9): 1011 1021.
[13] Setio A A, Ciompi F, Litjens G, et al. Pulmonary nodule detection in CT images: false positive reduction using multi-view convolutional networks[J]. IEEE Trans Med Imaging, 2016, 35(5): 1160 1169.
[14] Setio A A, Jacobs C, Gelderblom J, et al. Automatic detection of large pulmonary solid nodules in thoracic CT images[J]. Med Phys, 2015, 42(10): 5642 5653.
[15] Nasrullah N, Sang J, Alam MS, et al. Automated lung nodule detection and classification using deep learning combined with multiple strategies[J]. Sensors, 2019, 19(17): 274 276.
[16] 李欣菱, 郭芳芳, 周振, 等. 基于深度學习的人工智能胸部CT 肺结节检测效能评估[J]. 中国肺癌杂志, 2019, 22(6): 336 340.
Comparative Analysis of the Efficacy of Automatic Detection Program and Manual Detection for Pulmonary Nodules
HOU Qiuyu, ZHANG Chence, LI Huijian, LIU Fangbo, YUAN Na
(Qingdao 8th People′s Hospital, Qingdao 266000, China)
Abstract: In view of the difference between automatic and manual detection of pulmonary nodules, this paper compared and analyzed the efficacy of automatic and manual detection for pulmonary nodules. A total of 600 cases of chest CT plain scan were collected from The 8th People′s Hospital of Qingdao from February 2019 to October 2019, and the number and size of pulmonary nodules detected by two deputy chief physicians who had been engaged in imaging diagnosis for more than 20 years were taken as the reference standard. The detection rate, average reading time and false positive rate of pulmonary nodules in group A (one associate chief physician andone attending physician) and group B (automatic pulmonary nodules detection program system) were compared. The results showed that the detecting rate of group B was higher than that of group A, with statistically significant difference (P<0.05), and the false positive rate of group A was higher than that of group B, with statistically significant difference (P<0.05). In terms of the detection of nodules of different sizes, the difference in the detecting rate of nodules <3 mm in both group A and group B was statistically significant (P<0.05), while the difference in the detecting rate of nodules ≥3 mm was not statistically significant (P>0. 05). The reading time of group A and Group B was (5.0±1.1) min and (1.3±0.2) min, respectively, with statistically significant difference (P<0.05). This study has guiding significance for the screening of pulmonary nodules.
Key words: pulmonary nodules; automatic detection; program; chest computed tomography (CT)

