不同年龄萎缩性胃炎患者血清PG、G17、NO及IL-6差异比较
郑洁 周复亮
慢性萎缩性胃炎是一种以胃黏膜腺体萎缩为特征的常见消化系统疾病。引起慢性萎缩性胃炎的病因和发病机制目前尚不十分清楚,一般认为与免疫因素、生物因素、药物因素等相关[1]。慢性萎缩性胃炎与胃癌的发生密切相关,科学研究发现,胃癌发展过程是:正常胃黏膜—慢性浅表性胃炎—慢性萎缩性胃炎—肠上皮化生—异型增生—胃癌[2]。所以早期发现和诊断慢性萎缩性胃炎有利于及时干预,从而降低胃癌发病风险。目前慢性萎缩性胃炎诊断的金标准是内镜检查[3]。但内镜检查为有创操作,患者常无法耐受,血清学检查是内镜检查的替代或辅助手段,具有无创、易实行的特点,可以帮助早期筛查和诊断慢性萎缩性胃炎[4]。目前慢性萎缩性胃炎血清学指标主要包括血清胃蛋白酶原(pepsinogen,PG)、胃泌素17(gastrin 17,G17)、一氧化氮(nitric oxide,NO)及白介素6(interleukin 6,IL-6)等,它们可客观反映胃黏膜的功能状态[5]。但不同年龄层次慢性萎缩性胃炎的患病率不同[6],所以推测其血清学指标PG、G17、NO 及IL-6 水平可能也有差异,本文就不同年龄层次慢性萎缩性胃炎患者PG、G17、NO 及IL-6 水平做了以下研究,现报道如下。
1 资料与方法
1.1 一般资料
选取2017 年3 月—2018 年3 月在我院就诊的慢性萎缩性胃炎病例2 500 例,其中男性1 450 例,女性1 050 例,年龄18~75 岁,平均年龄(55.63±8.62)岁。
1.2 纳入标准与排除标准
纳入标准:符合慢性萎缩性胃炎临床诊断标准,均经内镜和病理学活检明确诊断;年龄>18 岁。排除标准:合并心、肝、肾等重要脏器功能不全;合并胃溃疡、胃癌等其他胃部疾病;合并恶性肿瘤;胃部手术史;精神病或心理障碍;近2 周使用过治疗胃病的相关药物;临床资料不全;妊娠期或哺乳期。本研究经本院伦理委员会批准实施。
1.3 方法
1.3.1 分组 根据年龄将研究对象分为青年(18~40 岁)、中年(41~65 岁)、老年(≥66 岁)3 个组。
1.3.2 内镜检查 使用奥林巴斯胃肠镜系统CV-260SL+GIFH260+CF-H260AI(成贯仪器有限公司)进行检查,检查前5 min口服局部麻醉药利多卡因胶浆(国药准字H13021217,邯郸康业制药有限公司)10 g,插入内镜完成常规检查,发现可疑病变区域后,用西甲硅油(H20160184,Berlin-Chemie AG)和清水反复冲洗观察区域,以清楚泡沫和黏液,对可疑区域喷洒染色剂,对胃部结构、粘膜形态、染色情况进行观察,观察结束后,在胃窦、胃体、胃角各取组织1 块以备病理学活检。
1.3.3 病理学检查 将3 组患者所取组织用甲醛固定,进行脱水、包埋、苏木素—伊红染色,由2 名高年资病理科医生进行病理诊断,以两者意见一致为最终结果,诊断存在分歧时请上级医生协助诊断,直至意见一致。慢性萎缩性胃炎的病理诊断采用慢性胃炎共识[7]中关于病理学的诊断标准。
1.3.4 PG、G17、NO 及IL-6 检测方法 取患者清晨空腹静脉血8 mL,置于肝素抗凝管中,凝结后离心分离血清。使用乳胶免疫测定法(日立生化仪)、荧光免疫分析法(必欧瀚)检测患者PGI、PGII 和G17 水平,使用电化学发光法(罗氏免疫发光仪)检测患者血清NO 及IL-6 水平。
1.4 观察指标
比较3 组入组即刻的PGI、PGII、G17、NO 及IL-6 水平。
1.5 统计学方法
采用SPSS 20.0 进行统计学数据处理,计数资料用频数表示,比较用χ2检验,计量资料用()表示,两组间比较用t 检验,多组间比较采用单因素方差分析,各指标与年龄之间进行相关性检验。以P<0.05 表示差异有统计学意义。
2 结果
2.1 3 组患者一般资料比较
2 500 例慢性萎缩性胃炎患者中,青年组540 例,中年组850 例,老年组1 110 例。3 组患者性别、体重、吸烟、喝酒比例差异均统计学意义(P>0.05)。
2.2 3 组患者PGI、PGⅡ、G17 水平比较
3 组患者PGI、PGⅡ、G17 水平差异具有统计学意义,PGI、PGII 水平随年龄增长而升高,G17 水平随年龄增长而降低(P 均<0.05)。见表1。
2.3 3 组患者NO 及IL-6 水平比较
3 组患者NO 及IL-6 水平差异具有统计学意义,NO 随年龄增长而降低,IL-6 水平随年龄增长而升高(P均<0.05)。见表2。
表1 3 组患者PGI、PGII、G17 水平的比较(μg/L,)

表1 3 组患者PGI、PGII、G17 水平的比较(μg/L,)
表2 3 组患者NO 及IL-6 水平的比较()
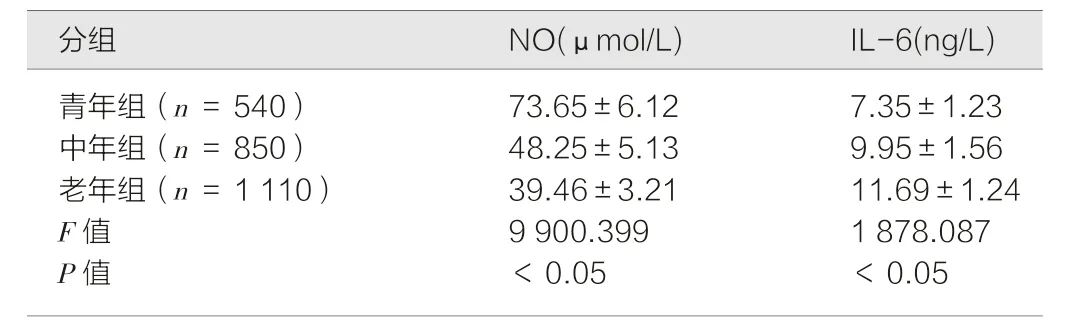
表2 3 组患者NO 及IL-6 水平的比较()
2.4 PGI、PGII、G17 水平与年龄的相关性分析
PGI、PGII、IL-6 水平与年龄呈正相关,而G17、NO 水平与年龄呈负相关(P均<0.05)。见表3。

表3 PGI、PGII、G17、NO 及IL-6 水平与年龄的相关性分析
3 讨论
慢性萎缩性胃炎患者血清学检查不仅可以用于胃癌的筛查,还可以评估胃分泌功能,判断胃黏膜病变程度,作为不能耐受内镜检查人群的替代检查、指导胃病患者合理用药等,所以其应用价值受到越来越多关注[8]。有研究发现[9-10],慢性萎缩性胃炎患者血清学参数PGI、PGII、G17 与年龄密切相关,但目前关于慢性萎缩性胃炎患者NO 及IL-6 水平与年龄关系的研究尚少。本研究综合对比不同年龄层次PGI、PGII、G17、NO 及IL-6 的水平发现,随着年龄的增长PGI、PGII、IL-6 水平逐渐升高,与年龄呈正相关,而G17 和NO 水平则逐渐下降,与年龄呈负相关(P均<0.05)。
PG 是胃蛋白酶的前体,根据其生化性质和免疫原性将其分成2 个亚群,1~5 组分的免疫原性相同,称为胃蛋白酶原Ⅰ,主要由胃底腺的主细胞和黏液颈细胞分泌;组分6 和7 被称为胃蛋白酶原Ⅱ,除由胃底腺的主细胞和黏液颈细胞分泌外,贲门腺和胃窦的幽门腺的黏液颈细胞以及十二指肠上段也能产生胃蛋白酶原Ⅱ[11]。通常情况下,约有1%的PG 透过胃黏膜毛细血管进入血液循环,进入血液循环的PG 在血液中非常稳定。血清PG Ⅰ和PGⅡ反映胃黏膜腺体和细胞的数量,也间接反映胃黏膜不同部位的分泌功能,当胃黏膜发生病理变化时,血清PG 含量也随之改变,因此,监测血清中PG 的浓度可以作为监测胃黏膜状态的手段[12]。PG Ⅰ是检测胃泌酸腺细胞功能的指标,胃酸分泌增多时PG Ⅰ升高,分泌减少或胃粘膜腺体萎缩时PG Ⅰ降低;PGII 与胃底粘膜病变的相关性较大,其升高与胃底腺管萎缩、胃上皮化生或假幽门腺化生、异型增值有关[13]。G17 由胃窦部G 细胞分泌,是人体内有生物活性胃泌素的主要成分,其分泌主要受胃内pH 值、G 细胞数量和进食的影响,能促进胃酸分泌,可以反映胃黏膜分泌功能和胃酸的负反馈调节状态[14]。PG 和G17 功能互补,能帮助更全面的了解胃黏膜的功能状态。郭会玲等[10]的研究显示,慢性萎缩性胃炎患者的PG Ⅰ、PGⅡ水平随着年龄的增长而升高,G17 水平随年龄增长而下降。本研究结果显示,不同年龄阶层慢性萎缩性胃炎患者的PG Ⅰ、PGⅡ、G17 水平差异很大,PG Ⅰ、PGⅡ水平随着年龄增长呈上升趋势,与年龄呈正相关,G17 水平随着年龄增长呈下降趋势,与年龄呈负相关(P均<0.05),本研究结果与郭会玲等的研究结果一致。说明年龄对PGI、PGⅡ、G17 水平影响较大。这是因为慢性萎缩性胃炎患者其胃酸分泌量随年龄的增长而升高,胃酸的大量分泌使胃内PH 值降低,反射性刺激主细胞分泌更多的PG[10],而且随着年龄的增长前列腺素水平下降,使本来可以被前列腺素抑制的胃酸和PG 分泌增多[15]。另一方面,随着年龄的增长,慢性萎缩性胃炎患者胃酸分泌增多,可开启机体负反馈调节机制,抑制胃窦部G 细胞分泌G17,使G17 水平降低[16],这也侧面反映了慢性萎缩性胃炎患病率与年龄呈正相关的原因。
NO 广泛分布于生物体内各组织中,是一种极不稳定的生物自由基,分子小,结构简单,具有脂溶性,可快速透过生物膜扩散,在血管调节、神经、免疫调节、胃黏膜的损伤修复等方面有着十分重要的生物学作用[17]。IL-6 是一种细胞因子,属于白细胞介素的一种。它是由纤维母细胞、单核/巨噬细胞、T 淋巴细胞、B 淋巴细胞、上皮细胞、角质细胞以及多种瘤细胞所产生。IL-6 也有很多生物学活性,能促进T 细胞增殖,B 细胞分化,还参与各种炎症反应[18]。有研究显示,NO 和IL6 水平与幽门螺旋杆菌感染密切相关,NO 水平与幽门螺旋杆菌感染呈负相关,而IL6 水平与幽门螺旋杆菌感染呈正相关[19-20]。而随着年龄的增长,幽门螺旋杆菌感染率越来越高,作用也逐渐增强[6]。所以本研究推测随着年龄的增长NO 水平会逐渐下降,而IL6 水平逐渐升高。本研究结果显示,不同年龄层次慢性萎缩性胃炎患者NO 和IL6 水平有很大差异,NO 水平随年龄增长而下降,与年龄呈负相关,而IL6 水平随年龄增长而升高,与年龄呈正相关(P均<0.05),该结果证实了本研究的猜想,说明不同年龄层次的慢性萎缩性胃炎患者的NO和IL6 水平不同。其原因可能是随着年龄的增长,机体抵抗力下降,自理能力更差,个人卫生问题较中青人更差,使幽门螺旋杆菌感染率增加[6]。幽门螺旋杆菌感染,可刺激机体分泌更多的缩血管物质和炎症介质[20-21],舒血管物质NO 减少,机体发生一系列炎症反应,使胃黏膜血供减少,血管内皮损伤,进一步加重胃黏膜的损伤,从而使慢性萎缩性胃炎的发病率增加[22]。
综上所述,不同年龄层次慢性萎缩性胃炎患者血清PG、G17、NO 及IL-6 水平有明显差异,随着年龄的增长PGI、PGII、IL-6 水平呈上升趋势,与年龄呈正相关,而G17、NO 水平呈下降趋势,与年龄呈负相关。

