响应面法优化鼠李果实多糖提取工艺
周巍,赵彦鹏
(信阳农林学院 农学院,河南 信阳464000)
鼠李(RhamnusdavuricaPall),鼠李科鼠李属植物,落叶小乔木或灌木,生于山坡林下,在我国分布广泛,河南、山西、吉林等省均有分布[1]。鼠李有重要的药用价值,它可用于清热利湿、消积通便等症状。研究表明[2],鼠李果实中含有大黄素、大黄酚、萜类化合物、有机酸、多糖类等多种物质。多糖是一种重要的生命活性物质,多糖因具有优良的抗自由基功能以及抗肿瘤作用[3],在食用和医学方面具有广泛应用。多糖也是很好的免疫增强剂,该特性对新型医药产品的研发提供了思路[4]。但迄今为止,国内外对鼠李果实多糖的研究还未见报道,因此,本研究通过响应面法优化鼠李果实多糖的提取工艺,以期对鼠李果实多糖资源的进一步开发利用提供了理论和实践参考[5]。
1 材料与方法
1.1 材料与试剂
材料:鼠李果实,产地河南,采自河南省信阳市金牛山。选取干燥果实,用粉碎机完全粉碎后过100目筛,备用。试剂:5 %苯酚(现配现用),丙酮、乙醚、葡萄糖、无水乙醇、浓硫酸均为国产分析纯。
1.2 实验仪器

表1 使用的主要仪器
1.3 试验方法
1.3.1 鼠李果实粗多糖提取工艺流程 鼠李果实粉末→热水浸提→离心取上清液→减压浓缩→加4倍无水乙醇→丙酮、乙醚洗涤沉淀→真空干燥→鼠李果实粗多糖。
1.3.2 标准曲线的绘制 用电子分析天平准确称取葡萄糖(预先在105 ℃下经干燥至恒重)2.5000 g于500 mL容量瓶中,用蒸馏水定容,室温下放置30 min,待充分溶解后移取2 mL,定容于100 mL容量瓶中。得浓度为100μg/mL的葡萄糖标准溶液。分别用移液管移取0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8 mL的标准溶液于20 mL具塞试管中,加水至2 mL,摇匀,然后加入1mL体积分数5 %苯酚,摇匀后,加入5 mL浓硫酸,振荡摇匀后放于试管架上,室温下放置15 min左右。以2 mL蒸馏水为空白对照,在波长490 nm条件下测定溶液的吸光度[6]。作浓度-吸光度曲线图,如图1。通过回归分析得到线性回归函数为:Y=0.0124S+0.1577,R2=0.9963。
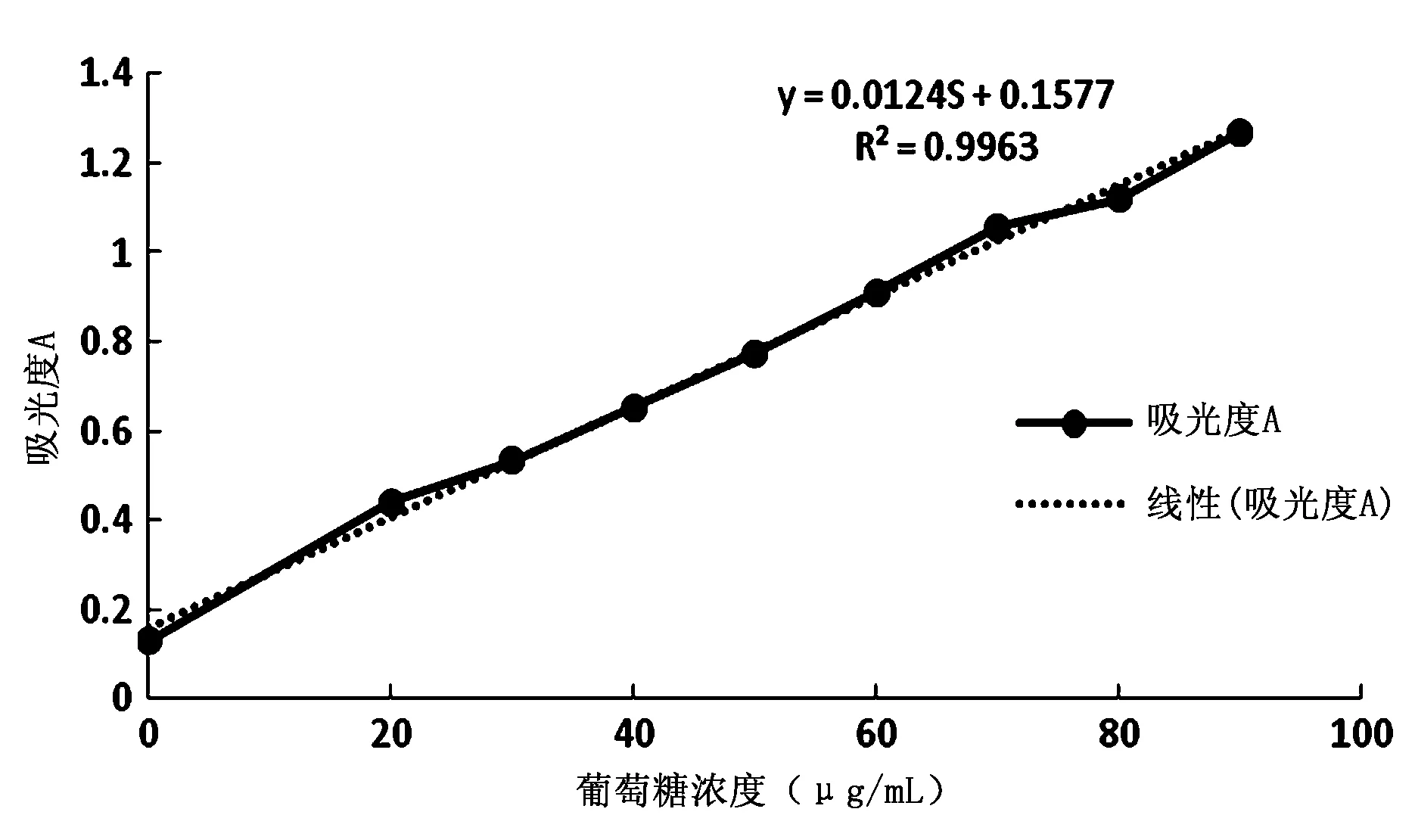
图1葡萄糖标准曲线
1.3.3 多糖的测定 多糖测定采用苯酚-硫酸法[7]。由图1可知浓度-吸光度的函数方程为:Y=0.0124S+0.1577,R2=0.9963,Y为吸光度/(A), S为葡萄糖浓度/(μg/mL)。鼠李果实多糖提取率计算公式如下:
1.3.4 单因素试验 液料比对多糖提取率的影响:准确称取1.0000 g鼠李果实粉末,设置梯度液料比为45:1、50:1、55:1、60:1、65:1(mL/g),水浴时间设定为1.5 h,水浴温度设定为80 ℃,在恒温水域锅中提取,冷却离心(3000 r/min),取2 mL上清液于15 mL具塞管中,加1 mL苯酚,5 mL浓硫酸,室温下放置15 min,测定溶液吸光度值。
提取温度对多糖提取率的影响:准确称取1.0000 g鼠李果实粉末,加入55 mL蒸馏水,水浴时间设定为1.5 h,提取温度为50 ℃、60 ℃、70 ℃、80 ℃、90 ℃, 在恒温水域锅中进行提取,冷却离心(3000 r/min)。取2 mL上清液于15 mL具塞管中,加1 mL苯酚,5 mL浓硫酸,室温下放置15 min,测定溶液吸光度值。
提取时间对多糖提取率的影响:准确称取1.0000 g鼠李果实粉末,加入55 mL蒸馏水,设置提取温度80 ℃,设置梯度提取时间为0.5、1.0、1.5、2.0、2.5 h,在恒温水域锅中进行提取,冷却离心(3000 r/min)。取2 mL上清液于15 mL具塞管中,加1 mL苯酚,5 mL浓硫酸,室温下放置15 min, 测定溶液吸光度值。
1.3.5 响应面实验 结合单因素实验数据,设计三因素优化鼠李果实多糖提取率的响应面实验。利用Design-Expert软件,根据Box-Benhnken实验设计原理,建立多元二次回归模型方程,用多项式对本实验中三个因素与指标的相互关系进行近似拟合,通过对回归函数的分析及各因素相互作用的响应面图形分析来寻求最佳工艺参数。
2 结果与分析
2.1 单因素试验
2.1.1 液料比对鼠李果实多糖提取率的影响 由图2可知,在液料比较小时考虑到多糖未能充分溶解,所以多糖提取率随液料比的增大而逐渐增加,在液料比达到55:1时,再增加液料比时多糖的提取率变化不大,不再有明显的波动情况。因此在考虑成本的情况下取液料比55:1为最佳条件。

图2液料比对鼠李果实多糖提取率的影响 图3提取温度对鼠李果实多糖提取率的影响
2.1.2 提取温度对鼠李果实多糖提取率的影响 如图3可知,在设定条件范围内,随着提取温度的升高多糖提取率逐渐提高,在温度达到70 ℃时提取率达到峰值,之后增加温度多糖提取率逐渐下降,可能是过高的温度导致多糖降解。因此,最佳温度条件设定为70 ℃。
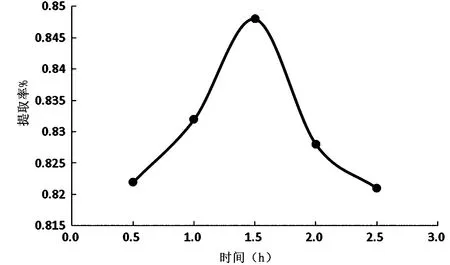
图4提取时间对鼠李果实多糖提取率的影响
2.1.3 提取时间对鼠李果实多糖提取率的影响 如图4可知,当提取时间达到1.5 h时,鼠李果实多糖提取率达到最大值。在低于1.5 h时多糖提取率随着提取时间的增加逐渐提高,在高于1.5 h时多糖提取率逐渐下降,可能是过长的时间导致多糖分解。因此,最佳提取时间选取1.5 h。
2.2 响应面试验
2.2.1 分析因素的选择及分析方案 根据单因素实验结果确定以下三个因素的三个不同编码水水平进行鼠李果实多糖提取工艺响应面优化设计方案[8],如表2所示。

表2 响应面分析因素与水平表
实验方案及结果如表3所示。

表3 实验方案及实验结果
2.2.2 模型方程的建立与显著性检验 使用Design-Expert8.0.6软件对表3中鼠李果实多糖提取率进行多元回归拟合,得到回归方程:
Y=1.11+0.098·A-1.625·10-3·B-2.500·10-3·C-2.250·10-3·AB+3.500·10-3AC-4.500·10-3·BC-0.10·A2-0.10·B2-0.10·C2;方程反映了提取时间、液料比、提取温度与提取率的关系。
2.2.3 响应面回归模型的方差分析 对鼠李果实多糖提取率的回归模型进行方差分析,结果如表4。
从表4可知,模型P<0.001<0.01,方程回归极显著;该回归方程相关系数R2=0.9993,又因为该模型的失拟项P=0.0997>0.05,说明模型拟合度高,可以用来描述鼠李果实多糖提取率与其影响因素之间的关系,该试验方法可靠[9]。另外,FA>FC>FB,说明液料比对鼠李果实多糖提取率影响最大,其次是提取温度,提取时间影响最小。

表4 方差分析
注:**为及其显著(P<0.01);*为显著(0.01 2.2.4 多糖提取率的响应面分析 由表4可知,模型中一次项A的P<0.0001, 说明差异极显著;一次项B的P>0.05, 差异不显著。FA>FB表明液料比比提取时间对鼠李果实多糖的提取率影响更大。 由图6可知,存在液料比和提取温度的最佳组合,但液料比的变化趋势比提取温度的变化趋势显著,这显示液料比对鼠李果实多糖提取率的影响更大。 图5Y=f(A,B)的响应面 图6Y=(A,C)的响应面 图7Y=(B,C)的响应面 图7表明,提取温度和提取时间所构成的响应面图形有最高点,两因素交互作用显著,所以二者存在最优组合[9-10];另外曲面的变化趋势也十分相似,但提取温度比提取时间略微陡峭一点,因此提取温度对鼠李果实多糖提取率的影响更大些。 图5、图6、图7直观地反映了液料比、提取温度、提取时间三个因素的交互作用对响应值的影响,综合分析可以看出提取时间和提取温度(BC)交互作用曲面的坡度最陡峭,表明其对鼠李果实多糖提取率的交互作用最明显。 2.2.5 最佳工艺条件的优化 利用Design-Expert8.0.6软件进行数据优化,鼠李果实多糖提取的最佳工艺组合为:液料比为53:1,提取时间为1.5 h,提取温度为69.80 ℃,考虑到实际试验的可操作性,鼠李果实多糖提取的最优工艺参数为:液料比为53:1,提取时间为1.5 h,提取温度为70 ℃,此时鼠李果实多糖的理论提取率为1.0501 %。 2.2.6 验证性实验 为验证理论结果的准确性,按照理论条件进行了3次验证试验,3次试验结果表明鼠李果实多糖的提取率平均值为1.0508 %,与上述预测值1.0501 %相对误差较小。 为探讨鼠李果实多糖的最佳提取工艺,在单因素试验的基础上,利用Design-Expert软件,依据Box-Benhnken原理,对鼠李果实多糖提取工艺进行了优化,结果显示,鼠李果实多糖的最佳提取工艺条件为:液料比为53:1,提取时间为1.5 h,提取温度为69.80 ℃,考虑到实际试验的可操作性,鼠李果实多糖提取的最优工艺参数为:液料比为53:1,提取时间为1.5 h,提取温度为70 ℃,此时鼠李果实多糖的理论提取率为1.0501%。经验证试验表明实验结果是可行的。所以说利用响应面法优化鼠李果实多糖的工艺参数可靠有效,可为进一步研究鼠李果实多糖提供参考。 由于实验中提取的是粗多糖,多糖的生物活性与其结构密切相关,所以不同的多糖具有不同的生物活性。因此后续还需要进一步研究其组成、结构等。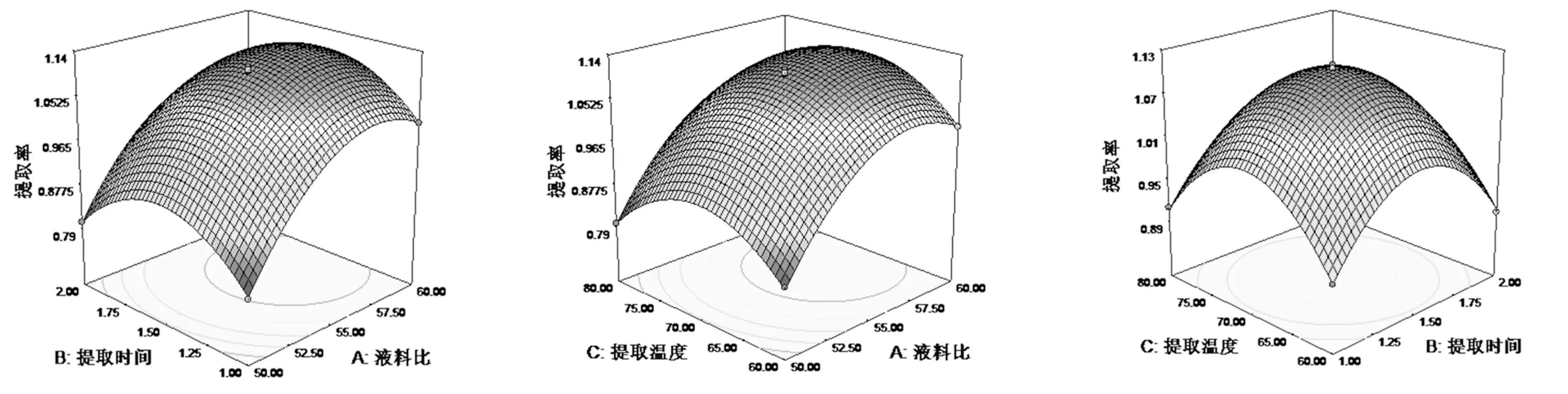
3 讨论与结论

