BMSC-CM通过抑制Notch1信号通路促进神经干细胞的有效分化
童 祎,宋旆文,申才良,刘晓颖
脊髓损伤(spinal cord injury,SCI)是一种灾难性的、代价高昂的损伤,目前尚无有效的治疗方法[1]。细胞移植可能是治疗SCI的一种方法,神经干细胞(neural stem cells,NSCs)具有自我更新和分化为神经元、星形胶质细胞和少突胶质细胞的能力[2]。然而,当神经干细胞移植到受损的脊髓中时,这些细胞倾向于分化为星形胶质细胞[3]。根据最近的体外研究[4-5]显示骨髓间充质干细胞条件培养液(bone mesenchymal stem cell -conditioned medium,BMSC-CM)可以调节NSCs的分化过程。然而,BMSC-CM影响NSCs分化的分子机制尚待深入研究。Notch信号通路在中枢神经系统的发育中起着重要的作用[6],Notch1被认为是调节神经系统发育的重要信号分子,增加神经干细胞中Hes1、Hes5的表达可以抑制神经干细胞向神经元类细胞分化[7],促进神经干细胞向胶质细胞分化[8-9]。现着重研究Notch1-Hes1/5信号通路与BMSC-CM影响NSCs分化方面是否有关联。
1 材料与方法
1.1 材料
1.1.1实验动物 生24~48 h龄SD大鼠1只和80~100 g成年雄性SD大鼠1只,购自安徽医科大学实验动物科学研究所。
1.1.2主要试剂 DMEM/F12培养基(美国Gibco公司);DMEM低糖培养基(美国Gibco公司);胎牛血清(美国Hyclone公司);B-27(美国Invitrogen公司);表皮生长因子(epidermal growth factor,EGF)及碱性成纤维生长因子(basic fibroblast growth factor,bFGF)(美国Pepro Tech公司);100 U/ml青霉素/0.1 mg/L链霉素(德国PAN公司);小鼠抗大鼠巢蛋白(Nestin)抗体(美国Sigma公司);小鼠抗大鼠胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体、兔抗大鼠微管相关蛋白-2(microtubule associated protein-2,MAP-2)抗体(英国Abcam公司);CY3标记的山羊抗兔IgG、AlexaFlour-488标记的山羊抗小鼠IgG(武汉伊莱瑞特生物有限公司);Triton X-100(北京中杉金桥生物技术有限公司);DAPI染色液、免疫荧光一抗稀释液、免疫荧光二抗稀释液(上海碧云天公司);左旋氏多聚赖氨酸(美国Sigma公司);胰蛋白酶(美国Gibco公司);Jagged-Fc融合蛋白(美国R&D System公司);ECL蛋白显影液试剂盒、BCA蛋白定量检测试剂盒(美国Pierce公司)。
1.2 方法
1.2.1NSCs的分离、培养和鉴定 取新生24~48 h龄SD大鼠,脱臼法处死,在75%酒精中浸泡5 min,断头,取出大脑,分离脑膜剥除血管后剪碎脑组织至1 mm3大小,加入0.25%胰蛋白酶消化10 min,轻柔吹打混匀,经200目筛网过滤成单细胞悬液,然后以1 000 r/min离心5 min,弃除上清液,重悬沉淀,再以1 000 r/min离心5 min并弃除上清液,然后以3×105个/ml的密度将细胞接种于无血清的培养基上(DMEM/F12+2% B27+20 ng/ml bFGF+20 ng/ml EGF)并添加100 U/ml青霉素/0.1 mg/L链霉素,置于5%CO2、37 ℃细胞培养箱中培养,每隔3 d加入新鲜的培养基,1周后神经球直径达到约100 μm,进行传代。得到第2代神经球,接种于经0.1 mg/ml多聚赖氨酸包被的盖玻片,行免疫细胞化学荧光检测神经干细胞特异性蛋白(Nestin),证实所培养的细胞为大鼠神经干细胞。
1.2.2分离、培养BMSCs并制备BMSC条件培养液 参考本课题组前期的实验方法[4],取成年雄性SD大鼠1只(体质量80~100 g),从大鼠股骨和胫骨骨髓中分离培养BMSCs,将细胞以106个/ml的密度接种于含20%胎牛血清的DMEM培养基中,置于37 ℃、5% CO2的细胞培养箱中孵育。48 h后更换培养基,以后每3 d更换1次,丢弃未贴壁细胞。当贴壁细胞在新鲜培养基中培养至细胞融合率达到90%时,用0.25 %胰蛋白酶消化,重新悬浮后,以1 ∶2的比例传代。得到第3代生长良好的BMSCs,当贴壁率达90%时使用倒置显微镜观察其形态鉴定,见图1。将原培养液换成不含胎牛血清的DMEM/F12再培养24 h,倒出培养液,最后用直径0.22 μm的孔滤器过滤获得所需条件培养基。
图1 第3代骨髓间充质干细胞的成纤维细胞形态 ×200
1.2.3NSCs的分组及分化培养 将生长良好的第2代NSCs接种在有0.1 mg/ml多聚赖氨酸包被处理盖玻片的6孔板中培养,每孔细胞数约2×104个,先用DMEM/F12 +B27培养基培养12 h,然后根据实验设计将NSCs分为四组,分别为:①对照组(NSCs)、 Jagged组(NSCs+1 μg/ml Jagged)、BMSC-CM组(NSCs+BMSC-CM)、 BMSC-CM+Jagged组(NSCs+BMSC-CM+1 μg/ml Jagged)。置于37 ℃、5%CO2细胞培养箱中培养,每3 d换液1次。1周后对分组培养的细胞行免疫荧光染色实验。
1.2.4NSCs的免疫荧光染色 实验应用免疫荧光染色技术检对检测细胞的神经元和神经胶质细胞的特异性标志物MAP-2及GFAP。取出样本,用0.01 mol/L的PBS洗3次,每次5 min,常温下用4%多聚甲醛固定15~20 min,吸去多余残液,再用PBS洗3次,每次5 min。含0.1% Triton X-100的PBS孵育20 min后,用PBS洗3次,每次5 min。加入正常山羊血清工作液,置于37 ℃恒温培养箱中孵育1 h,然后加入1 ∶500稀释的MAP-2一抗,1 ∶1 000稀释的GFAP一抗,在4 ℃冰箱内孵育过夜。第2天,取出标本,常温下放置1 h后PBS洗3次,每次5 min。分别加入1 ∶200稀释的特异性二抗CY3及Alexa Flour-488,在37 ℃恒温培养箱中孵育1 h。取出标本,PBS洗3次,每次5 min。最后,室温下用DAPI孵育10 min对细胞核染色。将载玻片用PBS漂洗3次,封片,荧光显微镜观察、拍照。
1.2.5Western blot分析 分别提取各组NSCs分化后细胞总蛋白,用BCA蛋白定量检测试剂盒测定各组蛋白含量,根据蛋白浓度选择上样量,依此行SDS-PAGE凝胶电泳,PVDF转膜,非特异性封闭。加入一抗,所用抗体及稀释度:抗MAP-2(1 ∶200稀释),抗GFAP(1 ∶500稀释),β-actin(1 ∶1 000稀释),抗Notch1(1 ∶200稀释),抗Notch胞内结构域(notch intracellular domain,NICD)(1 ∶1 000稀释)抗hes1(hairy and enhancer of split1)(1 ∶200稀释),抗Hes5(hairy and enhancer of split5)(1 ∶200稀释)。于4 ℃冰箱孵育过夜,第2天用TBST洗膜4次,再加入相应的二抗,室温孵育1 h,用TBST洗膜4次,用ECL化学发光显影并行胶片定影处理,用Super Signal West Femto最大灵敏度底物检测系统(美国Pierce公司)来观察免疫反应带,用Epson V200和Quantity One对实验结果进行统计分析。
2 结果
2.1 NSCs鉴定体外分离的细胞原代培养至7 d左右,可见培养瓶中细胞形成球形集落,对取贴壁后的NSCs细胞球行神经干细胞特异性蛋白Nestin荧光染色检测,结果示贴壁细胞中大多细胞呈Nestin阳性表达,见图2。
2.2 BMSC-CM对NSCs分化的影响第2代NSCs球接种后,培养7 d,细胞免疫荧光检测显示四组NSCs分化为MAP-2表达阳性的神经元和GFAP表达阳性的星形胶质细胞,见图3。与对照组相比,BMSC-CM组的MAP-2阳性细胞显著增加,GFAP阳性细胞显著减少。与对照组相比,Jagged组 MAP-2阳性细胞明显减少,GFAP阳性细胞明显增加。而BMSC-CM+Jagged组较Jagged组MAP-2阳性细胞显著增加,GFAP阳性细胞显著减少。BMSC-CM+Jagged组较BMSC-CM组MAP-2阳性细胞显著减少,GFAP阳性细胞显著增加,见图4、表1。Western blot分析显示BMSC-CM组与对照组相比, MAP-2蛋白表达水平显著增加,GFAP蛋白表达水平显著减少。与对照组相比,Jagged组MAP-2蛋白表达水平明显减少,GFAP蛋白表达水平明显增加。而BMSC-CM+Jagged组较Jagged组MAP-2蛋白表达水平明显增加,GFAP蛋白表达水平明显减少。BMSC-CM+Jagged组较BMSC-CM组MAP-2蛋白表达水平显著减少,GFAP蛋白表达水平显著增加,见图5、6和表2。BMSC-CM促进NSCs的有效分化。
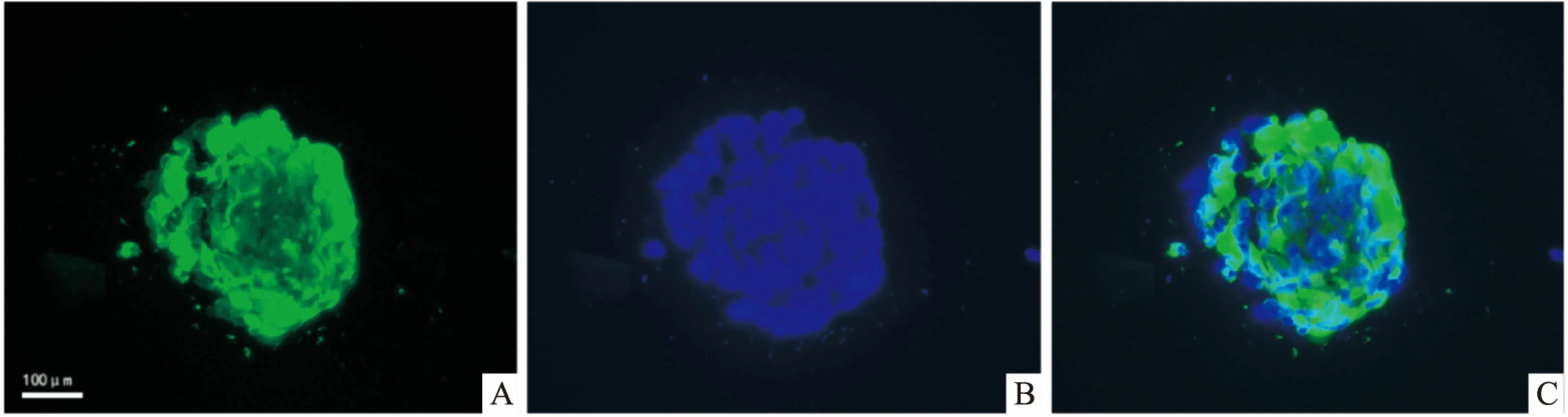
图2 神经干细胞的免疫荧光鉴定 ×400A:Nestin蛋白表达水平;B:DAPI蛋白表达水平;C:融合图像显示神经球中有大量Nestin蛋白表达
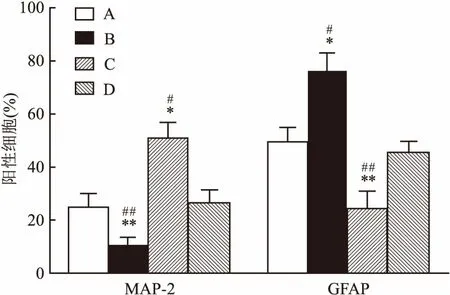
图4 NSCs在不同分化培养基中分化后MAP-2阳性细胞率及GFAP阳性细胞率
A:对照组;B:Jagged组;C:BMSC-CM组;D:BMSC-CM+Jagged组;与对照组比较:*P<0.05,**P<0.01;与BMSC-CM+Jagged组比较:#P<0.05,##P<0.01
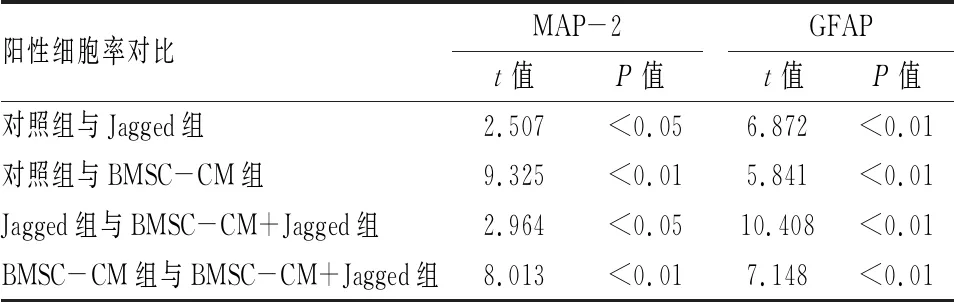
表1 NSCs在不同分化培养基中MAP-2阳性细胞率及GFAP阳性细胞率比较
2.3 在BMSC-CM与NSCs共培养时Notch1信号通路被抑制为研究Notch1信号通路在BMSC-CM与NSCs共培养中的作用,采用Western blot方法检测四组样本的Notch1通路相关蛋白的表达。见图6。结果显示:BMSC-CM组与对照组相比, Notch1、NICD、Hes1、Hes5蛋白表达水明显著减少;Jagged组与对照组相比,Notch1、NICD、Hes1、Hes5的蛋白表达水平明显增加;BMSC-CM+Jagged组较Jagged组Notch1、NICD、Hes1、Hes5的蛋白表达水平明显减少;BMSC-CM+Jagged组较BMSC-CM组Notch1、NICD、Hes1、Hes5的蛋白表达水平明显增加。见图7、8和表3。
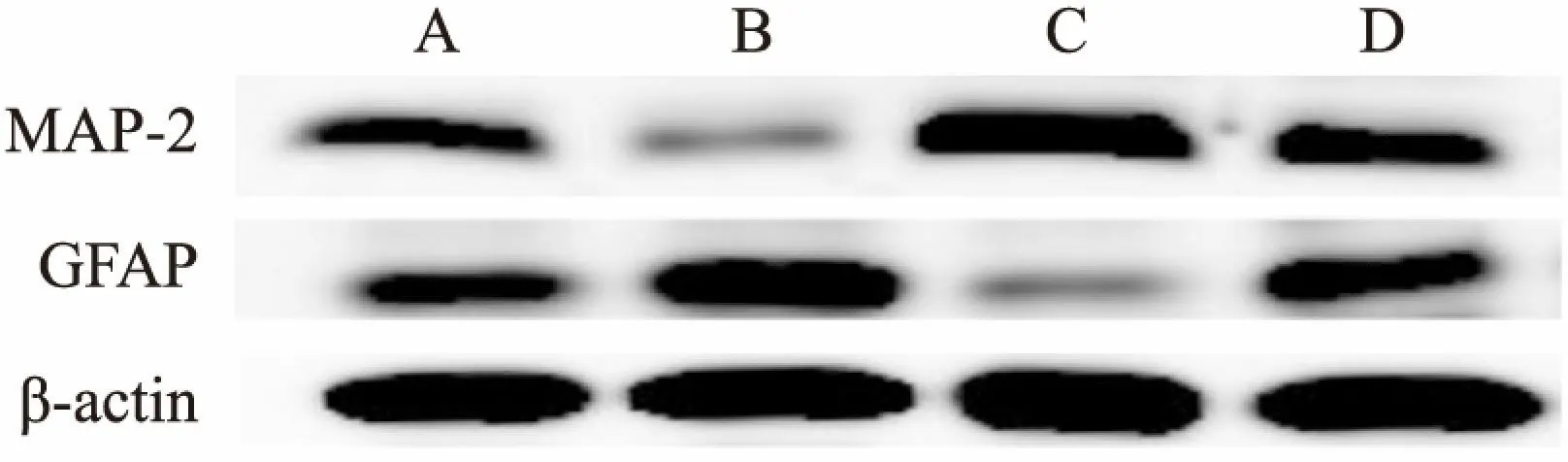
图5 NSCs在不同分化培养基中分化后的MAP-2及GFAP蛋白条带A:对照组;B:Jagged组;C:BMSC-CM组;D:BMSC-CM+Jagged组
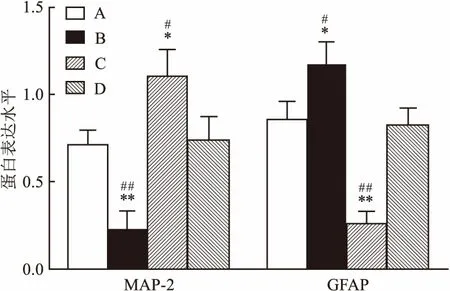
图6 NSCs在不同分化培养基中分化后MAP-2及GFAP蛋白表达水平
A:对照组;B:Jagged组;C:BMSC-CM组;D:BMSC-CM+Jagged组;与对照组比较:*P<0.05,**P<0.01;与BMSC-CM+Jagged组比较:#P<0.05,##P<0.01
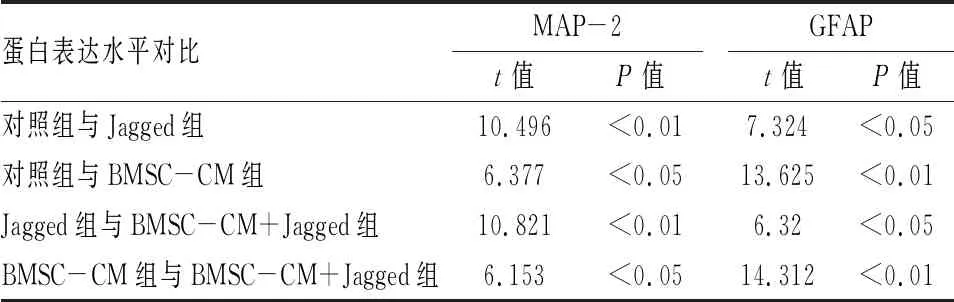
表2 NSCs在不同分化培养基中分化后MAP-2及GFAP蛋白表达水平的比较
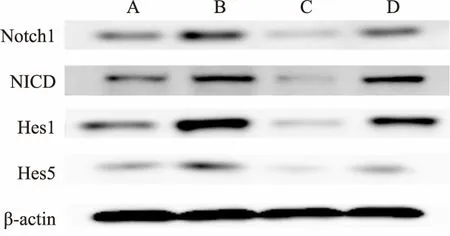
图7 NSCs在不同分化培养基中分化后Notch1通路相关蛋白条带A:对照组;B:Jagged组;C:BMSC-CM组;D:BMSC-CM+Jagged组
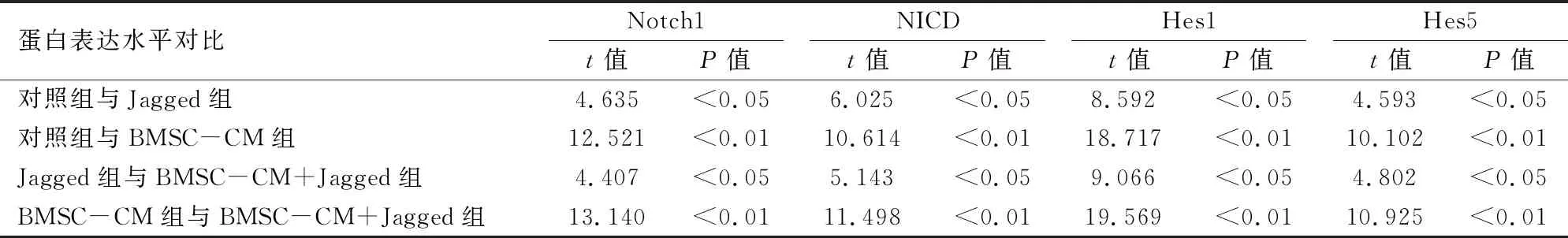
表3 NSCs在不同分化培养基中分化Notch1通路相关蛋白表达水平的比较

图8 NSCs在不同分化培养基中分化后Notch1通路相关蛋白表达水平
A:对照组;B:Jagged组;C:BMSC-CM组;D:BMSC-CM+Jagged组;与对照组比较:*P<0.05,**P<0.01;与BMSC-CM+Jagged组比较:#P<0.05,##P<0.01
3 讨论
本研究探讨了BMSC-CM对NSCs分化的调控及可能机制。与对照组相比,用BMSC-CM培养NSCs 7 d后,通过细胞免疫荧光和Western blot分析显示MAP-2蛋白表达水平比例增加,GFAP蛋白表达水平比例减少。这些结果表明,BMSC-CM对NSCs的分化有影响,显著增加神经元的比例,减少星形胶质细胞的比例。将BMSCs移植到受损的中枢神经系统中,可促进神经功能的恢复。以往的研究[10]表明,BMSCs在损伤后移植到小鼠脊髓内,导致空洞体积明显缩小,小鼠的运动和感觉恢复得到了改善。BMSCs与NSCs在体外共培养时,可以提供指导NSCs分化和促进轴突发育的指导性信号[11],且BMSC-CM在体外对神经元分化具有与BMSC相同的作用[12]。Notch信号通路可以调控NSC的自我更新、神经发生和胶质发生,激活Notch信号通路可以促进神经胶质发生,抑制NSC的神经发生[13]。本研究以BMSC-CM组及BMSC-CM+Jagged组作为实验组,通过BMSC-CM抑制被Jagged激活的Notch1通路,证明了BMSC-CM影响NSCs分化的潜在机制。Jagged是Notch1通路主要配体之一,Jagged蛋白能增加Notch1通路配体数量,直接激活Notch1通路。Notch信号通路主要通过跨膜受体(Notch1、Notch2、Notch3、Notch4)与相邻细胞表面的跨膜配体(Jagged l,2和Delta-like 1,3,4)的物理结合激活。经肿瘤坏死因子α-转化酶作用,然后激活γ-分泌酶(γ-Secretase)[14],促进NICD的释放,NICD转移至胞核内与转录抑制因子RBP-J结合,诱导下游靶基因(Hes1、Hes5等)的表达。为进一步研究其作用机制,通过应用Notch1信号通路的特异性激活剂(Jagged融合蛋白)激活Notch1信号通路,通过免疫荧光和Western blot分析观察上调Notch1信号通路对NSCs分化的影响。结果显示,加入Jagged时Notch1信号后被激活,Notch1、NICD、Hes1、Hes5表达量明显上调,NSCs向神经元分化减少,NSCs向星形胶质细胞分化增多。BMSC-CM组的Notch1、NICD、Hes1、Hes5表达量明显降低,Notch1通路被抑制,从而调控了NSCs分化。BMSC-CM+Jagged组Notch1、NICD、Hes1和Hes5的表达较Jagged组明显降低。这些结果表明,BMSC-CM可能是通过抑制Notch1信号通路调节NSCs的分化。此外,Notch1信号通路可能不是调节NSCs分化的唯一途径,在BMSCs调控NSCs分化的过程中有多种信号通路参与,不同信号通路之间存在交叉作用。BMSC-CM可通过抑制BMP-4-smad1/5/8信号通路来调节NSCs的分化,增加神经元的生成[5],减少星形胶质细胞的生成。因此联合调控BMP4-SMAD1/5/8信号通路和Notch信号通路对NSCs的有效分化可能存在协同作用。目前BMSCs调控NSCs分化的机制尚没有完全清楚,Notchl、Jaggedl、Hes1和Hes5可能是参与该调控的作用靶点,这为BMSC-CM诱导NSCs分化提供了新的理论支持。

